Schwermetalle
Schwermetalle sind unter uneinheitlichen Definitionen[1] zusammengefasste Metalle, deren Dichte oder Atommasse einen bestimmten Wert übersteigt. Teilweise werden in die Definition noch weitere Eigenschaften wie Ordnungszahl und Toxizität einbezogen.[2] Viele Quellen stufen als Schwermetall ein Metall ein, dessen Dichte größer als 5,0 g/cm³ oder – bei älteren Quellen – größer als 4,5 g/cm³ ist.[3][4][5][6]
| H | He | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
In der Kerntechnik wird „Schwermetall“ in zwei verschiedenen besonderen Bedeutungen verwendet:
Definitionen
In der Technik (nur NE-Metalle) und der Chemie fallen unter den Begriff „Schwermetall“ Metalle mit einer Dichte > 5 g/cm³.[8][9] Zu diesen werden üblicherweise unter anderem die Edelmetalle, die Basismetalle Eisen, Kupfer, Blei, Zink, Zinn und Nickel sowie Bismut, Cadmium, Chrom und Uran gerechnet. Eine Studie der IUPAC[10] fand jedoch mindestens 38 Definitionen für die Bezeichnung „Schwermetall“, die angefangen von der Dichte, dem Atomgewicht oder der Ordnungszahl bis zu den chemischen Eigenschaften oder der Toxizität reichen. Folglich unterscheiden sich Listen von „Schwermetallen“ von einem Satz von Richtlinien zu einem anderen; dabei werden oft auch Halbmetalle wie z. B. Arsen mit eingeschlossen. Die Bezeichnung wird oft ohne Angabe der Metalle, auf die sie sich bezieht, verwendet. Aus den oben aufgeführten Gründen ist die Bezeichnung aller anderen Metalle als Leichtmetalle ebenso undefiniert.[9] In der Öffentlichkeit gelten oft alle als „Schwermetall“ bezeichneten Stoffe (wobei deren Verbindungen und Legierungen häufig ebenfalls dazu gerechnet werden) als toxisch. Folgende Elemente haben eine Dichte über 5 g/cm³:
* Halbmetalle
** Da sich diese Elemente nicht in messbaren Mengen synthetisieren lassen, kann man viele ihrer Eigenschaften wie die Dichte nicht messen. Modellrechnungen legen jedoch Wertebereiche dieser Größen nahe.[11]
Die Tabelle enthält Elemente mit einer Dichte ab 5 g/cm³. Elemente mit bekannter Dichte zwischen 5 und 10 g/cm³ sind gelb, zwischen 10 und 20 g/cm³ orange und über 20 g/cm³ braun hinterlegt.
Vorkommen und Herkunft
Schwermetalle kommen in den Gesteinen der Erdkruste vor und sind dort in Erzen als Oxide, Sulfide und Carbonate fest eingebunden und auch in Silikaten eingeschlossen oder liegen zum Teil gediegen vor.[12] Ihre Konzentration in Hydrosphäre, Atmosphäre und Pedosphäre schwankt über viele Größenordnungen. Ihre Konzentration in der Erdkruste reicht von einstelligen parts per billion (ppb) (Iridium, Gold, Platin) bis zu 5 Prozent (Eisen). Durch Verwitterung und Erosion gelangen diese auf natürlichem Wege in Böden und Grundwasser.[13] Dabei enthalten einige Gesteine wie Pikrit, Serpentinit, Basalte und vor allem Erze zum Teil hohe Konzentrationen von Chrom, Nickel und Cobalt, was in deren Umgebung zu einer hohen natürlichen Schwermetallbelastung der Böden führt.[14] Die Stoffkreislaufmengen und die Akkumulation in der Umwelt sind seit der Industrialisierung im 19. Jahrhundert durch wachsende Emissionen aus verschiedenen anthropogenen Quellen jedoch schnell angestiegen. Dazu gehören die Gewinnung von Schwermetallen und deren Verarbeitung, die Düngemittelherstellung, die Verbrennung von Kohle, Müll und Klärschlamm, der Kfz-Verkehr und die Stahl-, Zement- und Glasproduktion.[12] Der bergmännische Abbau von „Schwermetallerzen“ geht häufig mit einer hohen Schwermetallbelastung der Böden einher. An einigen Stellen im Harz, im Siegerland und der Aachener Umgebung hat sich beispielsweise auf den durch Erzbergbau belasteten Böden azonale Vegetation spezifischer Pflanzengesellschaften ausgebildet. Dort bilden die Galmeipflanzen sogenannte „Schwermetallrasen“ aus.
Vor 4,5 Mrd. Jahren – als der Erdmantel noch flüssig war – sanken die Schwermetalle zum Erdmittelpunkt und bildeten den Erdkern. Zum Vorkommen von Schwermetallen in der Erdkruste nehmen Geologen an, dass der größte Teil von Asteroiden stammt. Untermauert wird diese Vermutung durch eine Studie mit Wolfram, welches aus einer Gesteinsprobe aus Grönland stammt. In dieser Gesteinsprobe fand sich 13-mal häufiger das Isotop 182W als in Gesteinsproben anderer Orte. Matthias Willbold von der University of Bristol, der Erstautor der Studie, sagt: „Die meisten der Edelmetalle, auf denen unsere Wirtschaft und viele wichtige industrielle Prozesse basieren, kamen durch einen glücklichen Zufall auf unseren Planeten – als die Erde von rund 20 Trillionen Tonnen Asteroidenmaterial getroffen wurde.“[15][16]
Eigenschaften
Biologische Eigenschaften und Umweltauswirkungen
| Metall | essentiell | toxisch | ||
|---|---|---|---|---|
| Pflanzen | Tiere | Pflanzen | Tiere | |
| Blei | ☠ | ☠ | ||
| Cadmium | ☠ | ☠ | ||
| Chrom | ✓ | ☠ | ☠ | |
| Cobalt | ✓ | |||
| Kupfer | ✓ | ✓ | ☠ | ☠ |
| Mangan | ✓ | ✓ | ☠ | |
| Molybdän | ✓ | ✓ | ☠ | |
| Nickel | ✓ | ☠ | ||
| Quecksilber | ☠ | ☠ | ||
| Selen | ✓ | ☠ | ||
| Zink | ✓ | ✓ | ☠ | ☠ |
| Zinn | ✓ | |||
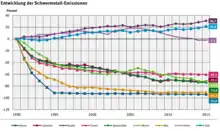
Von Natur aus kommen Schwermetalle und ihre Verbindungen in der Biosphäre nur in Spuren vor. Manche von ihnen sind in kleinen Mengen lebenswichtig für Pflanzen, Tiere und den Menschen, sie werden dann als essentielle Schwermetalle oder Spurenelemente bezeichnet. Dazu gehören Chrom, Eisen, Cobalt, Kupfer, Mangan, Molybdän, Nickel, Vanadium, Zink und Zinn. Viele Schwermetalle, auch die essentiellen, können bereits in leichter Überkonzentration für den menschlichen Organismus gesundheitsschädlich oder giftig sein, wobei deren toxische Wirkung auch stark von der chemischen Verbindung des Schwermetalles abhängt. Ein Beispiel dafür ist Chrom, welches in elementarer Form ungiftig, als Chrom(III) essentiell und als Chrom(VI) giftig und karzinogen ist.[18] Im Allgemeinen steigt die Gefährlichkeit der Verbindungen mit ihrer Wasser- und Fettlöslichkeit. Die Stoffe werden meist über die Nahrungskette aufgenommen und gelangen so in den menschlichen Körper.[12] Pflanzen spielen dabei eine große Rolle, da sie Schwermetalle aufnehmen und anreichern können.[19] Beim Menschen wirken chronische Schwermetallvergiftungen oft spezifisch auf bestimmte Organe und rufen charakteristische Krankheitsbilder hervor.[13]
Schwermetalle im Erdboden können mobilisiert ins Grundwasser, in Pflanzen und somit in die Nahrungskette gelangen und dort physiologische Schäden verursachen.
Seit dem Jahr 2006 gibt das amerikanische Blacksmith Institute eine Liste der zehn am stärksten verseuchten Orte der Welt heraus. Dabei sind sämtliche Schwermetalle – zumeist durch Bergbau oder bei der Verhüttung emittiert – jedes Mal in vielfältiger Weise vertreten.[20]
Blei
Blei sammelt sich bei der Aufnahme durch Nahrung und Atemluft im menschlichen Organismus an und wirkt schon in geringen Spuren als chronisches Gift. Es reichert sich in Knochen, Zähnen und im Gehirn an und beeinträchtigt die Funktionsfähigkeit des Nervensystems. Besonders Kinder sind gefährdet, sie zeigen oft Intelligenz-, Lern- und Konzentrationsstörungen. Auch die Immunabwehr kommt bei Bleivergiftungen zu Schaden, daraus folgt eine erhöhte Infektanfälligkeit.
Die größte Quelle für Bleivergiftung war früher das in den USA in den 1920ern entwickelte, verbleite Benzin, dem Tetraethylblei zugesetzt wurde, um die Klopffestigkeit zu erhöhen. In den USA wurde dieser Treibstoff ab 1973 nach und nach aus dem Verkehr gezogen. In Europa wurde erstmals in Deutschland 1983 wieder unverbleites Benzin verkauft. Nach schrittweiser Ersetzung und Abschaffung wurde verbleites Benzin mit Anfang 2000 EU-weit verboten.[21] Weltweit wird allerdings noch in Afrika und weiten Teilen Asiens verbleites Benzin verwendet – mit den entsprechenden gesundheitlichen Folgen.
Seit 1973 wurden in Deutschland keine Bleirohre mehr als Wasserleitung im Haus verbaut. Praktisch frei von Bleirohren ist der gesamte süddeutsche Raum, da dort seit über hundert Jahren keine mehr verlegt wurden. Der Grenzwert für Blei im Leitungswasser lag ab dem 1. Dezember 2003 bei 25 µg/L und wurde am 1. Dezember 2013 auf 10 µg/L reduziert.[22]
Cadmium
Cadmium und seine Verbindungen sind schon in geringen Konzentrationen giftig. Es hat sich im Tierversuch als krebserregend erwiesen und ist erbgut- und fruchtschädigend. Der Körper eines Erwachsenen enthält ca. 30 mg Cadmium, ohne dass es für den Aufbau von Körpersubstanzen benötigt wird. Es gehört zu den nichtessentiellen Elementen. Die orale Aufnahme von löslichen Cadmium-Salzen kann Erbrechen und Störungen im Verdauungstrakt, Leberschädigungen und Krämpfe verursachen. Die Inhalation von Cadmium-Dämpfen ruft Reizungen der Atemwege und Kopfschmerzen hervor. Chronische Vergiftungen äußern sich durch den Ausfall des Geruchsvermögens, Gelbfärbung der Zahnhälse, Blutarmut und Wirbelschmerzen, in fortgeschrittenem Stadium durch Knochenmarkschädigungen und Osteoporose. Cadmium ist vermehrt in Verruf gekommen seit dem Auftreten der oft tödlich endenden Itai-Itai-Krankheit in Japan, die mit schweren Skelettveränderungen einhergeht. Die Anreicherung von Cadmium in der Leber und vor allem in der Niere ist besonders bedenklich. Bei Rauchern wurden etwa doppelt so hohe Gehalte von Cadmium wie bei Nichtrauchern festgestellt. Die durchschnittliche Belastung mit Cadmium durch Rauchen beträgt 2 bis 4 µg pro Tag. Mit der Nahrung nimmt der Mensch täglich zwischen 10 und 35 µg Cadmium auf. Laut WHO liegt der kritische Grenzwert bei 10 µg pro Tag und Kilogramm Körpermasse. Die biologische Halbwertszeit beim Menschen liegt zwischen 10 und 35 Jahren.
Kupfer
Kupfer zählt zu den lebensnotwendigen Spurenelementen.[23] Spezielle Verbindungen jedoch können beim Verschlucken großer Mengen Schwäche, Erbrechen und Entzündungen im Verdauungstrakt verursachen. Akute Vergiftungen durch sehr hohe Mengen sind beim Menschen selten, da zwangsläufig Erbrechen ausgelöst wird. Kupfer wirkt in zahlreichen chemischen Prozessen katalytisch, dies betrifft auch Stoffwechselvorgänge.
Kupfer muss vom Menschen jeden Tag in ausreichender Menge aufgenommen werden. Die Speicherkapazität im Körper ist begrenzt. Der tägliche Bedarf eines Erwachsenen liegt bei etwa 1 bis 2 mg. Zahlreiche Nahrungsmittel enthalten dieses Spurenelement, hierzu zählen insbesondere Nüsse, bestimmte Fisch- und Fleischsorten sowie einige Gemüse.[24] Kupfer kann auch durch kupferhaltige Wasserleitungen ins Trinkwasser gelangen, allerdings nur, wenn das Trinkwasser längere Zeit in den Leitungen gestanden hat. Nur bei Wässern mit geringem pH-Wert ist dies mengenmäßig von Bedeutung. In diesem Fall wird empfohlen, abgestandenes Wasser ablaufen zu lassen. Frisches Wasser, das nicht in Leitungen stagniert, wird durch die Werkstoffe, die in der Hausinstallation verbaut wurden, grundsätzlich nicht in seiner Zusammensetzung verändert. Die Trinkwassernormen der WHO und der EU erlauben einen maximalen Kupfergehalt von 2 mg/L. Die deutsche Trinkwasserverordnung übernahm diesen Wert, der mit der Änderungsverordnung zur Trinkwasserverordnung 2011 auf 2,0 mg/L präzisiert wurde.[25]
Ein Kupfergehalt von 2 mg/L verleiht Wasser bereits einen metallischen Geschmack, 5 mg/L machen es ungenießbar. Nach derzeitigem Wissen wird ein mittlerer Gehalt des Trinkwassers von 2 mg/L als gesundheitlich unbedenklich angesehen, dies gilt für lebenslangen Genuss. Eine stark überhöhte Kupferzufuhr über Wasser oder Nahrungsmittel kann bei Säuglingen und Kleinkindern, deren Kupferstoffwechsel noch nicht vollständig ausgebildet ist, zur frühkindlichen Leberzirrhose führen.[22] Dies liegt unter anderem daran, dass der spezifische Gesamtbestand des Kupfers im Körper von Säuglingen schon bei Geburt von Natur aus relativ hoch ist. Bei Jugendlichen und Erwachsenen wird überschüssiges Kupfer ähnlich wie bei Vitamin C wieder ausgeschieden.
Vom Umweltbundesamt wurde 2011 der Entwurf der trinkwasserhygienisch geeigneten metallischen Werkstoffe veröffentlicht, Kupfer ist hierbei für alle Bauteiltypen enthalten.[26] Bei Wässern mit einem niedrigen pH-Wert sollten Kupferbauteile auf der Innenoberfläche verzinnt sein – DIN 50930-6 gibt hierzu detaillierte Beschreibungen der wasserseitigen Rahmenbedingungen. Eine genaue Prüfung ist bei Hausbrunnen notwendig, weil Hausbrunnenwasser vielfach nicht aufbereitet wird. Von dieser Ausnahme abgesehen ist das Trinkwasser aber deutlich besser als sein Ruf und kann unbedenklich auch von Kindern reichlich getrunken werden.[22]
Obwohl Kupfer für den Menschen zu den lebensnotwendigen Spurenelementen zählt, wirkt es auf viele Mikroorganismen wachstumshemmend oder sogar aktiv antimikrobiell. Gezielt genutzt wird diese Eigenschaft für Kontaktoberflächen im medizinischen Bereich als ergänzende Maßnahme im Kampf gegen antibiotikaresistente Mikroorganismen.[27]
Plutonium
Die für einen Menschen tödliche Dosis liegt wahrscheinlich im zweistelligen Milligrammbereich. Viel gefährlicher als die chemische Wirkung ist aber seine Radioaktivität, die Krebs verursachen kann. Zur Entstehung von Krebs reicht vermutlich eine Menge in der Größenordnung einiger Mikrogramm. Aus dieser Abschätzung wurde das weit verbreitete Missverständnis über die besondere Gefährlichkeit von Plutonium abgeleitet. Da die ausgesendete Alphastrahlung schon durch die äußersten Hornhautschichten abgeschirmt wird, ist Plutonium nur bei Inkorporation (beispielsweise die Inhalation von plutoniumhaltigem Staub) gesundheitsschädlich.
Quecksilber
Metallisches Quecksilber kann als Quecksilberdampf über die Lunge in den Körper aufgenommen werden. Es reizt die Atem- und Verdauungswege, kann zu Erbrechen mit Bauchschmerzen führen und auch Schäden an Nieren und am Zentralnervensystem hervorrufen.
Verwendung
Schwermetalle werden in vielen Bereichen, zumeist aber für die Metallveredelung verwendet. Dadurch erhalten die ausgewählten Materialien spezielle Eigenschaften. Folgende Anwendungsgebiete sind heute aufgrund ihrer gesundheitsgefährdenden Wirkung verboten:
- Blei in PVC und Trinkwasserleitungen
- Blei in Lötzinn ist nach der RoHS-Richtlinie nicht mehr erlaubt (mit wenigen Ausnahmen, siehe weiter unten)
- Cadmium in der Kosmetik, Pflanzenschutz und PVC, früher auch in Akkumulatoren
- Quecksilber in Holzschutzmitteln, Imprägnierstoffen, Antifoulingfarben sowie zur Wasseraufbereitung
Weiterhin verwendete Schwermetalle:
- Blei im Lötzinn bei medizinischen Geräten, in Überwachungs- bzw. Kontrollinstrumenten, in der Luft- und Raumfahrt und im militärischen Bereich sowie für Reparaturen
- Chrom und Nickel für Stahl, Nickel auch in Akkumulatoren
- Blei für Akkumulatoren (= aufladbare Batterien), Kabelummantelungen, Pigmente, Legierungen sowie beim Strahlenschutz
- Quecksilber in geringen Mengen in Leuchtstofflampen und Energiesparlampen, in Thermometern, in der Apparatetechnik und in Amalgam-Zahnfüllungen
- Cadmium für Akkumulatoren (Nickel-Cadmium und Silber-Cadmium), als Korrosionsschutz für Eisen und ähnliche Metalle (durch elektrolytische Abscheidung oder physikalische Gasphasenabscheidung erzeugte Cadmium-Überzüge schützen bereits in einer Dicke von 0,008 mm gegen Korrosion), Cadmium-Pigmente und Cadmiumseife als Stabilisatoren für PVC, Cadmium (auch als Legierungen) zur Abschirmung gegen thermische Neutronen und für Steuerstäbe in Reaktoren (Cadmium-113 hat einen besonders großen Wirkungsquerschnitt für den Neutroneneinfang).
Anwendung in der Medizin:
- Lanthan dient als Lanthancarbonat (Phosphatbinder) zur Behandlung der Hyperphosphatämie bei niereninsuffizienten Patienten.[29]
- Gadolinium wird komplexgebunden als Kontrastmittel bei der Magnetresonanztomographie eingesetzt, etwa das Gadopentetat-Dimeglumin. Es besteht die Gefahr einer nephrogenen systemischen Fibrose (NSF) bei niereninsuffizienten Patienten.[30][31]
- Schwermetalle wie Quecksilber hatten früher ein breites Indikationsspekrum, so etwa bei der Behandlung der Syphilis.[32]
Anwendung in der Landwirtschaft:
- Zink und Kupfer werden als Futtermittelzusatzstoffe eingesetzt, können sich jedoch in intensiv genutzten Böden anreichern.[33]
Literatur
- Jerome Nriagu: A History of Global Metal Pollution. In: Science. Band 272, Nr. 5259, 1996, S. 223–223, doi:10.1126/science.272.5259.223.
Weblinks
Einzelnachweise
- ME Hodson: Heavy metals—geochemical bogey men? In: Environmental Pollution, 129/2004, S. 341–343, doi:10.1016/j.envpol.2003.11.003.
- JH Duffus: Definitions of heavy metal: Survey of current usage. April 2001.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1141.
- Leichtmetalle. Lexikon der Chemie, Wissenschaft-Online-Lexika; abgerufen am 16. April 2009.
- K. Maile, E. Roos: Werkstoffkunde für Ingenieure: Grundlagen, Anwendung, Prüfung. Birkhäuser, 2005, ISBN 978-3-540-22034-3, S. 10.
- Wenige, ältere Quellen nennen einen Grenzwert von < 4,5 g/cm³
J. Elpers, H. Meyer, N. Meyer, H. Marquard, W. Nabbefeld, W. Skornitzke, W. Willner, F. Ruwe: Mechatronik. Grundstufe. 4. Auflage. Bildungsverlag Eins, 2001, ISBN 978-3-8242-2080-9, S. 52
K. Hengesbach: Fachwissen Metall Grundstufe und Fachstufe 1. 4. Auflage. Bildungsverlag Eins, 1994, ISBN 978-3-8237-0330-3, S. 248. - R. Zahoransky (Hrsg.): Energietechnik. 7. Auflage, Springer 2015, ISBN 978-3-658-07453-1, Seite 109.
- Fachkundebuch Metall. 56. Auflage. Europa-Lehrmittel, S. 268: Tabelle 1: Einteilung der NE-Metalle.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1065.
- John H. Duffus: ‚Heavy metals‘ – a meaningless term? In: International Union of Pure and Applied Chemistry (IUPAC), Pure and Applied Chemistry, 74/2002, S. 793–807, doi:10.1351/pac200274050793.
- Jyoti Gyanchandani, S.K.Sikka: Structural Properties of of Group IV B Element Rutherfordium by First Principles Theory, 2011, arxiv:1106.3146.
- Andreas Heintz, Guido A. Reinhardt: Chemie und Umwelt: Ein Studienbuch für Chemiker, Physiker, Biologen und Geologen. Springer DE, 2000, ISBN 3-642-61205-9, S. 233 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jörg Lewandowski, Stephan Leitschuh, Volker Koss: Schadstoffe im Boden: eine Einführung in Analytik und Bewertung: mit … Springer DE, 1997, ISBN 3-540-62643-3, S. 99 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Heinz Brauer: Handbuch Des Umweltschutzes Und Der Umweltschutztechnik: Band 1: Emissionen und ihre Wirkungen. Springer DE, 1996, ISBN 3-642-59197-3, S. 475 (eingeschränkte Vorschau in der Google-Buchsuche).
- Meteoriten ließen Edelmetalle auf die Erde regnen. Spiegel online, 8. September 2011.
- The tungsten isotopic composition of the Earth’s mantle before the terminal bombardment. In: Nature, 8. September 2011, doi:10.1038/nature10399.
- Toxische Metalle. GeoLexikon.
- Georg Schwedt: Taschenatlas der Umweltchemie. John Wiley & Sons, 1996, ISBN 3-527-30872-5, S. 206 (eingeschränkte Vorschau in der Google-Buchsuche).
- Robert Guderian: Handbuch der Umweltveränderungen und Ökotoxikologie: Band 2B: Terrestrische … Springer DE, 2001, ISBN 3-642-56413-5, S. 103 (eingeschränkte Vorschau in der Google-Buchsuche).
- The Top Ten Toxic Threats. 2013, Blacksmith Institute (PDF; 4,8 MB).
- SZ: Bleifreies Benzin
- aid infodienst Ernährung, Landwirtschaft, Verbraucherschutz e. V. mit Förderung durch das Bundesministerium für Ernährung, Landwirtschaft und Verbraucherschutz.
- B. R. Stern, M. Solioz, D. Krewski, P. Aggett, T. C. Aw, S. Baker, K. Crump, M. Dourson, L. Haber, R. Hertzberg, C. Keen, B. Meek, L. Rudenko, R. Schoeny, W. Slob, T. Starr: Copper and human health: biochemistry, genetics, and strategies for modeling dose-response relationships. In: Journal of Toxicology and Environmental Health – Part B – Critical Reviews. Band 10, Nummer 3, 2007 Apr-May, S. 157–222, doi:10.1080/10937400600755911, PMID 17454552 (Review).
- Kupfer und der Menschliche Körper. (Memento des Originals vom 23. Mai 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Eurocopper.
- Trinkwasserqualität bei Endverbrauchern (Schwermetalle) (Memento vom 18. Juli 2013 im Internet Archive). Umweltbundesamt, Daten zur Umwelt.
- Liste trinkwasserhygienisch geeignete metallene Werkstoffe (Entwurf) Trinkwasserhygienisch geeignete metallene Werkstoffe (Memento vom 3. September 2013 im Internet Archive). Umweltbundesamt (PDF; 103 kB).
- Gesundheitshygiene. (Memento des Originals vom 23. Mai 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Eurocopper.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1093.
- M. Fukagawa, C. Harman: Is lanthanum carbonate safer and more effective than calcium carbonate for hyperphosphatemia in dialysis patients? In: Nature Clinical Practice Nephrology. Band 1, Nr. 1, 2005, S. 20–21, doi:10.1038/ncpneph0020.
- K. J. Murphy, J. A. Brunberg, R. H. Cohan: Adverse reactions to gadolinium contrast media: a review of 36 cases. In: American Journal of Roentgenology. Band 167, Nr. 4, 1996, S. 847–849, doi:10.2214/ajr.167.4.8819369.
- H. S. Thomsen, S.K. Morcos, P. Dawson: Is there a causal relation between the administration of gadolinium based contrast media and the development of nephrogenic systemic fibrosis (NSF)? In: Clinical Radiology. Band 61, Nr. 11, 2006, S. 905–906, doi:10.1016/j.crad.2006.09.003.
- Robert C. Thompson, Dudley C. Smith: Evaluation of the treatment of early syphilis with arsphenamine and heavy metal. In: Am. J. Syph. Gon. Ven. Dis. Band 34, 1950, S. 410–419.
- Nationalen Bodenbeobachtung (NABO) 1985–2009. (PDF; 2,3 MB) Zustand und Veränderungen der anorganischen Schadstoffe und Bodenbegleitparameter. Agroscope, 2015, abgerufen am 29. Dezember 2020.