Kohlenwasserstoffe
Die Kohlenwasserstoffe sind eine Stoffgruppe chemischer Verbindungen, die nur aus Kohlenstoff und Wasserstoff bestehen.[1] Diese Stoffgruppe ist vielfältig, da Kohlenwasserstoffe Kohlenstoffketten, -ringe oder Kombinationen daraus enthalten können. Es gibt mehrere Untergruppen wie Alkane, Alkene, Alkine und Aromaten (Arene). Die Kohlenwasserstoffe haben vor allem durch ihre Verwendung als fossile Brennstoffe und in der organischen Synthese eine große technische Bedeutung erlangt.
| Kohlenwasserstoffe |
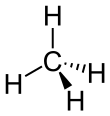 Methan |
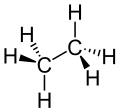 Ethan |
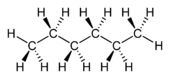 n-Hexan |
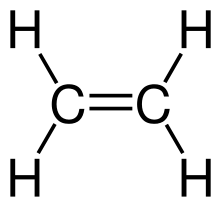 Ethen |
 Propen |
Ethin |
 Benzol |

Vorkommen
Kohlenwasserstoffe sind in der Natur insbesondere in Erdöl und Erdgas in sehr großer Menge enthalten, weshalb diese beiden Bodenschätze auch unter dem Überbegriff fossile Kohlenwasserstoffe zusammengefasst werden. Sie sind zudem verbreitet in vielen Pflanzen z. B. als Terpene, Carotinoide und Kautschuk, und so kommen sie fossil auch in Kohle vor. Einfache Kohlenwasserstoffe, insbesondere Methan, sind Stoffwechselprodukte einiger Mikroorganismen. Im Weltall sind Kohlenwasserstoffe, meist in Form von Methan und Ethan, auf Kometen, Planeten und Monden sowie in interstellarer Materie nachgewiesen.
Einige wenige (wie zum Beispiel Idrialin und Kratochvílit) treten in der Natur auch als Mineral auf.
Systematik
Kohlenwasserstoffe lassen sich unterteilen in die aromatischen und die aliphatischen Kohlenwasserstoffe, bei denen ungesättigte und gesättigte Verbindungen unterschieden werden.
Bei gesättigten Kohlenwasserstoffen handelt es sich um chemische Verbindungen, die ausschließlich C-C-Einfachbindungen enthalten. Sie werden in kettenförmige und ringförmige Verbindungen unterteilt. Kettenförmige werden systematisch als Alkane bezeichnet. Die einfachsten und bekanntesten Alkane sind Methan (CH4), Ethan (C2H6), und Propan (C3H8). Allgemein lautet die Summenformel für die homologe Reihe der kettenförmigen Alkane CnH2n+2. Ringförmige Alkane werden als Cycloalkane bezeichnet. Ihre allgemeine Summenformel für die homologe Reihe lautet CnH2n.
Ungesättigte Kohlenwasserstoffe lassen sich in Alkene und Alkine einteilen. Bei den Alkenen handelt es sich um Verbindungen, die C=C-Doppelbindungen enthalten. Der einfachste Vertreter dieser Stoffgruppe ist das Ethen, auch Ethylen genannt (C2H4). Die einfachsten n-Alkene mit nur einer Doppelbindung haben allgemein die Summenformel CnH2n. Als Polyene werden Verbindungen mit mindestens zwei C=C-Doppelbindungen, wie zum Beispiel 1,3-Butadien, bezeichnet. Cycloalkene sind cyclische Kohlenwasserstoffe, wie zum Beispiel Cyclopentadien. Hier liegen C-C-Doppelbindungen innerhalb eines Kohlenstoffringes vor. Alkine sind Kohlenwasserstoffe, die eine oder mehrere C-C-Dreifachbindungen enthalten. Der bekannteste Vertreter ist das Ethin (Acetylen) mit der Summenformel C2H2. Dementsprechend haben Alkine mit einer Dreifachbindung allgemein die Summenformel für die homologe Reihe CnH2n-2. Gesättigte und ungesättigte Kohlenwasserstoffe werden besonders in der Petrochemie unter der Bezeichnung aliphatische Kohlenwasserstoffe gesammelt.
Die dritte wichtige Gruppe von Kohlenwasserstoffen sind die aromatischen Kohlenwasserstoffe. Dabei handelt es sich um Kohlenwasserstoffe, die Aromatizität aufweisen und meist C6-Ringe besitzen (Arene). Der bekannteste Vertreter ist das Benzol (C6H6). Eine Untergruppe der Aromaten sind die polyzyklischen aromatischen Kohlenwasserstoffe. Bei ihnen handelt es sich um Verbindungen, die aus mehreren aneinander hängenden Benzolringen bestehen. Ein bekannter Vertreter ist das Naphthalin (C10H8).
Kohlenwasserstoffe, die vom Aufbau her Platonischen Körpern entsprechen, bezeichnet man als Platonische Kohlenwasserstoffe. Hierzu gehören Tetrahedran, Cuban und Dodecahedran.
Kohlenwasserstoffe mit gleicher Summenformel können verschiedene Strukturformeln (Verknüpfungen der C-Atome) aufweisen. Es handelt sich dann um Konstitutionsisomere. Es gibt sie bei den Alkanen ab den Butanen und bei den meisten anderen Kohlenwasserstoffen. Die klassische cis-trans-Isomerie tritt mitunter an C-C-Doppelbindungen auf. Einfache verzweigte Kohlenwasserstoffe können, wie das Beispiel 3-Methylhexan zeigt, chiral sein. Das Kohlenstoffatom in Position Nummer 3 wird hier zum Stereozentrum, die Verbindung ist asymmetrisch und man unterscheidet zwischen den (R)- und (S)-Enantiomeren.
Eigenschaften
In Wasser sind viele unpolare Kohlenwasserstoffe unlöslich, in den meisten organischen Lösungsmitteln jedoch gut löslich. Das heißt, Kohlenwasserstoffe sind hydrophob, also auch lipophil.
Gasförmige Kohlenwasserstoffe brennen sehr schnell und mit heißer Flamme; die dabei frei werdende Energie ist groß. Flüssige Kohlenwasserstoffe mit niedrigem Siedepunkt verdampfen leicht; infolge ihres auch niedrigen Flammpunktes sind Brände leicht zu entfachen. Bei der optimalen (vollständigen) Verbrennung von Kohlenwasserstoffen entsteht Wasser und Kohlenstoffdioxid, bei unzureichender (unvollständiger) Verbrennung können auch Kohlenstoffmonoxid oder Kohlenstoff (Ruß) entstehen. Die Reaktivität der Alkane ist abhängig von ihrer Kettenlänge. Langkettige Alkane sind relativ inert (wenig reaktiv). Verbrennt Kohlenwasserstoff mit rußender Flamme, kann dies auch ein Anzeichen für einen höheren Kohlenstoffanteil in der Verbindung (größere Kettenlänge) sein.
Alkane gehen aber – neben Redoxreaktionen bei ihrer Verbrennung – Substitutionsreaktionen ein, wobei Wasserstoffatome gegen andere Atome und Atomgruppen, aber hauptsächlich Halogenen ausgetauscht werden können. Alkene und Alkine hingegen sind recht reaktionsfreudig und reagieren mit vielen Substanzen unter Anlagerung an die C-C-Mehrfachbindung (Additionsreaktion).
Die vergleichsweise hohe Neigung der Kohlenstoffatome zur Ausbildung von Ketten C-C-C-… (Verkettung oder Katenisierung, englisch catenation, von lateinisch catena ‚Kette‘) ist für die Vielfalt der Kohlenwasserstoffe entscheidend und beruht auf der höheren Bindungsenergie der kovalenten C–C Bindungen (356 kJ/mol) im Vergleich zu höheren Homologen der 14. Gruppe (z. B. Si–Si (226 kJ/mol), Ge–Ge (186 kJ/mol)). Weiterhin ist die C–H-Bindung ebenfalls thermodynamisch stabiler als die Si–H-, Ge–H- oder Sn–H-Bindung. So kann erklärt werden, warum es eine höhere Vielfalt an Kohlen-, als an Silicium- oder Germaniumwasserstoffen gibt.[2]
Verwendung

_Tank_wagon_33_80_7920_362-0_with_hydrocarbon_gas_at_Bahnhof_Enns.jpg.webp)
Alkane werden häufig als fossiler Energieträger in Gemischen wie Biogas, Flüssiggas, Benzin, Dieselkraftstoff, Heizöl, Kerosin, Petroleum verwendet. Die bedeutendsten Alkane sind die niedermolekularen Alkane Methan, Ethan und Propan. Alkane wie Butan, Isopentan, verschiedene Hexane und das Cycloalkan Cyclohexan sind Bestandteile in Motorenbenzin.
Die Kohlenwasserstoffe dienen als Ausgangsstoff für eine Vielzahl von industriell bedeutenden chemischen Synthesevorgängen. Von technischer Bedeutung sind Alkene wie Ethen und Cyclohexen, Alkine wie Ethin und Polyene wie 1,3-Butadien, Isopren und Cyclopentadien. Viele Arene besitzen technische Bedeutung, darunter Benzol, Toluol, Xylol und Styrol.
Wichtig sind die Polymerisationsprodukte der Kohlenwasserstoffe wie zum Beispiel Polystyrol, Polyethylen, Polypropylen, Polyethin, viele Copolymere sowie die halogenierten Kohlenwasserstoffpolymere wie Polyvinylchlorid und Polytetrafluorethylen. Darüber hinaus dienen Kohlenwasserstoffe als lipophile Lösemittel.
Umweltbelastung
Kohlenwasserstoffe machen – nach Definition der Weltgesundheitsorganisation WHO – den Hauptteil der flüchtigen organischen Verbindungen (abgekürzt auch VOC) aus; diese gelten bei Emission als umweltschädigend. Zwecks Emissionsreduktion wird z. B. in der Schweiz auf diese Emissionen eine Lenkungsabgabe erhoben. Weiter besitzt Methangas einen erheblichen Treibhauseffekt.[3]
Siehe auch
Literatur
- Handbuch der Experimentellen Chemie Sekundarbereich II, Band 9, Kohlenwasserstoff, Aulis Verlag Deubner & Co. KG.
- Karl-Heinz Lautenschläger, Werner Schröter, Joachim Teschner, Hildegard Bibrack, Taschenbuch der Chemie, 18. Auflage, Harri Deutsch, Frankfurt (Main), 2001.
- J. C. Jones: Hydrocarbons. Physical Properties and their Relevance to Utilisation. J. C. Jones & Ventus Publishing ApS, 2010. ISBN 978-87-7681-513-4 (PDF bei bookboon.com).
- Hartung, Birgitta (1984) Potentielle Kohlenwasserstoff-Muttergesteine in der Tiefsee. Geowissenschaften in unserer Zeit; 2, 6; 208–211; doi:10.2312/geowissenschaften.1984.2.208.
Weblinks
Einzelnachweise
- Eintrag zu hydrocarbons. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.H02889 – Version: 2.3.2.
- Catherine E. Housecroft, Alan G. Sharpe: Inorganic Chemistry, 4. Auflage, Pearson Education, Amsterdam, 2012, S. 433f.
- BUWAL: Die Luftreinhaltung in den Kantonen, 1997.