Blei(II)-nitrat
Blei(II)-nitrat, ein weißer, kristalliner Feststoff, ist das Blei(II)-salz der Salpetersäure. Blei(II)-nitrat ist ein starkes Oxidationsmittel. Es ist im Gegensatz zu anderen Bleisalzen gut in Wasser löslich. Aus diesem Grund ist es giftig.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
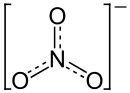 | |||||||||||||||||||
| Kristallsystem |
kubisch | ||||||||||||||||||
| Raumgruppe |
Pa3 (Nr. 205) (früher Raumgruppe Pa3)[1] | ||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Blei(II)-nitrat | ||||||||||||||||||
| Andere Namen |
Bleinitrat | ||||||||||||||||||
| Summenformel | Pb(NO3)2 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 331,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,53 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (522 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung
Blei(II)-nitrat entsteht bei der Reaktion von heißer, verdünnter Salpetersäure mit (1) Blei[6] oder (2) Blei(II)-oxid:
Aus den Lösungen kristallisiert es in großen, wasserklaren Kristallen aus.
Die Umsetzung von Blei(II)-carbonat mit Salpetersäure liefert ebenso Blei(II)-nitrat unter Bildung von Kohlenstoffdioxid:
Eigenschaften
-nitrat_by_Danny_S._-_002.JPG.webp)
Im Gegensatz zu vielen anderen Blei(II)-salzen wie Blei(II)-chlorid oder Blei(II)-sulfat ist Blei(II)-nitrat gut in Wasser löslich.
Erhitzt man Blei(II)-nitrat bis zu seiner Zersetzungstemperatur von 470 °C, so zerfällt es unter Bildung von Stickstoffdioxid, Sauerstoff und Blei(II)-oxid:
Daher ist diese chemische Reaktion im Labor zur Bildung geringer Mengen des Gases Stickstoffdioxid geeignet. Wegen der Sauerstoff-Freisetzung wird Blei(II)-nitrat bei der Synthese von Farbstoffen als Oxidationsmittel eingesetzt.
Toxizität
Bleinitrat ist gesundheitsschädlich, fruchtschädigend und kann möglicherweise die Fortpflanzungsfähigkeit beeinträchtigen. Es kann, wenn auch nur in vernachlässigbarer Menge, durch die Haut aufgenommen werden. Außerdem geht von ihm eine Gefahr für die Umwelt aus, da es giftig für Wasserorganismen ist.
Verwendung
Verwendung findet Blei(II)-nitrat weiterhin bei der Herstellung von Textilbeizen, Spezialexplosivstoffen, Ätzlösungen und zur Perlmuttfärbung.
Einzelnachweise
- W. C. Hamilton: A Neutron Crystallographic Study of Lead Nitrate, in: Acta Cryst., 1957, 10, S. 103–107. doi:10.1107/S0365110X57000304.
- Datenblatt Blei(II)-nitrat (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag lead compounds with the exception of those specified elsewhere in this Annex im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Blei(II)-nitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- Laboratory manual of chemistry, for secondary schools, 1905, S. 108.



