Blei(II)-chlorid
Blei(II)-chlorid (PbCl2) ist das Blei(II)-salz der Salzsäure. Es kristallisiert in weißen, rhombischen Nadeln oder Prismen aus.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
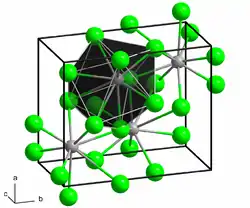 | |||||||||||||||||||
| _ Pb2+ _ Cl− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Blei(II)-chlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | PbCl2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 278,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
5,85 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
950 °C[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−359 kJ·mol−1[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
In der Natur kommt Blei(II)-chlorid als Mineral Cotunnit vor.
Gewinnung und Darstellung

Blei(II)-chlorid lässt sich durch Reaktion von Blei oder Blei(II)-oxid mit Chlor oder Salzsäure darstellen.[6]
Da Blei(II)-chlorid in Wasser schwerlöslich ist, fällt es aus bleihaltigen wässrigen Lösungen aus. Dies wird in der Salzsäuregruppe des Kationentrennungsganges ausgenutzt, um Blei von anderen Ionen abzutrennen.[7]
Eigenschaften
Blei(II)-chlorid kristallisiert wie Blei(II)-fluorid und Blei(II)-bromid in einer mit der Uran(III)-chloridstruktur verwandten Raumstruktur. Dabei ist jedes Bleiatom von insgesamt neun Chlorid-Atomen koordiniert. Diese bilden als Koordinationspolyeder verzerrte dreifach überkappte, trigonale Prismen, die über gemeinsame Flächen miteinander verbunden sind.[6]
Während Blei(II)-chlorid in kalter, verdünnter Salzsäure nur sehr gering löslich ist, löst es sich gut in konzentrierter Salzsäure oder konzentrierten Chloridlösungen (z. B. Natriumchlorid) unter Bildung von Chloroplumbaten.[7][8] Löslich ist es zudem in Ammoniumchlorid und -nitratlösungen, da sich dabei lösliche Komplexe bilden.[9]
Verwendung
Blei(II)-chlorid wird zur Herstellung von Bleichromat und als Flussmittel verwendet. Früher wurde es auch zur Herstellung mehrerer Pigmente, Pattinsons Bleiweiß (Bleihydroxidchlorid) und Veroneser Gelb (Bleioxidchlorid) genutzt.[9]
Einzelnachweise
- Datenblatt Blei(II)-chlorid (PDF) bei Merck, abgerufen am 19. Januar 2011.
- CRC Handbook of Chemistry and Physics 67. Auflage (1986/87)
- Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Bleiverbindungen mit Ausnahme der namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. Dezember 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Blei(II)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- PAETEC Formelsammlung Ausgabe 2003, Seite 116
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1013–1015.
- Gerhart Jander, Ewald Blasius: Einführung in das anorganisch-chemische Praktikum: (einschliesslich der quantitativen Analyse); mit 61 Tabellen. Hrsg.: Joachim Strähle, Rolando Rossi. 14., neu bearb. / von Joachim Strähle und Eberhard Schweda Auflage. Hirzel, Stuttgart 1995, ISBN 3-7776-0672-3, S. 245.
- Sven Hagemann: Thermodynamische Eigenschaften des Bleis in Lösungen der ozeanischen Salze. Braunschweig 1999, S. 166, doi:10.24355/dbbs.084-200511080100-200 (tu-braunschweig.de [abgerufen am 11. März 2021]).
- Eintrag zu Bleichloride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Mai 2014.


