Hämoglobin
Hämoglobin (von altgriechisch αἷμα haíma, „Blut“, und lateinisch globus, „Klumpen, Ballen“), Abkürzung Hb, ist der eisenhaltige Proteinkomplex, der als Blutfarbstoff in den roten Blutkörperchen von Wirbeltieren enthalten ist, Sauerstoff bindet und diesen so im Blutkreislauf transportiert.
| Hämoglobin α-Untereinheit | ||
|---|---|---|
| ||
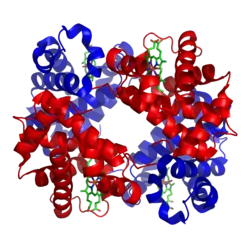
| Das Hämoglobin A1 erwachsener Menschen besteht aus 2 α-Ketten (rot) und 2 β-Ketten (blau) mit 4 Häm-Gruppen (grün), die je ein O2-Molekül binden können (Modell nach PDB 1GZX) | ||
|
Vorhandene Strukturdaten: UniProt-Eintrag | ||
| Masse/Länge Primärstruktur | 16 kDa je Untereinheit; α-Kette 141, β-Kette 146 Aminosäuren | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Name(n) | HBA1, HBA2 | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Beta-2 Globin | |
| Übergeordnetes Taxon | Wirbeltiere | |
| Hämoglobin β-Untereinheit | ||
|---|---|---|
| ||
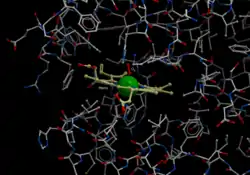
| Kugelmodell der Häm-Tasche der Hämoglobin β-Untereinheit mit Häm, Eisen (grün) und Disauerstoff, nach PDB 1GZX | ||
|
Vorhandene Strukturdaten: UniProt-Eintrag | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 146 Aminosäuren | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Name | HBB | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Beta-2 Globin | |
| Übergeordnetes Taxon | Wirbeltiere | |
| Übergeordnet |
| Zytosol |
| Gene Ontology |
|---|
| QuickGO |
Das Hämoglobin von Säugetieren ist ein Tetramer, es besteht aus vier Globinen als Untereinheiten. Beim erwachsenen Menschen sind dies je zwei Hb α und Hb β im Hämoglobin A (Hb A0), der häufigsten Form. Die vier den Komplex bildenden Proteine sind Aminosäureketten (α-Kette 141 AS; β-Kette 146 AS) in der für Globine typischen Faltung mit jeweils einer Tasche, in der ein Eisen-II-Komplex, das Häm, gebunden ist. Dessen Eisenion vermag ein Sauerstoffmolekül zu binden. Dabei ändert sich die Farbe des Häms von dunkel- zu hellrot. Die Bindungsstärke hängt empfindlich von der Konformation der Proteinumgebung des Häms ab. Wechselwirkungen zwischen den vier Globinen begünstigen die beiden extremen Zustände, in denen der Gesamtkomplex entweder mit vier Molekülen Sauerstoff gesättigt ist (in der Lunge bzw. den Kiemen) oder allen Sauerstoff abgegeben hat. Wechselwirkungen mit anderen Molekülen unterstützen die Beladung wie die Entladung.
Zum Vorkommen von Hämoglobin und ähnlicher Globine im Tierreich siehe Sauerstofftransporter.
Geschichte
Das Sauerstofftransportprotein Hämoglobin wurde 1840 von Friedrich Ludwig Hünefeld entdeckt.[1] 1851 beschrieb Otto Funke die Kristallisation von Hämoglobin durch Verdünnen von Tierblut mit Wasser, Ethanol oder Diethylether und anschließendem langsamen Verdampfen des Lösungsmittels aus der erhaltenen Proteinlösung („Funkesche Kristalle“).[2] Über die reversible Oxygenierung des Hämoglobins wurde 1866 erstmals von Felix Hoppe-Seyler berichtet.[3][4] Von ihm stammt auch der Name Hämoglobin. Die Strukturformel des Häms (bzw. des korrespondierenden Hämins), also des eisenhaltigen Porphyrinkomplexes, formulierte bereits 1912 der deutsche Chemiker William Küster,[5] der Nachweis der Richtigkeit dieser Strukturformel gelang dem Chemiker Hans Fischer 1928 durch die vollständige Synthese des Hämins. 1930 wurde er dafür mit dem Nobelpreis für Chemie ausgezeichnet. Das Hämoglobin ist eines der bestuntersuchten Proteine, seine Struktur wurde als eine der ersten überhaupt von Max Perutz et al 1959 mit Hilfe der Röntgenkristallographie ermittelt.[6][7][8][9] Für diese Arbeiten bekam er 1962 zusammen mit John Kendrew den Nobelpreis für Chemie.
Struktur
Nichtmodifizierte Grundstruktur
 Bändermodell von Hämoglobin A (HbA) –
Bändermodell von Hämoglobin A (HbA) –
je zwei Untereinheiten α und β (rot bzw. blau) tragen jeweils ein Häm (Stäbchenmodell, grün) als prosthetische Gruppe (nach PDB 1GZX)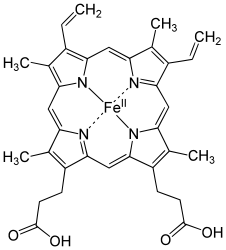 Strukturformel des Häm b
Strukturformel des Häm b
Säuger-Hämoglobine bestehen aus vier Untereinheiten, je zwei vom α- und zwei vom β-Typ. In jeder dieser Untereinheiten ist jeweils eine prosthetische Gruppe, an der die Sauerstoffbindung stattfindet, eingebettet. Ein Hämoglobinkomplex-Molekül kann also vier Sauerstoffmoleküle binden. Die prosthetische Gruppe der sauerstofffreien Form ist ein Eisen(II)-Komplex des Protoporphyrins IX, welches die vier äquatorialen Positionen des Eisenions besetzt. Das Eisenion befindet sich in einem high-spin-Zustand und ist daher etwas zu groß, um in das Loch des Porphyrins zu passen. Es befindet sich also etwas unterhalb der Ringebene. Dieses Häm b ist über die axiale Position des Eisenions auf der Unterseite über einen proximalen Histidinrest an die Proteinmatrix gebunden. Die zweite axiale Position auf der Oberseite ist unbesetzt und steht für die Anbindung des Sauerstoffmoleküls zur Verfügung.
Posttranslationale Modifikationen
Neben verschiedenen seltenen Modifikationen einzelner Aminosäuren in den Hämoglobin-Untereinheiten des Menschen tritt häufig die Glykation beider Untereinheiten an speziellen Aminosäuren auf. Dies ist die Folge einer hohen Glucosekonzentration im Blut und kann daher in der Labordiagnostik verwendet werden, um den durchschnittlichen Blutzuckerspiegel der letzten Monate zu ermitteln.
Bei der Glykation des Hämoglobins wird Glucose kovalent an Lysin-8, -17, -41, -62 der α-Untereinheit, sowie Valin-2, Lysin-9, -18, -67, -121 oder -145 der β-Untereinheit gebunden. Ist ein glykiertes β-Hämoglobin an Valin-2 modifiziert und hat sich der Glucoserest über ein Aldimin und eine Amadori-Umlagerung zu einem stabilen Ketoamin gewandelt, wird es als HbA1c bezeichnet.[10][11]
Sauerstofftransport
Leistungsfähigkeit
Hämoglobin ist ein globuläres Protein mit sehr guter Löslichkeit in Wasser (Löslichkeit bis zu 5 mmol/l Hämoglobin (34 %)). 1 g Hb kann in vitro 1,389 ml Sauerstoff binden, in vivo jedoch nur 1,34 ml (Hüfnersche Zahl), somit können 100 ml Blut, die etwa 15 g Hb enthalten, bei 100-prozentiger Sättigung bis zu 15 × 1,34 ml = 20,1 ml Sauerstoff aufnehmen.
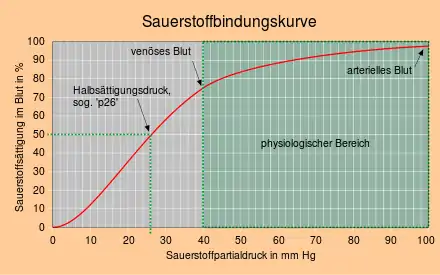
Auffällig ist der sigmoidale (S-förmige) Verlauf der Bindungskurve. Normalerweise würde man erwarten, dass die Sauerstoffbeladung mit steigendem Sauerstoffpartialdruck wie beim Myoglobin zunächst stark und dann immer langsamer zunimmt (hyperbolischer Verlauf). Für Hämoglobin verläuft die Sauerstoffbindungskurve im Bereich des in der Lunge herrschenden Sauerstoffpartialdrucks ungewöhnlich flach und im Bereich des im Gewebe herrschenden Sauerstoffpartialdrucks ungewöhnlich steil. Der flache Verlauf der Bindungskurve im Endteil verhindert einen stärkeren Abfall der Sauerstoffsättigung im Alter, bei Lungenfunktionsstörungen und in Höhenlagen, und der steilere Verlauf im Mittelteil sorgt dafür, dass bei einem sinkenden venösen Sauerstoffpartialdruck viel Sauerstoff abgegeben wird.[13][14]
Normbereich
Für das beim Erwachsenen überwiegende sogenannte „adulte Hämoglobin“ (siehe unten) wurde ein Normbereich festgelegt. Für Kinder gelten andere Normwerte.
Als Normalbereich wird der Bereich bezeichnet, in dem die Hb-Werte von 96 Prozent aller gesunden Menschen liegen.
| g/dl (alte Einheit) |
mmol/l (SI-Einheit) | |
|---|---|---|
| Männer | 13,5–17,5 | 8,4–10,9 |
| Frauen | 12–16 | 7,4–9,9 |
| Neugeborene | 19 | 11,8 |
Ein erhöhter Hämoglobin-Wert bedeutet meistens auch eine erhöhte Erythrozyten-Anzahl (Polyglobulie) und kann z. B. bei Aufenthalt in großen Höhen (Sauerstoffmangel) oder durch Flüssigkeitsverlust auftreten. Bei unklarer Ursache ist auch abzuklären, ob es sich bei stark erhöhten Werten um die Erkrankung Polycythaemia vera handelt.
Ein verringerter Hämoglobin-Wert wird als Anämie bezeichnet, eine verminderte Beladung der roten Blutkörperchen mit Hämoglobin als Hypochromasie.
Ein erhöhter/verringerter Hämoglobin-Wert ist immer abhängig vom Normalwert. Liegt der Normalwert bei 10,9 mmol/l, dann kann ein Wert von 8,4 mmol/l schon zu Symptomen von Anämie führen. Liegt der Normalwert bei 9 mmol/l, dann treten bei 8,4 mmol/l noch keine Symptome auf.
Die Höhe des Hämoglobinwertes ist maßgeblich bei der Zulassung zur Blutspende. Männer müssen einen Mindestwert von 8,4 mmol/l (13,5 g/dl), Frauen einen von 7,8 mmol/l (12,5 g/dl) aufweisen, um vom Spendearzt zugelassen zu werden. Bestimmt wird der Hb-Wert mittels elektronisch messender Hb-Photometer. Aktuelle Informationen des DRK-Blutspendedienstes besagen, dass Männer mit einem Hb von >11,2 mmol/l (18,0 g/dl) nicht mehr zur Spende zugelassen werden (12/2006). Dies ist jedoch nicht in allen Bundesländern der Fall, bei erhöhtem Hb-Wert wird weitere Flüssigkeitsaufnahme vor der Spende empfohlen.
Die Bestimmung des Hämoglobingehalts basiert auf dem Nachweis der Hämgruppen des Proteins. Daher wird als molare Hämoglobinkonzentration traditionell (so auch hier) die Konzentration der einzelnen Untereinheiten (mittlere molare Masse: 16114,5 g/mol)[15] angegeben.[15] Der Umrechenfaktor von g/dl zu mmol/l beträgt hierfür also 0,6206. Nach IUPAC und DIN 58931 wird die so berechnete (monomere) Hämoglobinkonzentration mit Hb(Fe) bezeichnet.[15] Da ein Hämoglobinkomplex-Molekül aus 4 Untereinheiten mit je einer Hämgruppe besteht, müssen die in mmol/l angegebenen Werte durch 4 geteilt werden, um die Konzentration des Hämoglobin-Tetramers (nach IUPAC und DIN 58931 mit Hb bezeichnet) zu erhalten (molare Masse: 64458 g/mol).[15] Der Umrechenfaktor von g/dl in mmol/l beträgt hierfür also 0,1551. Die in g/dl angegebenen Werte bleiben jeweils unverändert.
Sauerstoffbindung durch Hämoglobine auf molekularer Ebene
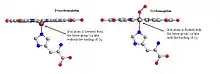
Bei der Bindung von Sauerstoff wird ein Disauerstoffmolekül (O2) in das Zentrum des Häm-Komplexes aufgenommen. Das Atom des zentralen Eisenions (FeII) geht durch die Sauerstoffbindung in einen low-spin-Zustand über. Dabei verringert sich seine Größe und es rutscht in die Ebene des Porphyrinrings.
Stabilisiert wird das gebundene Sauerstoffmolekül über eine Wasserstoffbrücke. Diese wird mit der Seitenkette des Globinproteins gebildet: einem distal gelegenen Histidinrest, der sich in der Nähe des Zentralatoms befindet. Jener proximale Histidinrest, über den das Eisenatom des Häms an die Proteinmatrix gebunden ist, liegt auf der anderen Seite der Ringebene.
Kooperativer Effekt bei der Sauerstoffbindung
Ein Hämoglobin, das aus vier Hb-Untereinheiten besteht, kann vier Sauerstoffmoleküle binden. Aus rein statistischen Erwägungen wäre zu erwarten, dass das Bestreben, weitere Sauerstoffmoleküle zu binden, mit jedem bereits gebundenen Sauerstoffmolekül abnimmt. Untersuchungen haben jedoch gezeigt, dass das Gegenteil der Fall ist und die Sauerstoffaffinität mit steigender Beladung zunimmt (positive Kooperativität).[16][17]
pH-Wert-Abhängigkeit der Sauerstoffbindung
Das Gleichgewicht zwischen R- und T-Form ist pH-abhängig (Bohr-Effekt) und wird bei einem niedrigen pH-Wert durch Protonierung zugunsten der weniger sauerstoffaffinen T-Form verschoben. Denselben Effekt hat ein hoher CO2 -Partialdruck durch eine reversible Carboxylierung der Untereinheiten. Dies führt dazu, dass hohe Protonen- und Kohlenstoffdioxid-Konzentrationen, wie sie z. B. durch Zellatmung und Milchsäuregärung im arbeitenden Muskel herrschen, eine vollständige Entladung des Hämoglobins begünstigen.
Konkurrenz zwischen Sauerstoff und Kohlenstoffmonoxid
Kohlenstoffmonoxid (CO) ist sehr giftig, da es mit dem Sauerstoff um die axialen Koordinationsstellen der Eisenzentren konkurriert. Einmal gebunden, kann CO z. B. lediglich durch Sauerstoffdruckbehandlung in einer Druckkammer verdrängt werden – es blockiert also Bindungsstellen für Sauerstoff. Bei starken Rauchern sind bis zu 10 Prozent des Hämoglobins mit CO besetzt.
An das freie Häm b bindet Kohlenstoffmonoxid 25000 Mal stärker als Disauerstoff, im Hämoglobin dagegen nur etwa 200 Mal. Die Ursache für die verringerte CO-Affinität ist, dass aufgrund des Raumbedarfes des distalen Histidins die vom Kohlenstoffmonoxid bevorzugte lineare Fe-CO-Koordination nicht möglich ist.
Effekte, welche die Sauerstoffbindung beeinflussen
Die Sauerstoffbindungskurve wird auf der Abszisse nach rechts verschoben durch:
- Temperaturanstieg
- Absinken des pH-Werts
- Steigerung der Konzentration von 2,3-Bisphosphoglycerat in den Erythrozyten
- Steigerung der Konzentration von Kohlenstoffdioxid
Die Rechtsverschiebung führt dazu, dass das Hämoglobin leichter Sauerstoff abgibt. Ein Beispiel: Ein arbeitender Muskel verbraucht sehr viel Sauerstoff für die Kontraktion. Da er die Energie zum Teil in Wärme umsetzt, steigt in der arbeitenden Muskulatur die Temperatur an. Außerdem setzt er Milchsäure frei, der pH-Wert sinkt. Durch den gesteigerten Stoffwechsel entsteht vermehrt Kohlenstoffdioxid: durch die lokalen Effekte kann die Muskulatur mehr Sauerstoff aus dem Blut entnehmen.
- Die Muskulatur verfügt über Myoglobin (siehe unten), das eine höhere Affinität zu Sauerstoff besitzt (Sauerstoff stärker anzieht). Es dient als Sauerstoff-Speicher.
Die Sauerstoffbindungskurve wird auf der Abszisse nach links verschoben durch:
- Temperaturabnahme
- Anstieg des pH-Werts
- Absinken der Konzentration von 2,3-Bisphosphoglycerat in den Erythrozyten
- Absinken der Konzentration von Kohlenstoffdioxid
Die Linksverschiebung führt dazu, dass Hämoglobin Sauerstoff stärker bindet. Dies macht man sich z. B. bei Herzoperationen zunutze, indem man den Patienten unterkühlt, um sein Blut maximal mit Sauerstoff zu sättigen. Tiere, die Winterschlaf halten, profitieren ebenfalls von diesem Effekt. In den Lungen wird ein Teil des Kohlendioxids im Zuge der Ausatmung abgegeben – das Hb kann wieder leichter mit Sauerstoff beladen werden.
Das im Rapoport-Luebering-Zyklus (Nebenweg der Glycolyse) durch das Enzym Bisphosphoglyceratmutase gebildete 2,3-Bisphosphoglycerat ist das wichtigste Intermediat der Glykolyse in den roten Blutkörperchen. Es bindet an Hämoglobin und verursacht einen allosterischen Effekt; die Abnahme der Affinität des Hämoglobins zum Sauerstoff. Es ist lebenswichtig, um die Abgabe von Sauerstoff im Organismus zu ermöglichen. Unter physiologischen Bedingungen liegt 2,3-BPG in den roten Blutkörperchen etwa in derselben Konzentration wie Hämoglobin vor. Eine Erhöhung der 2,3-BPG-Konzentration ist z. B. bei der Höhenanpassung zu beobachten. Sinn dieser Regulation ist folgender: Ist die Sauerstoffsättigung im Blut durch die „dünne Luft“ in großer Höhe vermindert, gibt Hb den gebundenen Sauerstoff an die Verbraucher schlechter ab als bei hoher Sättigung (siehe Bindungskurve). Trotzdem muss die Versorgung aller Organe mit O2 gewährleistet sein. Hb muss also weniger affin zum Sauerstoff werden, um die Peripherie ausreichend zu versorgen.
Hämoglobin-Typen
In verschiedenen Lebensphasen (Embryonalphase, Fetalphase und nach der Geburt, d. h. „adulte Phase“) sind beim Menschen verschiedene Hämoglobine zu finden. Diese Hämoglobine unterscheiden sich in ihrer Affinität für Sauerstoff. Sie bestehen aus jeweils vier Untereinheiten in paarweise verschiedener Zusammensetzung.
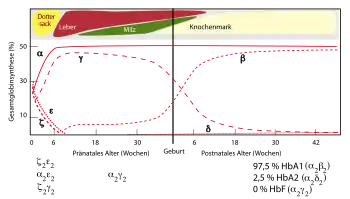
Entwicklungsgeschichtlich sind die unterschiedlichen Untereinheiten des Hämoglobins durch Genduplikationen des Globin-Gens entstanden. Die Kombinationen dieser Untereinheiten als Tetramer werden je nach Sauerstoffbedarf zu unterschiedlichen Zeitpunkten synthetisiert, beispielsweise um als Fötus im Mutterleib Sauerstoff aus dem mütterlichen Blut zu erhalten.
Während der Schwangerschaft wird Sauerstoff durch die Plazenta (Mutterkuchen) zum Fötus transportiert, den dieser dann effizient aufnimmt. Dies wird dadurch gewährleistet, dass die embryonalen und fetalen Hämoglobin-Typen eine deutlich höhere Sauerstoff-Bindungsaffinität haben als das später nachgeburtlich gebildete adulte Hämoglobin. Außerdem ist der Hämatokrit im Vergleich zur Mutter stark erhöht. Auf diese Weise gelangt durch die Nabelschnur genug Sauerstoff zum Fötus.
Embryonale Hämoglobine
Die embryonalen Hämoglobine werden in der Embryonalphase, den ersten 8 Wochen nach der Befruchtung, in Blutinseln des Dottersacks gebildet und tragen Eigennamen:
- Gower-1 (ζ2ε2) („zeta-epsilon“)
- Gower-2 (α2ε2) („alpha-epsilon“)
- Portland-1 (ζ2γ2) („zeta-gamma“)
- Portland-2 (ζ2β2) („zeta-beta“)
Fetale Hämoglobine
Als fetales Hämoglobin wird das während der Fetalperiode (ab der 9. Woche nach Befruchtung bis zur Geburt) vorwiegend gebildete Hämoglobin F (HbF) bezeichnet. Die Synthese des fetalen Hämoglobins beginnt schon in der vorangehenden Embryonalphase und wird auch nicht sofort nach der Geburt gestoppt, sondern hält noch einige Monate an. Bildungsort sind Leber und Milz. Es hat eine viel höhere Sauerstoffaffinität als adultes Hämoglobin, um den Sauerstoff aus dem mütterlichen Blut aufzunehmen.
- Hämoglobin F (α2γ2) – Im Fötus das dominierende Hämoglobin, bei gesunden Erwachsenen nur in Spuren nachweisbar
Adulte Hämoglobine
Als adulte Hämoglobine gelten Hämoglobin A (α2β2; HbA0 [früher Hb A1 genannt, die Bezeichnung HbA1c steht für eine glykierte Form][18]) und Hämoglobin A2 (α2δ2; HbA2). Die Synthese der adulten Hämoglobine beginnt schon im Fetus und ersetzt dann in den ersten Monaten nach Geburt das fetale Hämoglobin. Bildungsort ist das Knochenmark. Während des ersten Lebensjahres wird die Expression des γ-Gens abgesenkt und die des β-Gens erhöht.[19] Der Transkriptionsfaktor BCL11A ist der entscheidende Repressor des γ-Globins beim Erwachsenen.[20] Daher ist fetales Hämoglobin beim Erwachsenen nur in Spuren nachweisbar.
- Hämoglobin A (α2β2) – 98 %
- Hämoglobin A2 (α2δ2) – 2 %.
Glykohämoglobine
Glykohämoglobine entstehen durch Bindung von Glucose an Aminogruppen der Globine. Dies geschieht unter physiologischen Bedingungen nicht-enzymatisch durch den Kontakt des Hämoglobins mit dem Blutzucker (Glykierung). Die Hauptkomponente HbA0 des Hämoglobins A wird dabei vorwiegend in HbA1c umgewandelt, bei dem Glucose an die N-terminale Aminosäure Valin der β-Kette gebunden vorliegt. Der jeweilige Anteil von HbA1c am Gesamthämoglobin wird als Hinweis auf die durchschnittliche Blutzuckerhöhe der vergangenen Wochen interpretiert.
Methämoglobin
Methämoglobin (Met-Hb) ist eine deaktivierte, nicht sauerstoffaffine Form des Hämoglobins, in der das Eisenion sich in der Oxidationsstufe III statt II befindet. Das NADH-abhängige Enzym Methämoglobin-Reduktase (Diaphorase I) ist in der Lage, Methämoglobin wieder in Hämoglobin zu überführen. In der Regel liegen beim Menschen zwei Prozent des Hämoglobins als Methämoglobin vor. Ein höherer Anteil kann entweder genetisch bedingt oder Folge einer Vergiftung sein. Ein hoher Methämoglobinanteil hat eine mangelhafte Sauerstoffversorgung des Organismus zur Folge.
Abbau von Hämoglobin
Wenn die roten Blutkörperchen das Ende ihres Lebens (etwa 120 Tage) erreicht haben, werden sie in den mononukleären Phagozyten hauptsächlich in der Milz (und bei hohem Anfall von abzubauendem Hämoglobin auch in der Leber und im Knochenmark) abgebaut. Der Abbauprozess beginnt in der Milz und wird in der Leber fortgesetzt. Zuerst wird der Globinanteil vom Häm getrennt und zu Aminosäuren degradiert. Das Häm wird über eine Cytochrom-P450-abhängige Oxygenase (Hämooxygenase) zu Biliverdin gespalten, wobei Eisen (Fe2+) und Kohlenmonoxid frei werden. Das Eisen wird von den Makrophagen an das im Blut vorhandene Transportprotein Transferrin abgegeben. Die Biliverdin-Reduktase wandelt schließlich das grünliche Biliverdin in Bilirubin um. Dieses wird ins Blut abgegeben und an Albumin gekoppelt (da es schlecht wasserlöslich ist) und zur Leber transportiert. Hier wird das Bilirubin zweifach mit Glucuronsäure konjugiert und somit löslich gemacht – es kann nun mit der Galle in den Darm abgegeben und über den Stuhl ausgeschieden werden. Im Darm sorgen Bakterien dafür, dass die Glucuronsäure teilweise wieder gespalten wird, und auf diese Weise das orangefarbene Bilirubin reduziert wird zu farblosem Urobilinogen und zu braunem Sterkobilinogen. Ein geringer Anteil dieses reduzierten Bilirubins wird wieder über den Darm aufgenommen (enterohepatischer Kreislauf) und über die Niere ausgeschieden (gelbe Farbe des Urins). Verschiedene Lebererkrankungen wie die Leberentzündung (Hepatitis) oder Abflussbehinderungen in der Gallenblase (Gallensteine) führen zu einer erhöhten Bilirubinkonzentration. Bilirubin ist der Farbstoff, der bei Einlagerung in die Haut zur so genannten Gelbsucht (Ikterus = Gelbfärbung der Haut und Lederhaut (Sclera) der Augen) führt.
Rolle bei Krankheiten
Mutationen im HBA1-Gen können zu Defekten der α-Untereinheit und diese zu Heinz-Körper-Anämie und zur α-Thalassämie führen. Mutationen im HBB-Gen können die Ursache für Heinz-Körper-Anämie, β-Thalassämie und Sichelzellenanämie werden. Manche Varianten der HBG1/HBG2-Gene können Neugeborenengelbsucht verursachen.[21]
Reduzierte Hämoglobinwerte, mit oder ohne Reduktion der Zahl von roten Blutkörperchen, führen zu den Symptomen einer Anämie. Es gibt viele Ursachen für eine Anämie, wobei Eisenmangel der häufigste Grund in der westlichen Welt sein dürfte. Durch Eisenmangel wird die Häm-Synthese gehemmt. Als Folge sind die roten Blutkörperchen hypochrom (ohne die rote Farbe) und mikrozytisch (kleiner als normal).
Bei einer Hämolyse (verstärkter Abbau von roten Blutkörperchen) tritt ein Ikterus auf, verursacht durch den Hämoglobin-Metabolit Bilirubin. Bis zu einer Menge von 135 mg/dl wird in den Blutgefäßen freigesetztes Hämoglobin an Haptoglobin gebunden, bei einem stärkeren Blutzerfall kommt es zum Auftreten von freiem Hämoglobin im Blut (Hämoglobinämie).[22]
Eine Gruppe von genetischen Defekten, bekannt als Porphyrien, führen zu einer Störung der Hämsynthese. Durch die Anreicherung von Häm-Vorstufen kommt es unter anderem zu Lichtempfindlichkeit, Abdominalschmerzen und neurologischen Problemen sowie zur Porphyrinurie.
Bei der Methämoglobinämie wird das in den roten Blutkörperchen vorhandene Hämoglobin, das dem Sauerstofftransport dient, in das funktionsunfähige Methämoglobin umgewandelt und steht damit nicht mehr für den Sauerstofftransport zur Verfügung. Die Ursache dafür kann erblich bedingt sein (kongenitale Methämoglobinämie) oder durch Giftstoffe ausgelöst werden.
Mutationen in den Globinketten sind mit verschiedenen Hämoglobinopathien verbunden, wie die Sichelzellenanämie und Thalassämie.
Die Erreger der Malaria spalten Hämoglobin in von ihnen infizierten roten Blutkörperchen, um daraus Proteine für ihren eigenen Stoffwechsel zu gewinnen. Aus dem Häm entsteht dabei Hämozoin, das vom Parasiten kristallisiert wird und unter dem Mikroskop in den infizierten Erythrozyten als Pigment erkennbar ist. Das Malaria-Medikament Chloroquin hemmt diese Kristallisierung und der Parasit wird durch das Häm vergiftet.
Nachweis
Der Nachweis von Hämoglobin erfolgt durch den Teichmann-Test, bei dem Blut vorsichtig mit Kochsalz und Eisessig erwärmt wird, wobei sich Hämin (Teichmann-Kristalle) abscheidet, oder mit der Luminolreaktion, bei der eine Lösung aus Luminol sowie Natronlauge und eine Lösung aus Wasserstoffperoxid verwendet wird. Diese Reaktion findet nur in Anwesenheit eines Katalysators statt, im Nachweisfalle von Hämoglobin wäre dieser das Eisen(II)-Ion im Häm-Komplex.
Hämoglobin in Kunst und Musik

- Der deutsch-amerikanische Künstler Julian Voss-Andreae hat 2005 eine Skulptur geschaffen, die auf der Struktur des Hämoglobins beruht.[23][24] Das beabsichtigte Rosten des Werks ist eine Anspielung auf die Oxygenierung im Häm.
- Die britische Rockband Placebo nahm ein Lied mit dem Titel Haemoglobin auf.
- Der französische Rapper MC Solaar veröffentlichte im Jahr 1994 eine erfolgreiche Single mit dem Titel La concubine de l'hémoglobine.
- Die deutsche Melodic-Death-Metalband Deadlock hat auf ihrem Album "The Arrival" ein Lied mit dem Namen "Killing The Time With Haemoglobin" mit einer Länge von 11 Minuten.
Einzelnachweise
- Friedrich Ludwig Hünefeld: Der Chemismus in der thierischen Organisation. Brockhaus, 1840 (eingeschränkte Vorschau in der Google-Buchsuche).
- A NASA Recipe For Protein Crystallography. (PDF; 782 kB) In: Educational Brief. National Aeronautics and Space Administration, abgerufen am 2. Februar 2016.
- F. Hoppe-Seyler: Über die oxydation in lebendem blute. In: Med-chem Untersuch Lab. Band 1, 1866, S. 133–140.
- Georg Hoppe-Seyler: Felix Hoppe-Seyler – Arzt und Naturwissenschaftler.
- William Küster: Beiträge zur Kenntnis des Bilirubins und Hämins. In: Hoppe-Seylers Zeitschrift für Physiologische Chemie. Nr. 82, 1912, S. 463 ff.
- M. F. Perutz, M. G. Rossmann, A. F. Cullis, H. Muirhead, G. Will, A. C. T. North: Structure of H. In: Nature. Band 185, Nr. 4711, 1960, S. 416–422, doi:10.1038/185416a0, PMID 18990801.
- M. F. Perutz: Structure of hemoglobin. In: Brookhaven symposia in biology. Band 13, November 1960, ISSN 0068-2799, S. 165–183, PMID 13734651.
- M. F. Perutz, H. Muirhead, J. M. Cox u. a.: Three-dimensional Fourier synthesis of horse oxyhaemoglobin at 2.8 A resolution: (1) x-ray analysis. In: Nature. Band 219, Nr. 5149, Juli 1968, S. 29–32, doi:10.1038/219029a0, PMID 5659617.
- M. F. Perutz, H. Muirhead, J. M. Cox, L. C. Goaman: Three-dimensional Fourier synthesis of horse oxyhaemoglobin at 2.8 A resolution: the atomic model. In: Nature. Band 219, Nr. 5150, Juli 1968, S. 131–139, PMID 5659637.
- HbA1c and Glycated Hemoglobin (Memento vom 29. Januar 2012 im Internet Archive) Canterbury Scientific.
- UniProt P69905, UniProt P68871
- J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, München 2007, ISBN 978-3-8274-1800-5, S. 208ff.
- Robert F. Schmidt, Gerhard Thews (Hrsg.): Physiologie des Menschen. 25. Auflage. Springer-Verlag, Berlin 1993, ISBN 3-541-02636-7, S. 616–620.
- Erich Schütz, Heinz Caspers, Erwin-Josef Speckmann (Hrsg.): Physiologie. 16. Auflage. Urban & Schwarzberg, München 1982, ISBN 3-540-57104-3, S. 86–87.
- R. Zander, W. Lang, P. Lodemann: Das Molekulargewicht des Hämoglobins. Abgerufen am 13. August 2013.
- G. S. Adair: The hemoglobin system. VI. The oxygen dissociation curve of hemoglobin. In: J Biol Chem. Band 63, 1925, S. 529–545.
- D. E. Koshland, G. Némethy, D. Filmer: Comparison of experimental binding data and theoretical models in proteins containing subunits. In: Biochemistry. Band 5, Nummer 1, Januar 1966, S. 365–385, ISSN 0006-2960. PMID 5938952.
- Pschyrembel Online. Abgerufen am 29. Juli 2021.
- Hemoglobinopathies in the Fetal Position | NEJM. Abgerufen am 31. Januar 2019 (englisch).
- Vijay G. Sankaran, Tobias F. Menne, Jian Xu, Thomas E. Akie, Guillaume Lettre: Human fetal hemoglobin expression is regulated by the developmental stage-specific repressor BCL11A. In: Science (New York, N.Y.). Band 322, Nr. 5909, 19. Dezember 2008, ISSN 1095-9203, S. 1839–1842, doi:10.1126/science.1165409, PMID 19056937.
- UniProt P69905, UniProt P68871, UniProt P69891
- Wolfgang Piper: Innere Medizin. 2. Auflage. Springer, Berlin 2002, ISBN 978-3-642-33108-4, S. 639–640.
- Constance Holden: Blood and Steel. In: Science. Band 309, Nr. 5744, 30. September 2005, S. 2160, doi:10.1126/science.309.5744.2160d (sciencemag.org [PDF]).
- L. Moran, R. A. Horton, G. Scrimgeour, M. Perry: Principles of Biochemistry. Pearson, Boston, MA 2011, ISBN 978-0-321-70733-8, S. 127.
Literatur
- M. F. Perutz: Stereochemistry of cooperative effects in haemoglobin. In: Nature. Band 228, Nummer 5273, November 1970, S. 726–739, ISSN 0028-0836. PMID 5528785.
- L. Makowski, J. Bardhan u. a.: WAXS studies of the structural diversity of hemoglobin in solution. In: Journal of Molecular Biology, Band 408, Nummer 5, Mai 2011, S. 909–921, ISSN 1089-8638. doi:10.1016/j.jmb.2011.02.062. PMID 21420976. PMC 3081904 (freier Volltext).
- T. Yonetani, M. Laberge: Protein dynamics explain the allosteric behaviors of hemoglobin. In: Biochimica et biophysica acta, Band 1784, Nummer 9, September 2008, S. 1146–1158. doi:10.1016/j.bbapap.2008.04.025. PMID 18519045. PMC 2668241 (freier Volltext). (Review).
- Martin D. Vesper, Bert L. de Groot, Dennis R. Livesay: Collective Dynamics Underlying Allosteric Transitions in Hemoglobin. In: PLoS Computational Biology. Band 9, 2013, Artikel e1003232, doi:10.1371/journal.pcbi.1003232.
Weblinks
- Interaktives 3D-Modell von Hämoglobin – Proteopedia (engl.)
- Molekül des Monats: Hämoglobin (englisch)
- Jennifer McDowall/Interpro: Protein Of The Month: Haemoglobin. (engl.)