Ether
Als Ether (in der Gemeinsprache auch Äther[1]) werden in der Chemie organische Verbindungen bezeichnet, die als funktionelle Gruppe eine Ethergruppe – ein Sauerstoffatom, das mit zwei Organylresten substituiert ist – besitzen (R1–O–R2). In der Umgangssprache bezeichnet Ether oft auch den Diethylether (H5C2–O–C2H5), einen der wichtigsten und einfachsten Ether. Sind beide Reste an der Sauerstoffbrücke aliphatisch, so werden diese Ether nach der IUPAC auch als Alkoxyalkane bezeichnet.[2]
| Ether |
|---|
 |
| R1 und R2 sind Organylgruppen. Das Sauerstoffatom des Ethers ist blau markiert. |
Natürliches Vorkommen
Ether sind in der Natur weit verbreitete Verbindungen. Die glycosidische Bindung der Polysaccharide ist eine Sauerstoffbrücke zwischen zwei Kohlenstoffatomen; diese Acetale sind faktisch intramolekulare, geminal angeordnete Di-Ether.[3] Auch viele andere Naturstoffe, wie z. B. die Aromastoffe Anethol, 1,8-Cineol, Eugenol und Vanillin, sowie die Gruppen der Ubichinone und Strobilurine und viele Arzneistoffe sind Ether.
Struktur
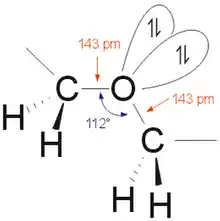
Allgemein kann ein Ether als
dargestellt werden. R1 und R2 sind hier Alkyl- oder Aryl-Reste, die im Fall eines cyclischen Ethers miteinander verbunden sind. Es sind auch Alkyl-Aryl-Ether möglich (siehe Anisol und Vanillin). Die Bindungsverhältnisse in Ethern ähneln denen in Alkoholen und im Wasser, das als Grundkörper dieser beiden Verbindungsklassen aufgefasst werden kann. Kohlenstoff- und Sauerstoff-Atome sind jeweils sp3 hybridisiert. Dies führt zu einer tetraedrischen Anordnung der Atomorbitale um alle beteiligten Atome. Der Bindungswinkel des Sauerstoffs ist aufgrund der gegenüber Wasserstoff (104,5° im H2O) voluminöseren Alkylsubstituenten mit 112° erweitert. Die C–O-Bindungen sind mit ca. 143 pm so lang wie in Alkoholen.
Nomenklatur
Gemäß der IUPAC-Nomenklatur werden aliphatische Ether als Alkoxyalkane bezeichnet: R1–O–R2, wobei die Gruppe O–R2 als Alkoxy-Substituent einer Alkan-Kette R1 behandelt wird. Der niederrangigere Substituent der Kette ist hierbei der Alkoxy-Rest (–O–R2), der höherrangigere bildet den Stamm des Stoffnamens. Ebenfalls von der IUPAC zugelassene Namen werden durch Nennung der beiden Alkylreste und der Endung ether gebildet und sind besonders für kleine, aliphatische Ether gebräuchlich. Bei symmetrischen Ethern ist dann die Bezeichnung sehr einfach durch Vorstellen eines Di möglich [z. B.: Diethylether (Ethoxyethan) oder Dimethylether (Methoxymethan)]. Cyclische und aromatische Ether sind fast sämtlich nur unter ihrem Trivialnamen bekannt.
Geradkettige und verzweigte Ether
Entsprechend verläuft die Benennung der Alkoxyalkane. Beispiele:
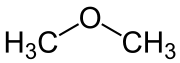
- Die Verbindung H3C–O–CH3 setzt sich zusammen aus einem H3C–O-Substituenten und dem Methyl-Rest (CH3) als Stamm, wobei hier allerdings beide Reste gleichwertig sind. Entsprechend heißt die Verbindung Methoxymethan oder Dimethylether:
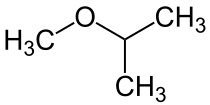
- H3C–O–CH(CH3)2 heißt 2-Methoxypropan oder Isopropylmethylether. Die höherrangige Propan-Kette bildet den Stammnamen, an die ein Methoxy-Substituent an 2- (bzw. iso-) Position des Propylrestes gebunden ist:
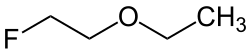
- FH2C–CH2–O–CH2-CH3 wird als 1-Ethoxy-2-fluorethan bezeichnet. Zwar sind beide Ketten prinzipiell gleichrangig, aber der fluorierte (und damit höher substituierte) Rest bildet den Namensstamm:
Cyclische Ether
Cyclische Ether werden als Cycloalkane betrachtet, bei denen ein (oder mehrere) C-Atome durch (ein) O-Atom(e) ersetzt wurde(n). Um dies zu verdeutlichen, wird entsprechend dem Hantzsch-Widman-System die Silbe „Oxa“ an der entsprechenden Position eingefügt. Beispiel:
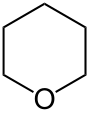
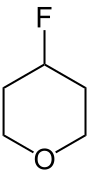
Die Verbindung wird fast ausschließlich unter dem Namen Tetrahydropyran geführt, der IUPAC-Name ist Oxacyclohexan. Die Verbindung ist cyclisch (cyclo), hat eine Ringgröße von 6 Atomen (hexan) und an einer Position ist ein C-Atom durch ein Sauerstoff-Atom ersetzt (oxa). Entsprechend gilt für die folgende Verbindung der Name 4-Fluoroxacyclohexan oder gängiger: 4-Fluortetrahydropyran [dem Heteroatom (Sauerstoff, O) im Ring wird dabei die Position 1 zugeordnet].
Eigenschaften
Die meisten Ether sind relativ reaktionsträge und werden daher oft als Lösungsmittel in der präparativen organischen Chemie verwendet. Da höhere Ether aufgrund wachsender sterischer Hinderungen schlechter Wasserstoffbrückenbindungen ausbilden können, nimmt die Löslichkeit in Wasser mit zunehmender Größe des Alkylrestes schnell ab.
| Ausgewählte Daten einiger offenkettiger Ether | |||||
|---|---|---|---|---|---|
| Ether | Struktur | Smp. °C | Sdp. °C | Löslichkeit (in einem Liter H2O) | Dipolmoment |
| Dimethylether[4] | H3C–O–CH3 | −141,5 | −24,8 | 70 g (20 °C) | 1,30 D |
| Diethylether[5] | H5C2–O–C2H5 | −116 | 35 | 69 g (20 °C) | 1,14 D |
| Di-n-propylether[6] | H7C3–O–C3H7 | −122 | 90 | 3,8 g (25 °C) | 1,32 D |
In starken Säuren sind Ether wegen der darin erfolgenden Protonierung unter Bildung von Oxoniumionen dagegen gut löslich.
Die physikalischen Eigenschaften der Ether unterscheiden sich deutlich von denen der entsprechenden Alkohole mit ähnlicher molarer Masse. Die Schmelz- und Siedepunkte der Ether sind erheblich niedriger als die der vergleichbaren Alkohole, siehe den Alkohol Morphin (Smp. 253 °C) und dessen Methoxyether Codein (Smp. 157 °C). Die hohe Elektronegativität des Sauerstoffs bestimmt jedoch ähnlich wie bei den Alkoholen wesentlich die Eigenschaften der Ether. Besonders bei cyclischen Ethern führt dies zur Ausbildung eines ausgeprägten Dipolmoments. Außerdem liegt das polare Sauerstoff-Atom in einer cyclischen Struktur exponierter vor. Dies wird von der Wasserlöslichkeit einiger cyclischer Ether bewiesen.
| Ausgewählte Daten einiger cyclischer Ether | |||||
|---|---|---|---|---|---|
| Ether | Struktur | Smp. °C | Sdp. °C | Löslichkeit (in einem Liter H2O) | Dipolmoment |
| Tetrahydrofuran | 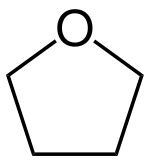 | −108,4 | 66,0 | beliebige Menge | 1,74 D |
| 1,4-Dioxan | 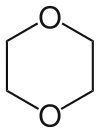 | 11,8 | 101,3 | beliebige Menge | 0,45 D |
Das niedrige Dipolmoment des 1,4-Dioxan wird durch seine symmetrische Struktur verursacht: die beiden sich im Ring gegenüberstehenden Sauerstoffatome verringern die Gesamtpolarität des Moleküls.
Ethersynthese
Williamson-Ethersynthese
Für Ether sind verschiedene Synthesewege möglich. Der wohl bekannteste Mechanismus ist die Williamson-Ethersynthese. Hierbei wird ein Alkali-Alkoholat mit einem Halogenalkan umgesetzt, wobei neben dem entsprechenden Alkali-Halogen-Salz (nicht gezeigt) der Ether entsteht.
Die Reaktion verläuft nach einem SN2-Mechanismus und wird zur Darstellung einfacher und gemischter Ether benutzt. Als Nebenreaktion kann Eliminierung auftreten, weshalb die Anwendung der Williamson-Ethersynthese mit tertiären Halogenalkanen nicht sinnvoll ist.
Die Williamson-Ethersynthese führt bei intramolekularer Reaktion zu cyclischen Ethern. Der einfachste Vertreter dieser Klasse ist Oxacyclopropan (Ethylenoxid, Oxiran); der bekannteste Vertreter Tetrahydrofuran (THF), ein beliebtes Lösemittel in der organischen Chemie.
Säurekatalysierte Kondensation von Alkoholen
Unter Säurekatalyse (hier Schwefelsäure) können zwei Moleküle Alkohol (gezeigt am Beispiel von Ethanol) unter Wasserabspaltung zu einem Ether (hier Diethylether) kondensiert werden:
Bei Verwendung nur einer Alkoholart (hier Ethanol) können auf diesem Weg symmetrische Ether (R–O–R) dargestellt werden. Verwendet man Gemische von z. B. zwei Alkoholen (z. B. R1–OH und R2–OH), so können unter Einwirkung von Schwefelsäure oder Phosphorsäure drei verschiedene Ether entstehen:
- R1–O–R1 (symmetrischer Ether)
- R2–O–R2 (symmetrischer Ether)
- R1–O–R2 (unsymmetrischer Ether)
Addition von Alkoholen an Doppelbindungen
Alkohole können an Doppelbindungen addieren, wobei zunächst das Proton einer zugesetzten Säure elektrophil an die Doppelbindung addiert wird. Anschließend lagert sich der Alkohol nukleophil an, nach anschließender Deprotonierung entsteht der Ether:
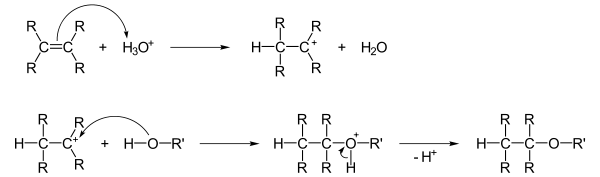
Besondere Ether
Heteroether
Neben den „normalen“ Ethern, also Alkylresten mit Sauerstoffbrücke, gibt es auch Analoga mit Verwandten des Sauerstoffs. In der 6. Hauptgruppe folgt auf den Sauerstoff der Schwefel. Dieser bildet entsprechend den oben beschriebenen Regeln so genannte Thioether. Bei diesen ist die Sauerstoffbrücke durch eine Schwefelbrücke ersetzt. Zu den bekanntesten Thioethern zählen das „Senfgas“ oder S-Lost sowie die Aminosäure Methionin.
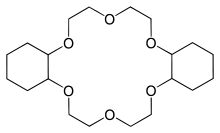
Kronenether
Kronenether sind eine besondere Gruppe von cyclischen Ethern, die aufgrund ihrer Bedeutung sowohl in der Chemie von Lebewesen als auch in der technischen Chemie Erwähnung verdienen. Allgemein sind es cyclische Ether, die aus aneinander gebundenen 1,2-Diethern bestehen. Die gängige Nomenklatur von Kronenethern ist ungewöhnlich. Einer der einfachsten Kronenether ist [12]Krone-4. Hierbei gibt [12] die Gesamtzahl der Atome (ohne Wasserstoffatome) in der cyclischen Ether-Teilstruktur an und -4 die Anzahl der Sauerstoffatome in diesem Molekülteil. Kronenether besitzen die einzigartige Fähigkeit, Metallatome (bzw. Metallionen) in einer Art Käfigstruktur zu binden und dadurch als Bausteine zu Transportsystemen dieser Metalle zu dienen.[7]
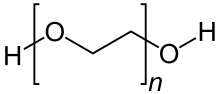
Polyether
Langkettige Verbindungen der Art
heißen Polyether (auch Polyalkylenglycole, Polyetherpolyole, Polyalkylenoxide). Beispiele für diese Gruppe polymerer Ether sind Polyethylenglycol und Polypropylenglycol, die beide durch katalytische Polymerisation der entsprechenden Epoxide (Oxirane) Ethylenoxid bzw. Propylenoxid hergestellt werden. In Fall von Polyethylenglycol und Polypropylenglycol sind alle Reste (R1, R2, R3…) mit Ausnahme der Endglieder der Ketten identisch. Bei der Umsetzung von Epoxiden mit Diolen können verschiedenste Polymere hergestellt werden. Die Zugabe eines einfachen Alkanols stoppt die Polymerisierung.

Neben Diolen können auch mehrwertige Alkohole, wie z. B. Glycerin, 1,1,1-Trimethylolpropan (TMP), Pentaerythrit oder Sorbit mit Epoxiden in Gegenwart starker Basen (z. B. KOH) zu Polyetherpolyolen umgesetzt werden. Die monomeren Polyole wirken quasi als Starter für die basenkatalysierte ringöffnende Polymerisation von Oxiranen. In Analogie dazu steht die säurekatalysierte ringöffnende Polymerisation von Tetrahydrofuran zum Polyetherdiol Polytetramethylenglycol (PTMEG), auch Polytetrahydrofuran (PolyTHF) genannt. Aus monomeren Triolen (Glycerin, TMP) werden mit Epoxiden entsprechend Polyethertriole erhalten. Bei der Polymerisation entstehen Gemische, die sich in der Molmassenverteilung der einzelnen Polyethertriolmoleküle und in den Kettenlängen der Ethersequenzen unterscheiden. Blockcopolymere können gezielt durch sequentielle Polymerisation mit unterschiedlichen Epoxiden hergestellt werden, wobei Copolymere mit außenständigen Ethylenoxideinheiten primäre, solche mit außenständigen Propylenoxideinheiten sekundäre Hydroxygruppen (mit verringerter Reaktivität) aufweisen.
Zur Charakterisierung von Polyetherpolyolen wird häufig die Hydroxylzahl (OH-Zahl) angegeben, deren Zahlenwert mit der Funktionalität des monomeren Polyols ansteigt und mit der molaren Masse des Polyetherpolyols abnimmt. Gängige Polyetherpolyole sind Lupranol (BASF) und Desmophen (Covestro).
Auch Epoxidharze sind Polyether mit endständigen Epoxidgruppen. Polyetherdiole, wie z. B. Polyethylenglycol, sind wichtige Vorprodukte bei der Reaktion mit Isocyanaten zu Polyurethanen.
Polycarboxylatether werden als Fließmittel oder Betonverflüssiger verwendet[8] und machen Mörtelmassen geschmeidiger.
Gefahrenhinweise und Lagerung
Autoxidation
Bei Aufbewahrung von Ethern an Licht bilden diese mit Luftsauerstoff Peroxide. Diese können sich bei der (Vakuum-)Destillation eines Ethers im Rückstand ansammeln und zu Explosionen führen.
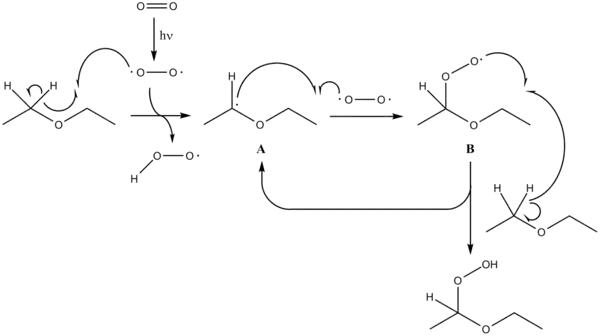
Dabei wird in α-Stellung zum Sauerstoff-Atom ein Wasserstoff-Atom unter Bildung eines Radikals abstrahiert und es bildet sich mit Sauerstoff ein Peroxid.[9] Eine Ausnahme stellt Methyl-tert-butylether (MTBE) dar, da dieser auf der tert-Butyl-Seite kein α-ständiges Wasserstoff-Atom besitzt und auf der Methylseite die Entstehung eines Radikals zu ungünstig ist. Die Peroxide können meist durch die Braunverfärbung von essigsauren Iodid-Lösungen nachgewiesen werden. Dabei wird Iodid zu Iod oxidiert, welches mit Iodid zu I3− reagiert und für die braune Farbe verantwortlich ist. Im Handel sind zudem spezielle Teststäbchen erhältlich. Die Vernichtung von Peroxiden kann beispielsweise mit Eisen(II)-Salzen erfolgen. Die Lagerung von Ethern für den Labor-Gebrauch sollte daher nur in kleinen Gebinden unter Lichtausschluss erfolgen, Metallkannen sind wegen ihrer Lichtundurchlässigkeit ideal. Ether, der längere Zeit gelagert wurde und im Besonderen, wenn das Gebinde nur teilweise gefüllt ist, sollte vor Gebrauch auf Peroxide geprüft werden. Cyclische Ether wie Tetrahydrofuran und Dioxan neigen stärker zur Peroxidbildung als acyclische.
Sonstiges
Bei dem Umgang mit niederen Ethern sollte deren niedriger Siedepunkt und leichte Entflammbarkeit nie unterschätzt werden. (Diethyl)Ether-Luft-Gemische sind zwischen 2 und 36 Vol.-% Ether explosiv. Wichtig ist, dass Ether-Dämpfe nicht nur farblos, sondern auch schwerer als Luft sind. Sie sammeln sich also an tiefgelegenen Stellen. Aufgrund dieser Tatsache und der narkotisierenden Wirkung von Ethern sind sie nur in gut funktionierenden Abzügen zu verwenden.
Verwendung
Aufgrund ihres ambivalenten Charakters sind die meisten Ether hervorragende Lösungsmittel und lösen viele wasserunlösliche Verbindungen. So wird der Großteil des produzierten Diethylethers als Lösungsmittel im Umfeld der chemischen und medizinischen Industrie sowie im Laborbedarf verbraucht.
Sonstiges
- Das Wort Äther leitet sich wie englisch ether her vom griechischen Wort αἰθήρ aithḗr, „die obere Luft“ (zugrunde liegt indogermanisch aith, „brennen“). in die modernen Sprachen übernommen wurde das Wort via lateinisch aether. Bei Paracelsus ist damit „die oberste Luftschicht“ bzw. „der gestirnte Himmel“ gemeint. Das Adjektiv dazu lautet ätherisch (schon 1520 auch etherisch).[10]
- Im Jahr 1730 übertrug Frobenius das Wort Äther auf das von ihm dargestellte Betäubungs- und Lösungsmittel:[11] Diethylether diente als einer der ersten Stoffe in der modernen Anästhesie als Anästhetikum. Aufgrund der starken Nebenwirkungen (ausgeprägte Erregungsphase, Übelkeit) und seiner Brennbarkeit ist er jedoch bei der Narkose nur noch von historischem Interesse. Zur Zeit der Prohibition diente Diethylether teilweise als Ethanol-Ersatz (orale Einnahme) und vereinzelt sind auch noch heute Fälle von Etherkonsum bekannt. Die physiologische Wirkung ist ähnlich der des Alkohols. Beim Abbau des Diethylethers im Körper entsteht unter anderem Ethanol.
- In der naturwissenschaftlichen Fachsprache des 19. Jahrhunderts wurde mit Äther die „feine Masse jenseits der Lufthülle der Erde“ bezeichnet.[12]
Einzelnachweise
- Duden (24. Auflage 2006) gibt dafür: Äther, fachspr. auch Ether.
- Axel Zeeck: Chemie für Mediziner, 6. Auflage, Elsevier Urban & FischerVerlag, 2006, ISBN 978-3-437-44435-7, S. 215.
- Eintrag zu Acetals. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00062.
- Eintrag zu CAS-Nr. 115-10-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu CAS-Nr. 60-29-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu CAS-Nr. 111-43-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- Axel Zeeck: Chemie für Mediziner, 6. Auflage, Elsevier Urban & FischerVerlag, 2006, ISBN 978-3-437-44435-7, S. 219.
- Alexander Göthlich, Sebastian Koltzenburg, Gunnar Schornik: Funktionale Polymere im Alltag. In: Chemie in unserer Zeit. Band 39, 2005, S. 262–273, doi:10.1002/ciuz.200400346.
- R. Brückner: Reaktionsmechanismen, 3. Aufl., Spektrum, Heidelberg/Berlin 2004, ISBN 3-8274-1579-9, S. 41–43.
- Friedrich Kluge: Etymologisches Wörterbuch der deutschen Sprache. De Gruyter, Berlin/ New York 1975, ISBN 3-11-005709-3, S. 34 f. (Äther).
- Friedrich Kluge: Etymologisches Wörterbuch der deutschen Sprache. 1975, S. 34.
- Friedrich Kluge: Etymologisches Wörterbuch der deutschen Sprache. 1975, S. 35.
Literatur
- H. Beyer, W. Walter: Lehrbuch der Organischen Chemie, 21. Auflage, S. Hirzel-Verlag, Stuttgart 1988, S. 144–147.
- A. Streitwieser, C. H. Heathcock, E. M. Kosower: Organische Chemie, VCH, Weinheim 1994, S. 232–243.
- Peter G. M. Wuts, Theodora W. Greene: Greene’s Protective Groups in Organic Synthesis, 4. Auflage, Wiley & Sons, 2007, S. 24–42.