Lipide
Lipide und Lipoide (von altgriechisch λίπος lípos „Fett“ und -id/-oid, Sinn etwa „fettartiger/Fetten ähnelnder Stoff“; Betonung auf der [im Nominativ Singular] letzten Silbe: Lipíd/Lipoíd) sind Sammelbezeichnungen für ganz oder zumindest größtenteils wasserunlösliche (hydrophobe) Naturstoffe, die sich dagegen aufgrund ihrer geringen Polarität sehr gut in hydrophoben (beziehungsweise lipophilen) Lösungsmitteln wie Hexan lösen. Ihre Wasserunlöslichkeit rührt vor allem von den langen Kohlenwasserstoff-Resten her, welche die allermeisten Lipide besitzen. Man teilt sie grob in verseifbare und nicht verseifbare Lipide ein.[1]
In lebenden Organismen werden Lipide hauptsächlich als Strukturkomponenten in Zellmembranen, als Energiespeicher oder als Signalmoleküle gebraucht. Die meisten biologischen Lipide sind amphiphil, besitzen also einen lipophilen Kohlenwasserstoff-Rest und eine polare hydrophile Kopfgruppe, deshalb bilden sie in polaren Lösungsmitteln wie Wasser Mizellen oder Membranen. Oft wird der Begriff „Fett“ als Synonym für Lipide gebraucht, jedoch stellen die Fette (Triglyceride) nur eine Untergruppe der Lipide dar.
Die Lipide können in sieben Stoffklassen eingeteilt werden: Fettsäuren, Triglyceride (Fette und fette Öle), Wachse, Phospholipide, Sphingolipide, Lipopolysaccharide und Isoprenoide (Steroide, Carotinoide etc.). Nicht natürliche oder synthetische Stoffe dieser Klassen werden in der Regel nicht als Lipide bezeichnet.
Fettsäuren, Triacylglycerole (Fette und fette Öle) und Wachse
Fettsäuren
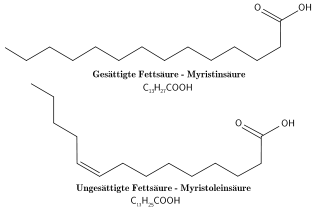
Fettsäuren sind meist unverzweigte Monocarbonsäuren, die aus einer Kohlenwasserstoffkette bestehen, an deren einem Ende sich eine Carboxygruppe befindet (siehe Bild).
Unterschieden wird zwischen gesättigten Fettsäuren, in denen keine Doppelbindungen vorkommen, und ungesättigten Fettsäuren, die eine oder mehrere Doppelbindungen besitzen (in der Natur meist in cis-Stellung und nicht in Konjugation miteinander). Die einfachste gesättigte Fettsäure ist die Buttersäure mit nur vier Kohlenstoffatomen.
Wichtige Vertreter der ungesättigten Fettsäuren sind Ölsäure (einfach ungesättigt) und Arachidonsäure (vierfach ungesättigt). Ungesättigte Fettsäuren können vom tierischen Organismus nur unter Einschränkung synthetisiert werden. Man bezeichnet daher all jene Fettsäuren, die mit der Nahrung aufgenommen werden müssen, als essenzielle Fettsäuren (s. u.). Je mehr Doppelbindungen eine Fettsäure enthält, desto niedriger liegt ihr Schmelzpunkt.
Triacylglycerole (Fette und fette Öle)
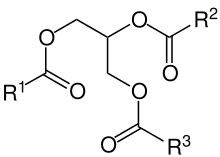
Die Seitenketten R1, R2 und R3 stehen für Alkylreste der Fettsäuren.
Siehe die Hauptartikel Fette und fette Öle, sowie Triacylglycerole.
Die Triacylglycerole (Triglyceride) machen mit mehr als 90 Prozent den Hauptanteil der Nahrungslipide aus. Sie sind ein wichtiger Energielieferant (1 g Fett enthält 38,9 kJ Energie, 1 g Zucker nur 17,2 kJ). Außerdem bilden Triacylglycerole den wichtigsten Energiespeicher des Körpers (Zucker, d. h. Glucose, wird zur Speicherung auch in Fett umgewandelt und nur in vergleichsweise geringen Mengen als kurzfristiger Puffer als Glykogen in der Leber und Muskulatur gespeichert), sie sind ein guter Kälteschutz in der Haut und schützen diese auch vor Verletzungen. Alle wichtigen Organe werden durch einen Fettmantel geschützt. Triacylglycerole bestehen aus Glycerol (Glycerin) und drei mit dem Glycerol veresterten Fettsäuren. Liegen sie bei Raumtemperatur (20 °C) flüssig vor, bezeichnet man sie als Öle, liegen sie fest vor als Fette. Wie schon erwähnt sind dies wichtige Energiespeicher für Tiere und Pflanzen. Werden Triacylglycerole durch Verseifung gespalten, entstehen Glycerin und die entsprechenden Salze der Fettsäuren.
Echte Wachse
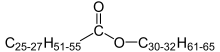
Wachse sind Einfach-Ester von Fettsäuren und unterscheiden sich als solche von den Dreifach-Estern der Fette und Öle. Sowohl der Säuren- als auch der Alkoholteil von Wachsen haben lange gesättigte Alkylreste. Im Gegensatz zu Triglyceriden sind Wachse weniger „ölig“, außerdem härter und poröser.
Wachse als Stoffklasse
Eine andere Definition (Deutsche Gesellschaft für Fettwissenschaft) sieht Wachse als Stoffklasse, die ausschließlich über ihre mechanisch-physikalischen Eigenschaften definiert wird. Laut dieser Definition sind Wachse bei 20 °C knetbar, fest bis brüchig hart, sie weisen eine grobe bis feinkristalline Struktur auf, farblich sind sie durchscheinend bis opak (undurchsichtig), aber nicht glasartig, über 40 °C schmelzen sie ohne Zersetzung, wenig oberhalb des Schmelzpunktes sind sie leicht flüssig (wenig viskos), weisen eine stark temperaturabhängige Konsistenz und Löslichkeit auf und sind unter leichtem Druck polierbar.
Membranbildende Lipide
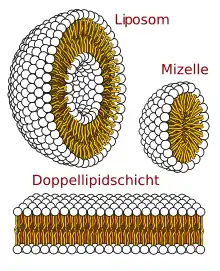
Membranbildende Lipide sind solche, die einen hydrophilen und einen hydrophoben Teil besitzen – also amphiphil sind. Dies erlaubt es ihnen, als vergleichsweise polare Lipide, in polaren Lösungsmitteln wie Wasser je nach Beschaffenheit entweder Mizellen (kugelförmige Aggregate aus amphiphilen Molekülen, die sich in einem Dispersionsmedium spontan zusammenlagern) oder Doppellipidschichten zu bilden – wobei immer der hydrophile Teil mit dem polaren Lösungsmittel interagiert. Aus diesen Doppellipidschichten sind, mit Ausnahme der Membranen von Archaeen, alle Biomembranen aufgebaut, welche den Inhalt einer Zelle gegen die Umgebung abgrenzen. Membranbildende Lipide sind daher eine Grundvoraussetzung für die Zellbildung und somit für das Leben.
Phospholipide
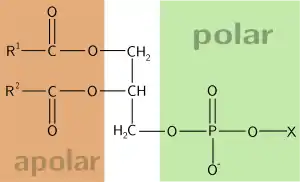
Die Reste R1 und R2 bestimmen die Fettsäuren, der Rest X bestimmt die Klasse. Bei X = H liegt Phosphatidsäure vor
Phospholipide bilden den Hauptbestandteil von Biomembranen. Man unterscheidet dabei Phosphoglyceride und Sphingomyeline. Die Struktur der Phosphoglyceride leitet sich von der Phosphatidsäure ab, welche den Triglyceriden ähnelt, mit dem Unterschied, dass sich an der C3-Hydroxygruppe statt des Acylrestes eine Phosphorylgruppe befindet. Diese gehören, wie auch die Triacylglyceride, zu den Glycerolipiden. Sphingomyeline hingegen unterscheiden sich von Glycerolipiden durch ihr Sphingosin-Grundgerüst. Die Phosphorsäurediestergruppe aller Phospholipide ist hydrophil (d. h. interagiert mit Wasser) und wird „Kopf“ genannt. Die Acylreste beziehungsweise der unpolare Teil des Sphingosins werden als „Schwanz“ bezeichnet und sind hydrophob. Dieser gegensätzliche Charakter führt zur Bildung von Lipid-Doppelschichten, bei denen der hydrophobe Teil der Membranlipide nach innen und der hydrophile Teil nach außen zeigen. Die wichtigsten am Aufbau von Biomembranen beteiligten Phospholipide sind die Phosphoglyceride Phosphatidylcholin (auch Lecithin), Phosphatidylethanolamin, Phosphatidylserin sowie Sphingomyeline. Letztere zählen sowohl zu den Phospho- als auch den Sphingolipiden. Phosphatidylethanolamin und Phosphatidylserin werden auch als Kephaline bezeichnet. Eine vor allem in der intrazellulären Weiterleitung extrazellulärer Signale (Signaltransduktion) wichtige Gruppe der Phosphoglyceride sind die in verschiedenen Phosphorylierungsstufen auftretenden Phosphatidylinositole; als Kopfgruppe besitzen sie ein Phosphoinositol.
Sphingolipide
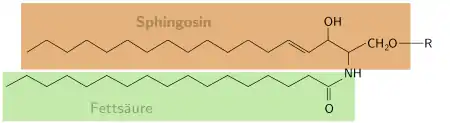
Verschiedene Reste (R) ergeben unterschiedliche Untergruppen.
Wasserstoff – Ceramide
Phosphocholin oder Phosphoethanolamin – Sphingomyeline
Saccharid – Glycolipide
Sphingolipide sind ebenfalls Bestandteile von Zellmembranen. Ihr Grundgerüst besteht aus einer Fettsäure und Sphingosin. Sie werden unterschieden in die Gruppen der Ceramide, der Sphingomyeline und Glycolipide. Sphingolipide finden sich im Nervengewebe, sie spielen eine wichtige Rolle in der Signalübertragung und der Interaktion einzelner Zellen.
Glycolipide
Glycolipide sind phosphatfreie, sphingosinhaltige Lipide mit einem glycosidisch an die 1-Hydroxy-Gruppe des Sphingosin gebundenen Kohlenhydrat-Anteil. Sie bilden häufig die Außenseite biologischer Membranen, wobei ihr Kohlenhydrat-Anteil auf der Zellmembran präsentiert wird. Es wird vermutet, dass diese eine Rolle in der Kommunikation und Interaktion zwischen einzelnen Zellen spielen. Glycolipide werden in Cerebroside, Ganglioside und Sulfatide unterschieden.
Etherlipide
Etherlipide sind der Hauptbestandteil der Zellmembranen von Archaeen, nicht aber bei Bakterien oder Eukaryoten.[2] In Archaeen sind die Etherlipide aus Glycerol mit Isoprenoiden aufgebaut. In geringem Umfang werden Etherlipide auch von Eukaryoten gebildet.
Isoprenoide
Als Isoprenoide werden Verbindungen bezeichnet, die auf Isopreneinheiten aufbauen. Zu den Lipiden zählende Verbindungen sind die Steroide, Terpene und Terpenoide sowie die Carotinoide. Natürlich vorkommende Steroide gehören zu den Triterpenoid-Derivaten (Triterpenoid bedeutet, dass es aus 30 Kohlenstoffatomen besteht), da sie alle von Squalen ausgehend biosynthetisiert werden. Carotinoide werden zu den Tetraterpenoid-Derivaten (40 Kohlenstoffatome) gezählt, sie leiten sich von Lycopen ab.
Steroide
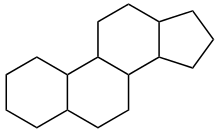
Alle Steroide haben als Grundstruktur ein System aus vier, üblicherweise trans-verbundenen Kohlenstoffringen, drei sechseckigen und einem fünfeckigen. Der bekannteste Vertreter der Steroide ist das zu den Sterinen zählende Cholesterin. Es ist unter anderem auch ein essentieller Bestandteil aller Zellmembranen mit Ausnahme der Innenmembran der Mitochondrien und kann somit im erweiterten Sinne auch zu den Membranlipiden gezählt werden. Es liegt in der Regel in veresterter Form als Cholesterinester der Fettsäuren vor. Das Spektrum der Fettsäuren der Cholesterinester in einem Lebewesen ist stark von seiner Ernährung abhängig.
Gallensäuren, die an der Fettverdauung beteiligt sind, besitzen einen hydrophoben und einen hydrophilen Teil, können somit Fette ummanteln und damit deren Absorption im Verdauungstrakt erleichtern.
Zu den Steroiden gehören auch die in den Eierstöcken und den Hoden produzierten Sexualhormone. Sie steuern die Fortpflanzung und die Ausbildung der sekundären Geschlechtsmerkmale. Die weiblichen Geschlechtshormone sind Progesteron und Östrogen, die männlichen Androgene (z. B. Testosteron und Androsteron).
Weitere Beispiele sind andere Zoo-, Myco- und Phytosterine und deren Ester wie z. B. Ergosterin, Vitamin D und Herzglycoside (z. B. Digitalis und Strophanthin). Phytosterine wie z. B. β-Sitosterin, Stigmasterin und Campesterin und deren Ester treten vermehrt bei vegetarischer Ernährung im Humanserum auf.
Carotinoide
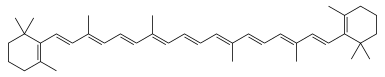
Carotinoide sind Polymerisationsprodukte von Isopren, die ausschließlich in Pflanzen, Bakterien und Pilzen hergestellt werden und für die gelb bis rötliche Färbung von Pflanzen verantwortlich sind (z. B. bei Karotten und Tomaten). Ihre physiologischen Aufgaben sind die Lichtabsorption und der Schutz vor oxidativen Stress, da sie als Radikalfänger fungieren können.[3] Über die Nahrung können Carotinoide auch von Tieren aufgenommen werden und sind so unter anderem für die Färbung von Eigelb und Butter verantwortlich.[4] Sie bestehen meist aus ungesättigten Kohlenwasserstoffketten und deren Oxidationsprodukten, und sind aus acht Isopren-Einheiten aufgebaut. Somit handelt es sich um Tetraterpene mit einer Skelettgröße von 40 Kohlenstoffatomen.[5] Sie werden in Carotine und Xanthophylle unterschieden, wobei Xantophylle, im Gegensatz zu Carotinen, Sauerstoffhaltige-Gruppen enthalten.[6] Das bekannteste und am häufigsten vorkommende Carotinoid ist das β-Carotin, auch bekannt als Provitamin A. Es wird im Organismus von Menschen und einigen Tieren in Retinal (ein Vitamin A) umgewandelt, welches eine wichtige Ausgangsverbindung für Rhodopsin (ein Sehpigment) darstellt, dieses ist notwendig für den Sehvorgang.
Analytik
Zur qualitativen und quantitativen Analytik der physiko-chemisch sehr unterschiedlichen Stoffklassen der Lipide kommen bevorzugt chromatographische Verfahren zum Einsatz.[7] Mit Hilfe der Dünnschichtchromatographie und der HPLC lassen sich alle Lipidklassen voneinander trennen.[8] Der Einsatz der Gaschromatographie erfordert jedoch die Abtrennung der Phospholipide, da diese nicht unzersetzt verdampft werden können. Durch Kopplung der chromatographischen Trennverfahren mit der Massenspektrometrie[9] sind hochspezifische und hochsensitive qualitative und quantitative Bestimmungen einzelner Substanzen der verschiedenen Lipidklassen möglich.
Auch die Festphasenextraktion wird zur Trennung der Lipidklassen eingesetzt.[10]
Biologische Funktionen
Die biologischen Funktionen der Lipide sind ebenso vielfältig wie ihre chemische Struktur. Sie dienen als
- Brennstoff (β-Oxidation der Fettsäuren)
- Energiespeicher (Triacylglycerole)
- Membranbausteine (Phospholipide)
- Signalmoleküle (Diacylglycerol; IP3-Kaskade)
- Hormone (Eicosanoide; Prostaglandine etc.)
- Fettlösliche Vitamine (Vitamine A, D, E, K)
- Cofaktoren (Dolichol)
- Pigmente (Carotinoide)
Während manche Lipide vom menschlichen Körper im Fettstoffwechsel selbst gebildet werden können, müssen andere mit der Nahrung aufgenommen werden. Daher werden diese als essentielle Lipide bezeichnet.
Essentielle Fettsäuren
Sogenannte essentielle Fettsäuren sind mehrfach ungesättigt und müssen mit der Nahrung aufgenommen werden, da bei Säugetieren und beim Menschen bei der Fettsäure-Synthese keine Doppelbindungen zwischen ihrem Ende und dem neunten Kohlenstoff-Atom eingeführt werden können. Zu ihnen gehören die Omega-6-Fettsäuren und die Omega-3-Fettsäuren. Zu den Vertretern der essentiellen Omega-3-Fettsäuren zählen die Linolensäure, Eicosapentaensäure und Docosahexaensäure; zu entsprechenden Omega-6-Fettsäuren zählen die Linolsäure und die Arachidonsäure. Aus der Arachidonsäure werden Eikosanoide synthetisiert, diese sind wichtige Gewebshormone und Mediatoren im Körper. Omega-9-Fettsäuren sind nicht essentiell, da sie aus Omega-3- und Omega-6-Fettsäuren synthetisiert werden können. Mögliche Quellen für Omega-3- und Omega-6-Fettsäuren in Nahrungsmitteln sind Fische, Leinsamen, Sojaöl, Hanföl, Kürbiskerne oder Walnüsse.
Essentielle Fettsäuren spielen eine wichtige Rolle in vielen Stoffwechselprozessen. Es gibt Hinweise, dass Mängel oder Ungleichgewichte in der Aufnahme der essentiellen Fettsäuren Ursache zahlreicher Krankheiten sind.
Fettlösliche Vitamine
Die fettlöslichen Vitamine sind:
- Vitamin A, ein Terpen, das eine wichtige Rolle zum einen beim Sehvorgang, zum anderen für Wachstum, Funktion und Aufbau von Haut und Schleimhäuten spielt,
- Vitamin D, ein Prohormon (Steroid), zuständig für die Regelung der Calcium- und Phosphor-Konzentrationen im Blut und somit von entscheidender Bedeutung für die Knochenstabilität,
- Vitamin E, ein Terpenoid mit antioxidativer Wirkung und
- Vitamin K, ein Terpenoid, das bei der Blutgerinnung mitwirkt.
Lipidomik
Die Erforschung aller Lipide, die in einer Zelle oder einem Organismus vorkommen, heißt Lipidomik (englisch Lipidomics).[11] Sie ist vergleichbar der Proteomik, die sich mit der Erforschung aller vorkommenden Proteine im Organismus und der Zelle beschäftigt. Ziel dieser subdisziplinären Wissenschaft ist sowohl die Erfassung aller Lipide als auch die Bestimmung ihrer Funktionen und Protein-Lipid-Interaktionen im biologischen, physiologischen oder physikalischen Kontext. In der Lipidomik werden zur Charakterisierung der Lipide Techniken eingesetzt wie die Massenspektroskopie (MS), Kernspinresonanzspektroskopie (NMR) oder Fluoreszenzspektroskopie. Besonders geeignet erscheinen massenspektroskopische Methoden, die eine hohe Sensitivität aufweisen und bei denen durch die Ionisation der Moleküle diese nicht zum Großteil zerfallen. Eine geeignete und sanfte Ionisationsmethode ist hierfür die Nano-Elektrospray-Ionisations-Massenspektrometrie.[12] Ziel der Forschung auf dem Gebiet der Lipidomik ist die Rolle der Lipide in vielen Stoffwechselerkrankungen wie Fettleibigkeit, Atherosklerose, Schlaganfall, Bluthochdruck und Diabetes festzustellen. Das schnell wachsende Gebiet der Lipidomik ergänzt die Gebiete der Genomik und Proteomik und macht mit ihnen die Systembiologie aus.[13][14]
Packungsparameter
Lipide lassen sich über den Packungsparameter charakterisieren:
| Volumen des Zylinders, der von den Fettsäureketten des Lipidschwanzes eingenommen wird | |
| größte Querschnittsfläche der hydrophilen Lipidkopfgruppe | |
| Lange des hydrophoben Lipidschwanzes |
Lipide mit nur einer Fettsäurekette und großem Kopf (Detergentien) besitzen einen Packungsparameter Pl < ⅓. Bei doppelkettigen Lipiden wie Phosphatidylethanolaminen nehmen die Fettsäureketten ein kegelförmiges Volumen ein und es gilt Pl = 1. Cardiolipine und Cholesterin besitzen einen Packungsparameter > 1.[15]
Literatur
- Georg Löffler, Petro E. Petrides: Biochemie und Pathobiochemie. Springer, Berlin 2003, ISBN 3-540-42295-1.
- Florian Horn, Isabelle Moc, Nadine Schneider: Biochemie des Menschen. Thieme, Stuttgart 2005, ISBN 3-13-130883-4.
- Charles E. Mortimer, Ulrich Müller: Chemie. Thieme, Stuttgart 2003, ISBN 3-13-484308-0.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemistry. 5. Auflage. Freeman, New York 2002, ISBN 0-7167-4684-0. (teils online verfügbar bei NCBI Bookshelf)
- Frank D. Gunstone, Bengt G Herslöf: A Lipid Glossary, The Oily Press Ltd., Ayr Scotland 1992, ISBN 0-9514171-2-6
- F. D. Gunstone, J.L. Harwood, F. B. Padley: The Lipid Handbook. Chapman and Hall, London New/ York 1986, ISBN 0-412-24480-2.
- O. W. Thiele: Lipide, Isoprenoide mit Steroiden. G. Thieme Verlag, Stuttgart 1979, ISBN 3-13-576301-3.
- Robert C. Murphy: Mass Spectrometry of Lipids. Handbook of Lipid Research, Vol. 7, Plenum Press, New York/ London 1993, ISBN 0-306-44361-9.
- Nepomuk Zöllner, Dietrich Eberhagen: Untersuchung und Bestimmung der Lipoide im Blut. Springer-Verlag, Berlin/Heidelberg / New Yorj 1965.
Weblinks
- Genomics of Lipid-Associated Disorders (Seite der Technischen Universität Graz u. a. mit einer Fülle von Lipid-Stoffwechselwegen)
- Biorama: Die Lipide (Memento vom 18. September 2007 im Internet Archive)
Einzelnachweise
- Eintrag zu lipids. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.L03571 – Version: 2.1.5.
- S. Jain, A. Caforio, A. J. Driessen: Biosynthesis of archaeal membrane ether lipids. In: Frontiers in microbiology. Band 5, 2014, S. 641, doi:10.3389/fmicb.2014.00641. PMID 25505460, PMC 4244643 (freier Volltext).
- J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemistry. 5. Auflage. W H Freeman, 2002, ISBN 0-7167-3051-0, Kap.: 19.5.2.
- W. K. Purves, D. Sadava, G. H. Orians, H. C. Heller: Biologie. 7. Auflage. Spektrum Akademischer Verlag, 2006, ISBN 3-8274-1630-2, S. 64.
- Paula Yurkanis Bruice: Organic Chemistry. 4. Auflage. Prentice-Hall, 2003, ISBN 0-13-141010-5, S. 1089.
- H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie. 6. Auflage. Springer, 2007, ISBN 978-3-540-73201-3, S. 239.
- Birgit Rehlender: Qualitative und quantitative Bestimmung von Lipidfraktionen verschiedener ernährungsphysiologisch relevanter Lipoproteine aus Humanseren, Analysen von Extrelut-Lipid-Extrakten durch kombinierten Einsatz von Dünnschichtchromatographie, Gaschromatographie und Massenspektrometrie. Dissertation. TU Berlin, 1983, DNB 840626266
- M. Gołębiowski, M. I. Boguś, M. Paszkiewicz, P. Stepnowski: Cuticular lipids of insects as potential biofungicides: methods of lipid composition analysis. In: Anal Bioanal Chem. 399(9), Mar 2011, S. 3177–3191. PMID 21153591.
- R. C. Murphy, T. J. Leiker, R. M. Barkley: Glycerolipid and cholesterol ester analyses in biological samples by mass spectrometry. In: Biochim Biophys Acta. 1811(11), Nov 2011, S. 776–783. PMID 21757029.
- Ruiz-Gutiérrez V1, Pérez-Camino MC: Update on solid-phase extraction for the analysis of lipid classes and related compounds., J Chromatogr A. 2000 Jul 14;885(1-2):321-41, Review, PMID 10941680, doi:10.1016/S0021-9673(00)00181-3.
- Kim Ekroos (Hrsg.): Lipidomics: technologies and applications. Wiley-VCH-Verlag, Weinheim 2012, ISBN 978-3-527-33098-0.
- Britta Brügger, Mathias Haag, Felix Wieland: Lipidomics von Zellen, Organellen und Viren. In: Biospektrum. Juli 2008.
- X. Han: Neurolipidomics: challenges and developments. In: Front. Biosci. 12, 2007, S. 2601–2615. doi:10.2741/2258. PMC 2141543 (freier Volltext). PMID 17127266.
- A. E. Rolim, R. Henrique-Araújo, E. G. Ferraz, F. K. de Araújo Alves Dultra, L. G. Fernandez: Lipidomics in the study of lipid metabolism: Current perspectives in the omic sciences. In: Gene. 554(2), 24. Okt 2014, S. 131–139. PMID 25445283.
- Volker Schünemann: Biophysik. Springer, Berlin 2004, ISBN 3-540-21163-2, S. 5.