Adamantan
Adamantan ist ein verbrückter Kohlenwasserstoff und der einfachste Diamantoid. Es bildet farblose, campherartig riechende Kristalle. Die Struktur des Adamantans besteht formal aus vier Cyclohexanmolekülen in Sesselkonformation. Diese hochsymmetrische Struktur (Punktgruppe Td) findet sich auch in anderen chemischen Stoffen wie Methenamin und Phosphortrioxid, sie wird gelegentlich als Adamantan-artig bezeichnet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
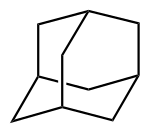 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Adamantan | |||||||||||||||||||||
| Andere Namen |
Tricyclo[3.3.1.13,7]decan | |||||||||||||||||||||
| Summenformel | C10H16 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser, campherartig riechender Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 136,23 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,07 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
unlöslich in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen
Adamantan kommt in der Natur nur in Spuren in einigen Bergkristallen vor. Es findet sich außerdem in kleinen Mengen im Erdöl, aus dem es zuerst isoliert wurde (Stanislav Landa, 1933).[3][4]
Synthese
Der tricyclische Kohlenwasserstoff ist durch Umlagerung von Tetrahydrodicyclopentadien, das durch Hydrierung des Diels-Alder-Dimers von Cyclopentadien hergestellt wird, mittels Aluminiumchlorid leicht zugänglich.[5] Die Herstellung läuft bei 160 °C und ca. 3 MPa ab.
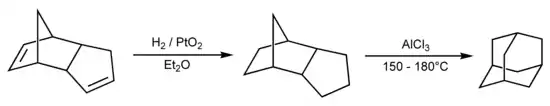
Mit einer verbesserten Synthese mit Supersäure als Katalysator über den Umweg einer Synthese von 1,3-Dialkyl-Adamantan lässt sich nach einem Verfahren der Sun Oil das Adamantan in Polymere einbauen.
Jährlich werden über 10.000 Tonnen Adamantan hergestellt.
Eigenschaften
Physikalische Eigenschaften
Adamantan ist bei Raumtemperatur eine feste Substanz, die in zwei polymorphen Kristallformen auftritt.[6] Bei Raumtemperatur liegt die Kristallform I vor, die bei 270 °C in die flüssige Phase übergeht.[7] Bei −64,5 °C wird ein Phasenübergang von der Kristallform II zur Form I beobachtet. Hier erfolgt der Übergang von der kristallinen zu einer plastisch kristallinen Form.[8][9] Das bedeutet, die Verbindung liegt oberhalb dieser Temperatur bis zum Schmelzpunkt und somit auch bei Raumtemperatur in einem mesomorphen Zustand vor. Das Verhalten ist analog zu ähnlichen "kugelförmigen" Molekülen wie Cuban oder Tetramethylbutan, die ähnliche Mesophasen bilden.
Chemische Eigenschaften
Adamantan ist sehr stabil und allgemein wenig reaktionsfreudig. Eliminierungen sind unmöglich, die Bredtsche Regel gilt für alle Kohlenstoff-Atome. Substitutionsreaktionen finden vorwiegend am Brückenkopf-C1 statt. In Wasser ist Adamantan nahezu unlöslich.
Verwendung
Adamantan wird in Polymerverbindungen genutzt, um die Beständigkeit gegen Lösungsmittel, Chemikalien und Hitze zu verbessern. Es findet Verwendung als Matrix für Radikale und als Referenzsubstanz in der Festkörper-NMR-Spektroskopie. Durch die hohe Symmetrie der Moleküle ist eine molekulare Rotation im Festkörper vorhanden, die besonders einfach messbar ist.
Es findet auch zur Herstellung weiterer Adamantanderivate Verwendung:
- Adamantan-1-ylamin (Amantadin) findet Verwendung gegen Morbus Parkinson und gegen die vom Influenza-A-Virus ausgelöste Virusgrippe. Es wirkt vorbeugend gegen das Influenza-A-Virus H5N1 der Vogelgrippe H5N1 48 Stunden nach Infektion.[10]
- 3,5-Dimethyl-adamantan-1-ylamin (Memantin) findet Verwendung als Antidementivum in der Behandlung von moderater bis schwerer Demenz vom Alzheimer-Typ.[11]
Einzelnachweise
- Eintrag zu Adamantan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. April 2014.
- Datenblatt Adamantan bei AlfaAesar, abgerufen am 12. Dezember 2020 (PDF) (JavaScript erforderlich).
- S. Landa, V. Macháček: Sur l’adamantane, nouvel hydrocarbure extrait du naphte. In: Coll. Czech. Chem. Comm. Band 5, 1933, S. 1–5, doi:10.1135/cccc19330001.
- H. Stetter: Die Chemie der organischen Ringsysteme mit Urotropin-Struktur. In: Angewandte Chemie. Band 66, Nr. 8, 1954, S. 217–229, doi:10.1002/ange.19540660802.
- Paul von R. Schleyer, M. M. Donaldson, R. D. Nicholas, C. Cupas: Adamantane In: Organic Syntheses. 42, 1962, S. 8, doi:10.15227/orgsyn.042.0008; Coll. Vol. 5, 1973, S. 16–19 (PDF).
- J.T.S. Andrews, R.E. Carpenter, T.M. Martinko, R.C. Fort, T.A. Flood, M.G. Adlington: Transition and Fusion Thermodynamics of Heteroadamantanes. In: Mol. Cryst. Liq. Cryst. 41, 1978, S. 257–261, doi:10.1080/00268947808070312.
- P. Espeau, R. Ceolin: Thermodynamic studies of solids with non-negligible vapour pressure: T–v and p–T diagrams of the dimorphism of adamantane. In: Thermochimica Acta. 73, 2001, S. 147–154, doi:10.1016/S0040-6031(01)00561-5.
- G.J. Kabo, A.V. Blokhin, M.B. Charapennikau, A.G. Kabo, V.M. Sevruk: Thermodynamic properties of adamantan and the energy states of molecules in plastic crystals for some cage hydrocarbons. In: Thermochimica Acta. 345, 2000, S. 125–133, doi:10.1016/S0040-6031(99)00393-7.
- F. H. Herbstein: Some applications of thermodynamics in crystal chemistry. In: J. Mol. Structure. 374, 1996, S. 111–128, doi:10.1016/0022-2860(95)08996-9.
- T. H. Maugh: Panel urges wide use of antiviral drug. In: Science. Band 206, Nr. 4422, 30. November 1979, ISSN 0036-8075, S. 1058–1060, doi:10.1126/science.386515, PMID 386515.
- Claire Mount, Christian Downton: Alzheimer disease: progress or profit? In: Nature Medicine. Band 12, Nr. 7, 1. Juli 2006, S. 780–784, doi:10.1038/nm0706-780.
