Phosphorpentoxid
Phosphorpentoxid, genauer Diphosphorpentoxid, ist ein Oxid des Elementes Phosphor und gehört zur Stoffgruppe der Phosphoroxide. Es ist ein farb- und geruchloses, äußerst hygroskopisches Pulver, das mit Wasser in stark exothermer Reaktion zu Phosphorsäure umgesetzt wird.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
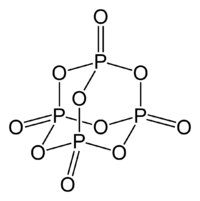 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Phosphorpentoxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | P4O10 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser, hygroskopischer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 283,92 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sublimationspunkt |
362 °C (Unter Normaldruck)[1] | |||||||||||||||
| Löslichkeit |
mit Wasser Zersetzung zu Phosphorsäure[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
| |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Obwohl lange bekannt ist, dass das Molekül durch die Summenformel P4O10 beschrieben werden kann, ist die historische Bezeichnung (Di)phosphorpentoxid, also P2O5 (CAS-Nummer 1314-56-3), erhalten geblieben.
Herstellung
Phosphorpentoxid entsteht bei der Verbrennung von weißem Phosphor in einem trockenen Luftstrom unter starker Wärmeentwicklung:
Bei Sauerstoffmangel entsteht auch Phosphortrioxid P4O6, bei dem die vier „äußeren“ (in der obigen Formel doppelt an ein Phosphoratom gebundenen) Sauerstoffatome fehlen.[6]
Eigenschaften
Physikalische Eigenschaften
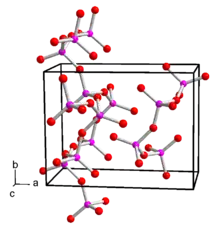
_ Phosphor, _ Sauerstoff.
Phosphorpentoxid sublimiert bei 362 °C, der Schmelzpunkt lässt sich nur unter Druck in einer geschlossenen Ampulle zu 562 °C bestimmen.[1]
Phosphorpentoxid ist polymorph. Die Umwandlung einer hexagonalen H-Form erfolgt bei 450 °C unter Druck über 24 Stunden über die flüssige und Glasphase zur orthorhombischen O-Form und weiter zur stabilen ebenfalls orthorhombischen O'-Form.[2] Die bei Zimmertemperatur stabile orthorhombische Form kristallisiert mit der Raumgruppe Pnma (Raumgruppen-Nr. 62) und den Gitterparametern a = 9,193 Å, b = 4,89 Å und c = 7,162 Å.[7] Diese besteht aus unendlichen Schichten, die aus Sechsringen von PO4-Tetraedern aufgebaut sind. Daneben existiert eine metastabile trigonale Struktur mit der Raumgruppe R3c (Nr. 161) und den Gitterparametern a = 10,2 Å und c = 13,5 Å.[8] Diese besteht aus isolierten P4O10-Molekülen. Des Weiteren gibt es die o-Form, die nicht aus isolierten Molekülen, sondern aus Ketten von über drei Sauerstoffatomen verknüpften PO4-Tetraedern besteht. Diese Form ist ebenfalls orthorhombisch, Raumgruppe Fdd2 (Nr. 43), mit den Gitterparametern a = 16,31 Å, b = 8,115 Å und c = 5,265 Å.[9] In der Gasphase liegen P4O10-Moleküle vor. Mittels Elektronenbeugung konnten die Bindungslängen der P=O-Doppelbindung mit 143 pm und der P-O-Einfachbindung mit 160 pm bestimmt werden. Die Bindungswinkel betragen für P-O-P 123,5°, für O=P-O 116,5° und für O-P-O 101,6°.[10]
Chemische Eigenschaften
Phosphorpentoxid hat ein großes Bestreben, Wasser aufzunehmen und Tetrametaphosphorsäure zu bilden[2][10]:
Das Gleichgewicht liegt hier fast vollständig auf der rechten Seite, so dass sich in einem Phosphorpentoxid enthaltenden, abgeschlossenen Raum ein Wasserdampfdruck von unter 1,3·10−4 Pa einstellt.
Weitere Wasseraufnahme führt über die einfachste Polyphosphorsäure Diphosphorsäure[2][10]
Die Bruttoreaktion
verläuft stark exotherm. Hierbei wird eine molare Reaktionswärme von −377 kJ·mol−1 realisiert.[11] Phosphorpentoxid spaltet Wasser auch aus Verbindungen ab. So resultieren aus Salpetersäure das Anhydrid Distickstoffpentoxid, aus Perchlorsäure das Dichlorheptaoxid, aus Schwefelsäure das Schwefeltrioxid und aus Malonsäure das Kohlensuboxid.[10]
Verwendung
Phosphorpentoxid ist auf Grund des vorstehend dargestellten Gleichgewichts ein äußerst wirksames Trocknungsmittel (siehe Exsikkator): Wassermoleküle aus der umgebenden Luft, die auf Phosphorpentoxid treffen, werden sehr stark gebunden. Kommerzielle Trocknungsmittel enthalten 75 % Phosphorpentoxid und 25 % inertes anorganisches Trägermaterial, wodurch eine rieselfähige Struktur des Trocknungsmittels erhalten bleibt. Durch Zusatz von Wasser-Indikatoren wird der Erschöpfungsgrad des Mittels angezeigt. Bei Wasseraufnahme verfärbt sich der ursprünglich farblose Indikator über grün, blaugrün nach blau (Wassergehalt ca. 33 %).
In Gasen, Flüssigkeiten und Feststoffen enthaltenes Wasser hat einen höheren Wasserdampfdruck, wodurch die Wassermoleküle nach und nach fast vollständig zum Phosphorpentoxid wandern. Davon betroffen sind auch chemisch gebundenes Wasser (siehe Kristallwasser) und sogar getrennt gebundene Wasserstoff- und Hydroxygruppen in organischen Molekülen oder biologischem Material: Auch diese haben einen gewissen Wasserdampfdruck, d. h., eine OH-Gruppe bildet mit einem benachbart gebundenen H-Atom gelegentlich ein Wassermolekül, das bei extremer Lufttrockenheit verdunstet. In der uns umgebenden, Wasserdampf enthaltenden Luft spielt dieses Gleichgewicht keine Rolle, aber ein Stück Würfelzucker wird im Exsikkator schwarz wie der im Backofen vergessene Kuchen (dem das Wasser auf dem gleichen Wege durch die Hitze verloren ging).
Düngemittel enthalten Phosphate wie z. B. Kaliumdihydrogenphosphat KH2PO4 oder Diammoniumhydrogenphosphat (NH4)2HPO4, wobei der Gehalt an Phosphor oft auf Phosphorpentoxid (P2O5) umgerechnet angegeben wird.
Zwar wird Phosphorpentoxid in der organischen Chemie praktisch nur als Trocknungsmittel eingesetzt, experimentell konnte jedoch gezeigt werden, dass das Kation von Phosphorpentoxid in der Gasphase so reaktiv ist, dass es sogar die stabilste aller Kohlenstoff-Wasserstoff-Bindungen, und zwar die von Methan, effektiv bei Raumtemperatur aktivieren kann.[12]
Industrielle Verwendung findet die Verbindung zur Herstellung sehr reiner thermischer Phosphorsäure und zur Synthese von organischen Phosphorsäureestern.[10] Die Umsetzung mit Ethern führt zu den Triestern.[10]
Mit Alkoholen werden Mono- und Diester gebildet.[10]
Sicherheitshinweise
Phosphorpentoxid ruft schwere Verätzungen hervor. Deswegen sind bei der Handhabung Handschuhe, Atemschutz und entsprechende Laborkleidung zu tragen.
Einzelnachweise
- Eintrag zu Phosphorpentoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 898–899 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche).
- Eintrag zu Diphosphorus pentaoxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 1314-56-3 bzw. Phosphorpentoxid), abgerufen am 2. November 2015.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 644.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. vol. 1, Academic Press, 1963, S. 541–542.
- D. Stachel, I. Svoboda, H. Fuess: Phosphorus Pentoxide at 233 K. In: Acta Crystallographica, C51, 1995, S. 1049–1050, doi:10.1107/S0108270194012126.
- D.W.J. Cruickshank: Refinements of structures containing bonds between Si, P, S or Cl and O or N. V. P4O10. In: Acta Crystallographica, 17, 1964, S. 677–679, doi:10.1107/S0365110X64001670.
- E.H. Arbib, B. Elouadi, J.P. Chaminade, J. Darriet: New refinement of the crystal structure of o-P2O5. In: Journal of Solid State Chemistry, 127, 1996, S. 350–353, doi:10.1006/jssc.1996.0393.
- Ralf Steudel: Chemie der Nichtmetalle, Synthesen - Strukturen - Bindung - Verwendung, 4. Auflage, 2014 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-030439-8, S. 408–409, (abgerufen über De Gruyter Online).
- K. Schrödter, G. Bettermann, T. Staffel, F. Wahl, T. Klein, T. Hofmann: Phosphoric Acid and Phosphates. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2008. doi:10.1002/14356007.a19_465.pub3
- R. Crabtree: C–H bond activation: A radical non-metal solution. In: Nature Chemistry. 1, 2009, S. 348–349. (Originalarbeit: N. Dietl, M. Engeser. H. Schwarz: Aktivierung der C–H-Bindung von Methan bei Raumtemperatur durch nacktes [P4O10]+. In: Angewandte Chemie. 121, 2009, S. 4955–4957, doi:10.1002/ange.200901596).
