Phosphorpentachlorid
Phosphorpentachlorid ist eine farblose, hygroskopische kristalline Masse von ätzendem Geruch. Es ist durch teilweisen Zerfall in Phosphortrichlorid und Chlor meist gelblich oder grünlich gefärbt.[6]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
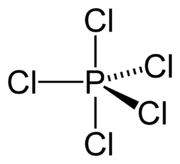 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Phosphorpentachlorid | |||||||||||||||
| Andere Namen |
Phosphor(V)-chlorid | |||||||||||||||
| Summenformel | PCl5 | |||||||||||||||
| Kurzbeschreibung |
farbloser bis gelblicher Feststoff mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 208,24 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,1 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sublimationspunkt |
162,2 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
heftige Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
DFG/Schweiz: 1 mg·m−3 (gemessen als einatembarer Staub)[1][4] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Die technische Darstellung von Phosphorpentachlorid erfolgt durch Chlorierung von Phosphortrichlorid in einer Gleichgewichtsreaktion:
Dabei werden die Edukte in mit Blei ausgekleideten Türmen im Gegenstromverfahren zur Reaktion gebracht.[6]
Eigenschaften und Verwendung
Mit Wasser zersetzt sich der Stoff zu Phosphorsäure und Chlorwasserstoff:
Schon bei Normaltemperatur dissoziiert das Pentachlorid zum Phosphortrichlorid unter Abgabe von Chlor. Bei Normaldruck schmilzt Phosphorpentachlorid nicht, sondern sublimiert ab etwa 100 °C. In einer geschlossenen Apparatur schmilzt es unter Überdruck bei 148–160,5 °C.[1][6] Kristallines festes Phosphorpentachlorid ist ionisch aufgebaut: [PCl4]+[PCl6]−.[7]
Generell dient Phosphorpentachlorid als Chlorierungsmittel, da es sehr leicht Chlor abgibt. Es werden z. B. Carbonsäuren zum entsprechenden Säurechlorid umgesetzt. Durch Reaktion mit Benzophenon kann Dichlordiphenylmethan dargestellt werden.[8]
Sicherheitshinweise
Phosphorpentachlorid ist sehr giftig und reagiert heftig mit Wasser, Metalloxiden, Metallpulvern und organischen Stoffen unter Hitzeentwicklung und Abspaltung giftiger Gase wie Phosphorylchlorid, Chlorwasserstoff und Chlorgas.[1] Des Weiteren reagiert Phosphorpentachlorid mit vielen Säuren und deren Salzen zu den entsprechenden Säurechloriden. So bildet sich aus Carbonaten und Phosphorpentachlorid das äußerst giftige Phosgen.
Einzelnachweise
- Eintrag zu Phosphorpentachlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- NIOSH. Phosphorus pentachloride. Abgerufen am 14. Juni 2018.
- Eintrag zu Phosphorus pentachloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 10026-13-8 bzw. Phosphorpentachlorid), abgerufen am 2. November 2015.
- Datenblatt Phosphorpentachlorid (PDF) bei Merck, abgerufen am 5. April 2007.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 757–758.
- Arnold F. Holleman, Nils Wiberg: Lehrbuch der Anorganischen Chemie. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 639.
- Alberto Spaggiari, Daniele Vaccari, Paolo Davoli, Giovanni Torre, Fabio Prati: A Mild Synthesis of Vinyl-Halides and -Dihalides Using Triphenyl Phosphite−Halogen-Based Reagents. In: The Journal of Organic Chemistry. 72, 2007, S. 2216, doi:10.1021/jo061346g.


