Puffer (Chemie)
Ein Puffer ist ein Stoffgemisch, dessen pH-Wert (Konzentration der Oxoniumionen) sich bei Zugabe einer Säure oder einer Base wesentlich weniger stark ändert, als dies in einem ungepufferten System der Fall wäre. Die Wirkung des Puffers beruht auf der Umsetzung der durch die Säure bzw. Base zugeführten Oxoniumionen (H3O+) bzw. der Hydroxidionen (OH−) zu schwachen Säuren bzw. Basen, die selbst nur wenig zur Bildung von H3O+ bzw. OH−-Ionen neigen.
Puffer sind die in der Chemie gezielt hergestellten, wässrigen Pufferlösungen. Komplexere Puffersysteme liegen in Körperflüssigkeiten wie dem Blut oder auch in Grundwässern, die beispielsweise mit Humus in Wechselwirkung stehen, vor.
Chemische Grundlagen
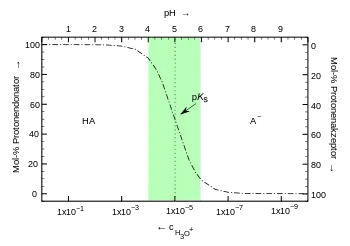
Pufferlösungen enthalten eine Mischung aus einer schwachen Säure und ihrer konjugierten bzw. korrespondierenden Base (bzw. des jeweiligen Salzes) oder einer schwachen Base und ihrer konjugierten bzw. korrespondierenden Säure. Auch Ampholyte (bifunktionale Moleküle) können als Puffer dienen. Der den pH-Wert bestimmende Faktor ist das Verhältnis bzw. das Protolyse-Gleichgewicht des Pufferpaares.
Für das Säure-Base-Gleichgewicht einer Säure HA gilt:
Nach dem Massenwirkungsgesetz stünde zu erwarten, dass in den Nenner zusätzlich noch die Konzentration des Wassers aufgenommen wird. Da aber Wasser hier nicht nur Reaktionspartner, sondern auch Lösemittel ist, gilt hier für die Aktivität des Wassers a(H2O) = 1, so dass sie sich rechnerisch nicht auf das Ergebnis auswirkt. Fälschlicherweise wird oft argumentiert, die Konzentration des Wassers im Reaktionsgemisch sei im Vergleich zu den Ionenkonzentrationen mit 55,6 mol/l sehr groß, dürfe daher als konstant angesehen werden und werde definitionsgemäß in die Dissoziationskonstante Ks (der Säurekonstante) hineingezogen, doch das führt zu falschen Werten, einschließlich der Fehlbehauptung, es gelte pKS (H3O+) = −1,32, womit das Oxonium-Ion stärker sauer wäre als etwa die Salpetersäure, definitionsgemäß eine starke Säure.
Durch Umformen erhält man:
Bildet man hieraus den negativen dekadischen Logarithmus, erhält man:
Dies entspricht:
beziehungsweise:
- Henderson-Hasselbalch-Gleichung (Puffergleichung)
Mit dieser Gleichung – sie gilt unter der Näherung, dass die Aktivitäten der Stoffe ihren Konzentrationen in Lösung entsprechen – lässt sich bei bekanntem pKs-Wert für einen bestimmten pH-Wert das Konzentrationsverhältnis an Säure und Base ermitteln. Je höher die Konzentrationen sind, desto geringer wirken sich Zugaben von Säuren oder Basen aus. Die Menge an starker Base (oder Säure), die durch eine Pufferlösung ohne wesentliche Änderung des pH-Wertes aufgenommen werden kann, wird durch die Pufferkapazität ausgedrückt.
Beispiele für Pufferlösungen sind der Essigsäure/Acetat-Puffer oder der Ammoniumpuffer aus Ammoniumionen und Ammoniak.
Arten von Puffersystemen
Der Carbonatpuffer (eine Mischung aus Kohlensäure und Hydrogencarbonaten) regelt die CO2-Konzentration zwischen Atmosphäre, Ozeanen und der Biosphäre. Er ist auch der Hauptteil des Blutpuffers. Dieser hält den pH-Wert des Blutes zwischen pH 7,35 und 7,45 und gleicht die durch den Stoffwechsel verursachten Schwankungen aus. Bei einem pH-Wert unterhalb von 7,35 spricht man von einer Azidose, über 7,45 von einer Alkalose. Der Tod tritt bei pH-Werten unter 6,8 bzw. über 8,0 ein.
Betrachtet man ein Puffersystem, so muss zwischen geschlossenen und offenen Puffersystemen unterschieden werden. Bei einem geschlossenen Puffersystem (z. B. Essigsäure/Acetat-Puffer) werden die bei einer chemischen Reaktion entstehenden Protonen (H+) oder Hydroxid-Ionen (OH−) von der Puffersubstanz abgefangen. Sie reagieren zu der entsprechenden korrespondierenden bzw. konjugierten Säure oder Base des Puffers und verbleiben demnach in der Lösung. Bei einem offenen Puffersystem (z. B. dem Hydrogencarbonat-/CO2-Puffersystem in der Lunge) steht das System im Austausch mit der Umgebung. Es ist in der Lage, durch Abgabe einer Komponente an die Umgebung den entsprechenden pH-Wert aufrechtzuerhalten, z. B. durch Abatmen von CO2.
Bedeutung
Puffer haben eine wichtige Bedeutung in der technischen Chemie wie beispielsweise bei der Galvanisierung oder in der Analogfotografie, genauso wie in der Analytik.
Auch spielen Puffersysteme in der Bodenkunde eine wichtige Rolle; siehe hierzu Pufferbereich (Bodenkunde).
Bedeutung in den Biowissenschaften: Für viele Tiere und nicht zuletzt auch für den menschlichen Organismus sind Puffer unerlässlich. So ist das menschliche Blutplasma und viele Enzyme auf einen konstanten pH-Wert angewiesen. Ohne Puffer würden bereits kleinste Mengen Säure – z. B. Milchsäure aus dem Energiestoffwechsel – genügen, um den Organismus lahmzulegen, weil diverse Proteine denaturieren und somit unbrauchbar werden würden.
Beispiele
- Barbital-Acetat-Puffer nach Michaelis (pH 2,6 bis 9,2)
- Essigsäure-Acetat-Puffer (pH 3,7 bis 5,7)
- Ringerlösung
- Good-Puffer, darunter z. B.
- HEPES: 4-(2-Hydroxyethyl)-1-piperazinethanesulfonsäure (pH 6,8 bis 8,2)
- HEPPS: 4-(2-Hydroxyethyl)-piperazin-1-propansulfonsäure (pH 7,3 bis 8,7)
- MES: 2-(N-Morpholino)ethansulfonsäure (pH 5,2 bis 6,7)
- Kohlensäure-Silicat-Puffer (pH 5,0 bis 6,2; schwach sauer)
- Phosphatpuffer nach Sørensen (pH 5,4 bis 8,0)
- Phosphat-Citrat-Puffer nach McIlvaine
- Kohlensäure-Bicarbonat-System (pH 6,2 bis 8,6; neutral)
- TRIS: Tris(hydroxymethyl)-aminomethan (pH 7,2 bis 9,0)
- Ammoniakpuffer: NH3 + H2O + NH4Cl (pH 8,2 bis 10,2)
- Citronensäure- oder Citratpuffer
- Bouin-Lösung
- Elektrophoresepuffer