Phosphortrichlorid
Phosphortrichlorid oder Phosphor(III)-chlorid ist eine farblose, giftige und stark ätzende Flüssigkeit von stechendem Geruch, die an feuchter Luft infolge von Hydrolyse raucht.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
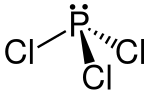 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phosphortrichlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | PCl3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, an feuchter Luft rauchende Flüssigkeit mit stechendem Geruch[1][2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 137,33 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,57 g·cm−3 (21 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
76 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,5122 (21 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
Es entsteht bei der direkten Umsetzung von Chlor mit weißem Phosphor, P4, neben geringen Mengen Phosphorpentachlorid, PCl5. Letzteres reagiert mit überschüssigem Phosphor ebenfalls zu Phosphortrichlorid.[1]
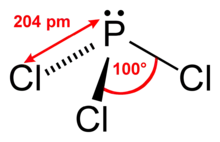
Eigenschaften
Phosphortrichlorid ist das Säurechlorid der phosphorigen Säure, einem dyadischem Tautomer der Phosphonsäure. Infolgedessen erfolgt mit Wasser die Hydrolyse zu dieser und Chlorwasserstoff:[7] Die Hydrolysereaktion verläuft mit einer Reaktionswärme von −286,9 kJ·mol−1 stark exotherm.[8]
Hydrolyse des Phosphor(III)-chlorids zu phosphoriger Säure / Phosphonsäure
Auf analoge Weise bilden sich mit Alkoholen Phosphorigsäureester. Dabei werden die Chlor-Atome schrittweise substituiert:
Umsetzung von Phosphortrichlorid mit Methanol – schrittweise Substitution
Analog erfolgen die Umsetzungen mit Aminen, Thiolen oder (Pseudo-)Halogeniden.
Phosphortrichlorid ist ein recht starkes Reduktionsmittel und wird als Sauerstoff-Akzeptor eingesetzt. Fungiert es als letzterer, so bildet sich als Oxidationsprodukt Phosphorylchlorid, welches als Verunreinigung Phosphorchlorid begleitet, wenn dieses mit Luft in Berührung kommt.
Phosphortrichlorid lässt sich weiter zum Phosphorpentachlorid chlorieren:[9]
Verwendung
Phosphortrichlorid ist ein Grundstoff der chemischen Industrie, der vielfältige Verwendung findet. Man benötigt es für die Herstellung anderer Phosphorderivate wie Insektizide, Pharmazeutika, Di- und Trialkylphosphite, Phosphorylchlorid, Thiophosphorylchlorid, Flammschutzmittel u. v. a. m.[1]
Im Labormaßstab kann man mit Hilfe von Phosphortrichlorid Carbonsäurechloride darstellen,[7] eine Methode, die gegenüber der Darstellung mittels Thionylchlorid oder Oxalylchlorid allerdings keine Vorteile birgt.
Einzelnachweise
- Eintrag zu Phosphorchloride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. März 2014.
- Eintrag zu Phosphortrichlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Liquids, S. 4-140.
- Eintrag zu Phosphorus trichloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7719-12-2 bzw. Phosphortrichlorid), abgerufen am 14. September 2019.
- Stoffliste (MAK-Werte und TRK-Werte), Verordnung des Bundesministers für Arbeit über Grenzwerte für Arbeitsstoffe sowie über krebserzeugende und fortpflanzungsgefährdende (reproduktionstoxische) Arbeitsstoffe (Grenzwerteverordnung 2021 – GKV), Österreich, abgerufen am 27. August 2021.
- Karl A. Hofmann: Anorganische Chemie. Springer-Verlag, 2013, ISBN 978-3-663-14240-9, S. 273 (eingeschränkte Vorschau in der Google-Buchsuche).
- Kapias, T.; Griffiths, R.F.: Spill behaviour using REACTPOOL Part III. Results for accidental releases of phosphorus trichloride (PCl3) and oxychloride (POCl3) and general discussion in J. Hazard. Mat. A81 (2001) 223–249, doi:10.1016/S0304-3894(00)00297-1.
- Egon Wiberg: Lehrbuch der Anorganischen Chemie - Mit einem Anhang: Chemiegeschichte. Walter de Gruyter, 2011, ISBN 978-3-11-023832-7, S. 260 (eingeschränkte Vorschau in der Google-Buchsuche).


