Ascorbinsäure
Ascorbinsäure ist ein farb- und geruchloser, kristalliner, gut wasserlöslicher Feststoff mit saurem Geschmack. Sie ist eine organische Säure, genauer eine vinyloge Carbonsäure; ihre Salze heißen Ascorbate. Ascorbinsäure gibt es in vier verschiedenen stereoisomeren Formen, biologische Aktivität weist jedoch nur die L-(+)-Ascorbinsäure auf. Eine wichtige Eigenschaft ist beim Menschen und einigen anderen Spezies die physiologische Wirkung als Vitamin. Ein Mangel kann sich bei Menschen als Skorbut manifestieren. Der Name ist daher abgeleitet von der lateinischen Bezeichnung der Krankheit, scorbutus, mit der verneinenden Vorsilbe a- (weg-, un-), also die ‚antiskorbutische‘ Säure. Da Ascorbinsäure leicht oxidierbar ist, wirkt sie als Redukton und wird als Antioxidans eingesetzt.
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
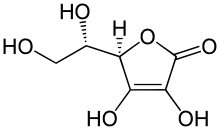 | |||||||||
| L-Ascorbinsäure | |||||||||
| Allgemeines | |||||||||
| Trivialname | Vitamin C | ||||||||
| Andere Namen | |||||||||
| Summenformel | C6H8O6 | ||||||||
| CAS-Nummer | 50-81-7 | ||||||||
| PubChem | 5785 | ||||||||
| ATC-Code | |||||||||
| DrugBank | DB00126 | ||||||||
| Kurzbeschreibung | weißes, geruchloses, kristallines Pulver[3] | ||||||||
| Vorkommen | Obst, Gemüse, Grüner Tee | ||||||||
| Physiologie | |||||||||
| Funktion | Radikalfänger, Cofaktor bei Mono- und Dioxidasereaktionen (insbes. Biosynthese von Collagen), Komplexierung von Metallkationen | ||||||||
| Täglicher Bedarf | 95 mg (Frauen) 110 mg (Männer)[4] | ||||||||
| Folgen bei Mangel | Skorbut (Morbus Möller-Barlow), Schwächung des Bindegewebes | ||||||||
| Überdosis |
| ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 176,13 g·mol−1 | ||||||||
| Aggregatzustand | fest | ||||||||
| Dichte | 1,65 g·cm−3 (20 °C)[3] | ||||||||
| Schmelzpunkt | |||||||||
| pKs-Wert |
4,25[7] | ||||||||
| Löslichkeit | gut wasserlöslich (333 g·l−1 bei 20 °C)[3] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Die L-(+)-Ascorbinsäure und ihre Ableitungen (Derivate) mit gleicher Wirkung werden unter der Bezeichnung Vitamin C zusammengefasst.[8] Der Sammelbegriff Vitamin C umfasst daher auch Stoffe, die im Körper zu L-(+)-Ascorbinsäure umgesetzt werden können, wie zum Beispiel die Dehydroascorbinsäure (DHA).
Geschichte

Erforschung des Skorbut
Skorbut war bereits im 2. Jahrtausend v. Chr. im Alten Ägypten als Krankheit bekannt. Auch der griechische Arzt Hippokrates und der römische Autor Plinius berichten darüber.
Bis ins 18. Jahrhundert war Skorbut die häufigste Todesursache auf Seereisen. Im Jahre 1747 untersuchte der britische Schiffsarzt James Lind diese Krankheit. Er nahm zwölf Seeleute, die unter Skorbut litten, und teilte sie in sechs Gruppen zu je zwei Personen. Jeder Gruppe gab er zusätzlich zu den üblichen Nahrungsrationen einen weiteren speziellen Nahrungsmittelzusatz, darunter Obstwein, Schwefelsäure, Essig, Gewürze und Kräuter, Seewasser, sowie Orangen und Zitronen. Er stellte fest, dass die Gruppe, welche die Zitrusfrüchte erhielt, eine rasche Besserung zeigte. Im Jahr 1757 veröffentlichte Lind dieses Resultat. Doch erst 1795 ließ die britische Marine die Nahrungsrationen auf See mit Zitronensaft ergänzen. Zusätzlich wurden Sauerkraut und Malz zur Skorbutprävention eingesetzt. Lange Zeit wurde behauptet, dass Skorbut die Folge einer speziellen bakteriellen Erkrankung, Vergiftung, mangelnder Hygiene oder Überarbeitung sei.
Der Engländer George Budd vermutete bereits 1842, dass in der Nahrung spezielle essentielle Faktoren enthalten sein müssen. Fehlen diese, würden erkennbare Mangelerscheinungen auftreten. Diese Entwicklungen gerieten wieder in Vergessenheit, als die Reisedauer durch das Aufkommen der Dampfschifffahrt stark verkürzt wurde und dadurch die Gefahr des Mangels sank. Außerdem führte die fehlende exakte Identifikation des Vitamins dazu, dass wirksamer frischer Orangensaft durch billigeren gekochten Limettensaft ersetzt wurde. Zuletzt machte Ende des 19. Jahrhunderts die sogenannte Ptomain-Theorie von sich reden, die eine Nahrungsmittelvergiftung für den Skorbut verantwortlich machte. So kam es, dass auf den großen Polarexpeditionen wieder der Skorbut Einzug hielt, der zwar mit frischen Lebensmitteln geheilt werden konnte, aber es hatte zunächst niemand ein korrektes Konzept für die Vorbeugung. Betroffen waren insbesondere die britische Arktisexpedition 1875–1876, die Jackson-Harmsworth-Expedition 1894–1897, Scotts Discovery-Expedition 1901–1904 und die Terra-Nova-Expedition 1910–1913.[9]
Im Jahr 1907 entdeckten zwei norwegische Ärzte zufällig ein Tiermodell zur Erforschung des Skorbuts: Axel Holst und Theodor Frølich studierten ursprünglich den „Schiffs-Beriberi“ der Schiffsbesatzungen der norwegischen Fischereiflotte, und zwar anhand von Tauben als Versuchstiere. Sie gaben später Meerschweinchen dasselbe Futter aus Getreide und Mehl, die jedoch unerwarteterweise mit Skorbutsymptomen reagierten. Somit beobachteten Holst und Frølich erstmals den Skorbut, der bis dahin nur bei Menschen beobachtet wurde, an Tieren. Sie zeigten ferner, dass durch bestimmte Futterzusätze die Krankheit bei den Meerschweinchen geheilt werden konnte. Damit leisteten sie einen wesentlichen Beitrag zur Entdeckung des Vitamins C ab dem Jahre 1928 durch den Ungarn Albert Szent-Györgyi und den Amerikaner Charles Glen King.[10]
Isolierung der Ascorbinsäure

Im Jahr 1912 entdeckte der Biochemiker Casimir Funk nach Studien zu der Mangelerkrankung Beriberi, dass diese durch das Fehlen der chemischen Substanz Thiamin (Vitamin B1) verursacht wurde. Er prägte dafür das Kunstwort „Vitamin“, eine Zusammensetzung aus vita (Leben) und Amin (Aminogruppe). In Bezug auf Skorbut vermutete er fälschlicherweise einen ähnlichen Amino-Faktor und bezeichnete diesen als „Antiskorbut-Vitamin“ (heute: Vitamin C). Tatsächlich enthält Vitamin C keine chemische Aminogruppe, dennoch ist die Bezeichnung bis heute geblieben.
Im Jahr 1921 gab der Biochemiker Sylvester Zilva einer Mischung von aus Zitronensaft isolierten Substanzen, die in der Lage war, Skorbut zu heilen, die Bezeichnung Vitamin C.[11] Bereits 1927 gelang es dem ungarischen Wissenschaftler Albert von Szent-Györgyi Nagyrápolt, Vitamin C aus der Nebenniere, Orangensaft beziehungsweise Weißkohl zu isolieren. Die so isolierte Ascorbinsäure sandte er Zilva zu, der diese aber nach Analyse fälschlicherweise nicht als Vitamin C erkannte. Durch diesen Fehler verzögerte sich die Identifikation von Ascorbinsäure als Vitamin C um mehrere Jahre. In den 1920er Jahren verfehlten auch andere, wie zum Beispiel der Wissenschaftler Karl Paul Link oder Oberst Edward B. Vedder, den Nachweis dafür, dass Ascorbinsäure Skorbut heilen kann und sie das postulierte Vitamin C ist.
Zwischen 1928 und 1934 gelang es Szent-Györgyi sowie Joseph L. Svirbely und unabhängig davon Charles Glen King mit seinen Mitarbeitern, durch Kristallisationsversuche die für die Heilung von Skorbut verantwortliche Substanz zu isolieren. Im Jahr 1931 isolierten King und Svirbely kristallines Vitamin C aus Zitronensaft und erkannten, dass diese Skorbut heilen kann und die physikalischen und chemischen Eigenschaften der damals noch kaum charakterisierten sogenannten Hexuronsäure,[12] der heutigen Ascorbinsäure, teilte. Szent-Györgyi wollte diese Säure zunächst „Ignose“ nennen (von ignosco), da sie trotz vieler Wissenslücken mit Hexosen verwandt war. Dieser Name wurde aber nicht akzeptiert. Da die Anzahl der Kohlenstoffatome (sechs C-Atome) bekannt war und die Substanz sich wie eine Säure verhält, wurde der Name Hexuronsäure von Szent-Györgyi eingeführt. Svirbely wechselte bald als Mitarbeiter zu Szent-Györgyi. Sie bewiesen, dass die bisher isolierten Substanzen mit Skorbut heilenden Eigenschaften (Vitamin C) mit der Hexuronsäure übereinstimmten. Damit stellte Szent-Györgyi fest, dass diese das lang gesuchte Vitamin C ist.
Die Struktur dieser damals noch Hexuronsäure genannten Verbindung wurde 1933 schließlich durch die Arbeiten von Walter Norman Haworth und dessen damaligen Assistenten Edmund Hirst aufgeklärt. Szent-Györgyi und Haworth änderten den Namen der Hexuronsäure schließlich in L-Ascorbinsäure, der bis heute akzeptiert wird. 1934 gelang Haworth und Tadeus Reichstein erstmals die Synthese künstlicher L-Ascorbinsäure aus Glucose.[13] Haworth erhielt 1937 für seine Forschungen am Vitamin C den Nobelpreis für Chemie, Szent-Györgyi den für Medizin. Seit 1967 propagierte Linus Pauling die Verwendung hoher Dosen von Ascorbinsäure als Vorbeugung gegen Erkältungen und Krebs, wofür jedoch Evidenzen fehlen. Pauling selbst nahm 18 g pro Tag ein und starb 1994 im Alter von 93 Jahren an Prostatakrebs.
Die industrielle Herstellung von Vitamin C begann 1934 durch Roche in der Schweiz (Redoxon), der damalige Forschungsleiter Markus Guggenheim war jedoch über den tatsächlichen Bedarf und den Nutzen skeptisch.[14] Die Nachfrage danach blieb anfangs gering.[15] Durch geschicktes Marketing und Ausnutzung von Ängsten (angebliche Unterversorgung) konnte die Vermarktung aber angekurbelt werden.[16]
Die Zeit des Nationalsozialismus
In der Zeit des Nationalsozialismus (1933–45) förderten die Machthaber in Deutschland die Versorgung der Bevölkerung mit den damals gerade erst entdeckten Vitaminen sehr aktiv. Sie wollten so den „Volkskörper von innen stärken“, weil sie davon überzeugt waren, dass Deutschland den Ersten Weltkrieg auch als Folge von Mangelernährung verloren hatte. In Vitamin-Aktionen wurden Kinder, Mütter, Schwerstarbeiter und Soldaten mit Vitaminen versorgt, insbesondere mit Vitamin C. Nationalsozialistische Massenorganisationen wie die Deutsche Arbeitsfront und die Reichsarbeitsgemeinschaft für Volksernährung organisierten die Produktion und Verteilung von Vitamin-C-Präparaten. Hausfrauen wurden dazu aufgerufen, Hagebutten und Sanddorn zu sammeln, aus denen Brotaufstriche und andere Vitaminpräparate für die Wehrmacht hergestellt wurden. Noch 1944 bestellte die Wehrmacht 200 Tonnen Vitamin C, unter anderem bei Roche.[15]
Vorkommen
In der Nahrung kommt Vitamin C vor allem in Obst und Gemüse vor. Zitrusfrüchte wie Orangen, Zitronen und Grapefruits enthalten – in reifem Zustand unmittelbar nach der Ernte – viel Vitamin C. Grünkohl hat den höchsten Vitamin-C-Gehalt aller Kohlarten (105–120 mg/100 g verzehrbare Substanz). Rotkraut, Weißkraut und Sauerkraut sind ebenfalls Vitamin-C-Lieferanten. Sauerkraut war lange Zeit in der Seefahrt von Bedeutung, wo ein haltbares Vitamin-C-reiches Nahrungsmittel benötigt wurde. Die höchsten natürlichen Vitamin-C-Konzentrationen wurden in der Buschpflaume und im Camu-Camu gefunden. In Sauerkraut und Kohlgemüse ist Ascorbinsäure in Form von Ascorbigen A und B (C-2-Scatyl-L-ascorbinsäure) gebunden.[17] Wird das Gemüse gekocht, zerfallen die Moleküle in L-Ascorbinsäure und 3-Hydroxyindol, sodass es in gekochtem Zustand mehr Vitamin C enthalten kann als im rohen Zustand. Durch zu langes Kochen gelangt das Vitamin verstärkt in das Kochwasser. Viele Gemüsearten enthalten Ascorbinsäure-Oxidase, die insbesondere durch Zerkleinern mit dem Vitamin in Berührung kommt und dieses oxidiert. Das führt zum Beispiel bei Rohkost, die nicht sofort verzehrt wird, zu erheblichen Vitamin-C-Verlusten.
Die folgenden Angaben dienen nur der Orientierung, die tatsächlichen Werte hängen stark von der Sorte der Pflanze, der Bodenbeschaffenheit, dem Klima während des Wachstums, der Lagerdauer nach der Ernte, den Lagerbedingungen und der Zubereitung ab. Das Weizenkorn enthält zum Beispiel kein Vitamin C, sondern dies entsteht erst bei der Keimung.[18]
Vitamin-C-Gehalt in Obst- und Gemüsesorten je 100 g (nach absteigendem Vitamin-C-Gehalt geordnet):
|
|
Vitamin-C-Gehalt in tierischen Produkten je 100 g (nach absteigendem Vitamin-C-Gehalt geordnet):
- Kalbsleber 40 mg[22]
- Rinderleber 33 mg[17]
- Milch 1 mg[17]
Herstellung

Die Jahresproduktion an Ascorbinsäure lag 2006 weltweit bei etwa 80.000 Tonnen[23] und hat sich damit seit 1999 mehr als verdoppelt.[24][25] Marktführer war lange Zeit die Schweizer Hoffmann-La Roche (30 % Weltumsatz), gefolgt vom BASF-NEPG-Kartell (auch etwa 30 %) und der Firma Merck. Im Jahr 2002 hat Hoffmann-La Roche seine Vitaminsparte für 3,4 Milliarden Schweizer Franken, etwa 2,1 Milliarden Euro, an die niederländische Koninklijke DSM verkauft.
Der größte Produzent von Ascorbinsäure ist heute die Volksrepublik China, wo sie ausschließlich biotechnologisch produziert wird.[26]
Synthese
Ascorbinsäure kann aus C5-Zuckern wie L-Xyloson, L-Lyxose, L-Xylose und L-Arabinose synthetisiert werden. Für die großtechnische Synthese dagegen wird in der chemischen Industrie aus der Ausgangssubstanz D-Glucose – einer Hexose – über die Stufe des Sorbitols kristalline Ascorbinsäure, Natriumascorbat (E 301), Calciumascorbat (E 302) und Ascorbylmonophosphat hergestellt. Die 1934 entdeckte Reichstein-Synthese bildet die Grundlage der industriellen, chemisch-mikrobiologischen Produktion.
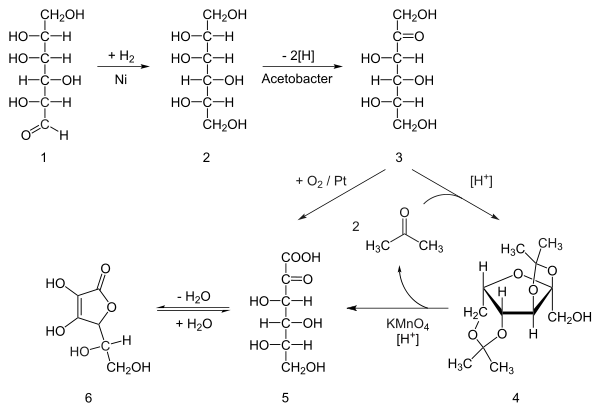
Biologisch-technisches Verfahren
Zur Unterscheidung von diesem synthetisch hergestellten Produkt wird ein mit Hilfe gentechnisch veränderter Mikroorganismen hergestelltes Vitamin C international mit GMO-Vitamin C (GMO, genetically modified organism: „gentechnisch veränderter Organismus“) bezeichnet. GMO-Ascorbinsäure ist preiswerter; nach diesem Verfahren wird weltweit der größere Teil hergestellt.
Im Sonoyama-Verfahren wird Ascorbinsäure aus D-Glucose hergestellt.[27] Dabei wird dieses zunächst durch Pantoea agglomerans zu 2,5-Dioxo-D-Gluconsäure oxidiert. Ein zweiter Stamm, Aureobacterium sp., reduziert das Produkt zu 2-Oxo-L-Gulonsäure, das dann wie bei der Reichstein-Synthese zu L-Ascorbinsäure umgesetzt wird. Es wird versucht, P. agglomerans-Stämme gentechnisch so zu verändern, dass diese aus Glucose in einem einstufigen mikrobiellen Verfahren 2-Oxo-L-Gulonsäure herstellen.[28]
Eigenschaften
Physikalische Eigenschaften
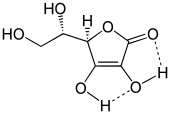
Ascorbinsäure bildet unter Normalbedingungen farblose Kristalle, die gegen Licht, Wärme und Luft beständig sind. Der Schmelzpunkt liegt bei 190–192 °C. Das Schmelzen erfolgt unter Zersetzung. In fester Phase bildet Ascorbinsäure zwei intramolekulare Wasserstoffbrückenbindungen, die maßgeblich zur Stabilität und damit zu den chemischen Eigenschaften der Endiol-Struktur beitragen.
Ascorbinsäure kristallisiert im monoklinen Kristallsystem mit den Gitterparametern a = 1730 pm, b = 635 pm, c = 641 pm, β = 102°11´. Die vier Moleküle der Einheitszelle sind paarweise durch Pseudoschraubenachsen verbunden. Die Moleküle bestehen aus einem Fünfring und der Seitenkette, wobei die Endiolgruppe planar ist.[29] Infolge der guten Wasserlöslichkeit des Vitamins können die Verluste je nach Art und Dauer der Zubereitung in Lebensmitteln bis zu 100 % betragen.[30]
Molekulare Eigenschaften
Ascorbinsäure enthält mehrere Strukturelemente, die zu ihrem chemischen Verhalten beitragen: eine Lactonstruktur, zwei enolische Hydroxygruppen sowie eine sekundäre und eine primäre Alkoholgruppe. Der Lactonring ist nahezu planar.[7]
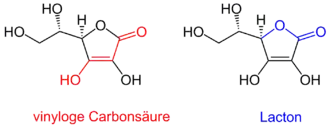
Ascorbinsäure hat zwei asymmetrische Kohlenstoffatome (C4 und C5) und existiert damit in vier verschiedenen stereoisomeren Formen, die optische Aktivität aufweisen. Die Moleküle L- und D-Ascorbinsäure verhalten sich wie Bild und Spiegelbild zueinander, sie sind Enantiomere, ebenso die L- und die D-Isoascorbinsäure. L-Ascorbinsäure und D-Isoascorbinsäure sowie D-Ascorbinsäure und L-Isoascorbinsäure sind Epimere, sie unterscheiden sich in der Konfiguration nur eines Kohlenstoffatoms. Trotz dieser geringen Unterschiede sind die Stereoisomere der L-Ascorbinsäure im Körper fast alle inaktiv, da die am Stoffwechsel beteiligten Enzyme spezifisch L-Ascorbinsäure erkennen. Lediglich die D-Isoascorbinsäure (E 315) weist eine geringe Wirkung auf.
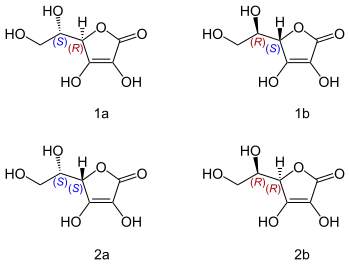
L-Ascorbinsäure (R, S) (1a), D-Ascorbinsäure (S, R) (1b)[31], L-Isoascorbinsäure (S, S) (2a), D-Isoascorbinsäure (R, R) (2b).
Chemische Eigenschaften
Obwohl Ascorbinsäure keine der „klassischen“ sauren funktionellen Carbonsäure-, Sulfonsäure- oder Phosphonsäuregruppen aufweist, ist sie beträchtlich sauer. Mit einem pKs-Wert von 4,25[7] ist sie saurer als Essigsäure mit pKs = 4,8. Sie liegt damit unter physiologischen Bedingungen als Ascorbat-Anion AscH− vor.
Dies ist zum einen auf die Endiol-Struktur zurückzuführen. Enole sind bereits deutlich saurer als Alkohole. Zusätzlich wird die Acidität bei Ascorbinsäure durch die zweite enolische Hydroxygruppe und durch die benachbarte Carbonylgruppe noch verstärkt. Zum anderen wird das nach Abspaltung des Protons entstehende Enolat-Anion mittels Keto-Enol-Tautomerie stabilisiert. Die dann am Sauerstoff bestehende negative Ladung wird dabei sowohl über die Doppelbindung zwischen den beiden Kohlenstoffatomen als auch über die Carbonylfunktion delokalisiert, also verteilt und somit stabilisiert. Strukturell könnte diese Gruppierung als vinyloge Carbonsäure aufgefasst werden, das heißt als eine Carbonsäure-Funktion mit „eingeschobener“ Kohlenstoff-Kohlenstoff-Doppelbindung zwischen Carbonylgruppe und Hydroxygruppe. Die Endiol-Struktur bedingt die reduzierenden (antioxidativen) Eigenschaften der Ascorbinsäure, da Endiole leicht zu Diketonen oxidiert werden können. Endiole mit benachbarter Carbonylgruppe heißen daher auch Reduktone.
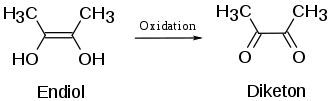

Die andere enolische Hydroxygruppe hat nur schwach saure Eigenschaften (pKs = 11,79[7]), da hier das Anion weniger mesomere Grenzstrukturen zur Stabilisierung ausbilden kann. Nach Abgabe beider Protonen entsteht aus Ascorbinsäure ein Dianion (Asc2−). Die intermediäre Form, die durch Abgabe eines Elektrons und eines Protons entsteht (AscH.), ist eine sehr starke Säure (pKs = −0,45).[7] Sie hat wegen ihrer Kurzlebigkeit im Metabolismus keine Bedeutung.
Das Säurerest-Ion der Ascorbinsäure nennt sich Ascorbat.[32] Es entsteht durch Übertragung eines Wasserstoffions (H+, Proton) auf ein protonierbares Lösungsmittel, etwa Wasser. Deswegen lautet seine Summenformel C6H7O6−. Die Reaktion ist eine Gleichgewichtsreaktion:
- Ascorbinsäure reagiert mit Wasser zu Ascorbat und einem Oxonium-Ion.
Ascorbinsäure ist in wässrigen Lösungen ein starkes Reduktionsmittel. Hierbei kann es über Zwischenstufen zu Dehydroascorbinsäure (DHA) oxidiert werden. Dieser Prozess ist reversibel, so können beispielsweise Cystein, Dithiothreitol oder andere Thiole DHA zurück zu Ascorbinsäure reduzieren. In der Reduktions- und Oxidationswirkung liegt eine wichtige Eigenschaft von Vitamin C in biologischen Systemen.
In kristalliner Form ist Ascorbinsäure relativ stabil gegenüber Oxidation durch Luftsauerstoff. In wässriger Lösung geschieht die Oxidation wesentlich rascher, wobei eine Temperaturerhöhung[33], eine Erhöhung des pH-Wertes sowie die Anwesenheit von Schwermetallionen diese beschleunigen. Säuren wie Citronensäure, Oxalsäure oder Metaphosphorsäure sowie Komplexbildner wie 8-Hydroxychinolin wirken stabilisierend.[34] Bei der Zubereitung von Nahrungsmitteln durch Kochen werden durchschnittlich 30 % der enthaltenen Ascorbinsäure oxidiert.[35]
Dehydroascorbinsäure
L-Dehydroascorbinsäure (englisch dehydro ascorbic acid, DHA) entsteht durch Oxidation von Ascorbinsäure. Im menschlichen Metabolismus kann sie zu L-Ascorbinsäure reduziert werden und damit Vitamin C regenerieren. Dehydroascorbinsäure liegt in wässrigen Lösungen nahezu vollständig als Monohydrat (mono-DHA·H2O) vor. Dabei bildet es einen Bizyklus, was durch Kernspinresonanzspektroskopie nachgewiesen wurde. Möglicherweise kann es noch ein zweites Molekül Wasser aufnehmen, um dann ein Dihydrat auszubilden.[36] Auch Semi-Dehydroascorbinsäure sowie oxidierte Formen veresterter Ascorbinsäuren werden zur Gruppe der Dehydroascorbinsäure gezählt.
Generell wird Vitamin C in Form von DHA durch Glucosetransporter, hauptsächlich GLUT-1, in die Mitochondrien der Zellen transportiert, da nur sehr wenige Zellen über spezifische Vitamin-C-Transporter verfügen.[37] Hierbei sind die meisten dieser Transporter Natriumionen-abhängig. Insbesondere das Gehirn ist auf eine Versorgung mit Ascorbinsäure angewiesen, das Vitamin kann jedoch nicht die Blut-Hirn-Schranke passieren.[38] Dieses Problem wird dadurch umgangen, dass Dehydroascorbinsäure durch Glucosetransporter, zum Beispiel GLUT1, durch die Schranke transportiert und in den Gehirnzellen zu Ascorbinsäure reduziert wird.
Es wird davon ausgegangen, dass Ascorbinsäure in Form von DHA intrazellulär transportiert wird. Hierbei soll extrazelluläre Ascorbinsäure zu DHA oxidiert, in die Zelle aufgenommen und dann wieder reduziert werden, da Ascorbinsäure selbst die Zelle nicht verlassen kann.[7] DHA ist instabiler als L-Ascorbinsäure. Je nach Reaktionsbedingungen (pH-Wert, An- beziehungsweise Abwesenheit von Reduktionsmitteln wie Glutathion) kann es entweder wieder zurück in Ascorbinsäure umgewandelt werden oder zu Diketogulonsäure (DKG) irreversibel hydrolysieren.[39][40]
Verwendung
Ascorbinsäure findet hauptsächlich als Antioxidans Verwendung. Sie wird vielen Lebensmittelprodukten als Konservierungsmittel oder Umrötungshilfsmittel, zum Beispiel bei der Herstellung von Brühwürsten zugesetzt, was in der Zutatenliste des Lebensmittels mit E 300 zu kennzeichnen ist. E-Nummern von Ascorbinsäurederivaten sind E 301 (Natriumascorbat), E 302 (Calciumascorbat), E 304a (Ascorbylpalmitat) und E 304b (Ascorbylstearat). Naturtrüber Apfelsaft kann bei der Herstellung mit Ascorbinsäure versetzt werden und wird dadurch deutlich heller, weil es im natürlichen Saft vorhandene Chinone reduziert, die bei der Pressung durch Oxidation von Phenolen mit Luftsauerstoff und dem Enzym Polyphenoloxidase entstehen und eine braune Farbe bewirken. Ascorbylpalmitat wird zur Verhinderung der Autooxidation von Fetten eingesetzt und verhindert so, dass diese ranzig werden. Der Ascorbinsäurezusatz zu Mehlen als Mehlbehandlungsmittel soll das Gashaltevermögen und das Volumen der Teige vergrößern. Dies lässt sich durch die Ausbildung zusätzlicher Disulfidbrücken zwischen den Kleber-Strängen des Teiges erklären.[41] Auch im Pharma-Bereich dient Ascorbinsäure als Antioxidans zur Stabilisierung von Pharmaprodukten.
In der Küche wird Ascorbinsäure (in Rezepten meist als „Vitamin-C-Pulver“ bezeichnet) eingesetzt, damit geschnittenes Obst (meist Äpfel und Bananen) länger frisch bleibt und nicht braun wird.
Wegen ihrer reduzierenden Eigenschaft wird Ascorbinsäure vereinzelt als Entwicklungssubstanz in photographischen Entwicklern eingesetzt.
Zum Auflösen von Heroinbase vor der Injektion wird oft Ascorbinsäure mit dem Heroin aufgekocht.
Physiologische Bedeutung
Vitamin C ist ein Radikalfänger und hat eine antioxidative Wirkung (es wirkt also als Reduktionsmittel).
Weiterhin stellt Vitamin C ein wichtiges Coenzym für die Prolyl-4-Hydroxylase dar. Dieses Enzym wird bei der Biosynthese des Proteins (Eiweißes) Kollagen benötigt. Es wandelt integrierte Prolinreste in 4-Hydroxyprolyl-Seitenketten unter Verbrauch von molekularem Sauerstoff um. Hydroxyprolin ist für den stabilen Kollagenaufbau unerlässlich.
Ebenfalls innerhalb der Biosynthese von Kollagen, aber auch weiterer Proteine, findet mithilfe von Ascorbinsäure und des Enzyms Lysylhydroxylase die Hydroxylierung von L-Lysin zum Hydroxylysin statt. Im Kollagen erfüllt dieses eine Funktion in der kovalenten Quervernetzung benachbarter Moleküle. Darüber hinaus kann Hydroxylysin im Kollagen und weiteren Proteinen glykosyliert werden, was zur Bildung von Glykoproteinen führt.
Mangel an Vitamin C führt zu einer verminderten Aktivität der Prolyl-Hydroxylierung und der Lysyl-Hydroxylierung und damit zur Instabilität von Kollagen. Da Kollagen in praktisch allen Organen und Geweben des menschlichen und tierischen Organismus vorkommt, vor allem im Bindegewebe, wird bei Mangel von Vitamin C Skorbut ausgelöst.
Bei der Hydroxylierung von Steroiden ist Vitamin C ein wichtiger Cofaktor. Darüber hinaus spielt es eine wichtige Rolle beim Aufbau von Aminosäuren wie beispielsweise dem L-Tyrosin. Auch bei der Umwandlung von Dopamin zu Noradrenalin, im Cholesterin-Stoffwechsel (Ascorbinsäure spielt eine Rolle bei der Umwandlung von Cholesterol zu Gallensäure und senkt dadurch den Blut-Cholesterol-Gehalt),[42] der Serotoninsynthese und bei der Carnitinbiosynthese wird Ascorbinsäure benötigt.
Mit Niacin und Vitamin B6 steuert Vitamin C die Produktion von L-Carnitin, das für die Fettverbrennung in der Muskulatur benötigt wird. Weiterhin begünstigt es die Eisenresorption im Dünndarm.
Aufgrund der hohen Konzentration von Vitamin C im männlichen Sperma wird der Einfluss auf die Zeugungsfähigkeit derzeit untersucht. Vitamin-C-Gaben bei manchen unfruchtbaren Männern konnten vereinzelt die Spermienqualität erhöhen.[42]
Die Stimulation der körpereigenen Abwehr, die dem Vitamin C oft zugeschrieben wird, wird unter anderem durch einen Schutz der Phagozytenmembran vor oxidativer Selbstzerstörung erklärt.[43][44][45] Diese oxidative Selbstzerstörung kann sonst durch das bei der Phagozytose ausgelöste Halogenid-Peroxidase-System ausgelöst werden. Zudem wurde in Tierversuchen eine erhöhte Interferonproduktion sowie eine Aktivierung des Komplementsystems nach Gabe von Vitamin C beobachtet werden.[43] Generell wurde bei Leukozyten im Blut, die einen wichtigen Stellenwert in der Immunabwehr einnehmen, ein hoher Ascorbinsäuregehalt festgestellt.[46] Weiterhin scheint Vitamin C Einfluss auf zahlreiche weitere neutrophile Funktionen zu haben, wie die Chemotaxis, Aufnahme von Partikeln durch Phagozyten, Lysozym-beeinflusste nicht-oxidative Immunreaktion und die Stimulation des Hexose-Monophosphat-Shunts.[47]
Der Stellenwert von Vitamin-C-Gaben zur Bekämpfung und Vorbeugung von Krankheiten wie der Erkältung ist wissenschaftlich allerdings umstritten,[48][42] wobei größere Reviews einen generellen Trend sehen, dass während Vitamin C zwar keinen messbaren prophylaktischen Effekt bei saisonaler Erkältung hat, allerdings ein moderater positiver Effekt auf den Krankheitsverlauf beobachtet wurde. Dieser konnte in therapeutischen Studien allerdings nicht reproduziert werden.[49][50] Rezente Meta-Analysen zeigen, dass Nahrungsergänzungsmittel mit Vitamin C bei Erkältungen weder prophylaktisch helfen noch die Genesung beschleunigen können.[51][52]
Bei Meta-Reviews vorhandener Studien wurden keine klinisch relevanten Effekte einer Vitamin-C-Supplementation bei Krebs beobachtet.[53][54] Auch bei schwer erkrankten Patienten auf der Intensivstation gibt es keine Evidenzen für einen Nutzen einer Vitamin-C-Gabe.[55]
L-Ascorbinsäure wirkt am Nicotinrezeptor des Typs α9α10 als positiver allosterischer Modulator. Hierdurch könnte es sich zur Akutbehandlung eines Schalltraumas empfehlen. Die wirksame Konzentration liegt bei 1–30 mM.[56]
Bedarf

Der Bedarf an Vitamin C wird zum Teil sehr kontrovers gesehen. Die Zufuhrempfehlung für einen gesunden Erwachsenen (ab 19 Jahren) beträgt laut Empfehlung der Deutschen Gesellschaft für Ernährung 95 mg/Tag für Frauen beziehungsweise 110 mg/Tag für Männer.[4] Die Meinungen hierüber gehen jedoch weit auseinander; die Empfehlungen anderer Gruppierungen liegen zwischen einem Bruchteil (zum Beispiel der Hälfte) und einem Vielfachen (zum Beispiel „so viel wie möglich“) dieses Wertes. Fest steht, dass Mengen bis zu 5000 mg kurzzeitig als unbedenklich gelten. Überschüssige Mengen werden vom Körper über den Urin ausgeschieden, da Vitamin C gut wasserlöslich ist (siehe auch Hypervitaminosen).
Bei einer ausgewogenen Mischkost kann in Deutschland davon ausgegangen werden, dass dem Körper alle lebensnotwendigen Vitamine, und daher auch Vitamin C, in ausreichendem Maße zugeführt werden. Die Versorgung mit Vitamin C ist in Deutschland knapp über der DGE-Empfehlung von 95 mg/Tag beziehungsweise 110 mg/Tag. Daher sind Vitaminpräparate für einen gesunden Menschen, der sich abwechslungsreich und vollwertig ernährt, überflüssig. Die Empfehlung für Schwangere und Stillende liegt bei 105 beziehungsweise 125 mg täglich. Für Raucher liegt die Empfehlung bei 135 mg/Tag für Frauen beziehungsweise 155 mg/Tag für Männer. Ursache für eine unzureichende Zufuhr ist meistens eine einseitige Ernährung. Dies betrifft vor allem Menschen, die nicht täglich frisches Obst und Gemüse verzehren.
Untersuchungen mit 14C-markiertem Vitamin C zeigen, dass der tägliche Ascorbatumsatz unabhängig von der Vitamin-C-Zufuhr nur etwa 20 mg beträgt. Somit genügen bereits knapp 20 mg täglich, um Skorbut zu vermeiden. Die Fachinformation des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) gibt für Vitamin C einen täglichen Gesamtumsatz von etwa 1 mg/kg Körpergewicht an.
Für Vergleichszwecke interessant ist, dass für Meerschweinchen eine Tagesdosis von 10 bis 30 mg empfohlen wird (bei einem Gewicht von etwa 0,8 bis 1,5 kg), wobei sie diese ebenso wie der Mensch nicht selbst produzieren können. Im Gegensatz dazu produzieren viele Tiere selbst Vitamin C. Große Hunde oder kleine Kälber, die etwa das Körpergewicht eines Menschen haben, stellen 1 bis 2 g täglich her, bei Krankheit bis zu 10 g.
Studien zur Pharmakokinetik von Vitamin C zeigen, dass eine volle Sättigung der Körperreserven mit Vitamin C (3000 mg) eine tägliche Zufuhr von 200 mg erfordert. Immunzellen wie Lymphozyten, Neutrophile und Monozyten werden bereits bei einer täglichen Aufnahme von 100 mg Vitamin C gesättigt. Die vollständige Plasmasättigung wird bei Zufuhr von 1000 mg Vitamin C pro Tag erreicht. Die Bioverfügbarkeit nimmt bei oraler Einnahme mit steigender Einzeldosis stark ab. 200 mg werden noch nahezu vollständig aufgenommen.[57] Aus diesem Grund ist es sinnvoller, mehrere Einzeldosen mit je 200 mg über den Tag verteilt zu sich zu nehmen, als einmalig 1000 mg.
Die Vitamin-C-Versorgung des Organismus spiegelt sich im Blutspiegel wider. Laut DGE sind geringere Konzentrationen als 20 µmol/l (0,35 mg/dl) mit vorklinischen Symptomen wie beispielsweise allgemeiner Müdigkeit, Leistungsschwäche, Infektanfälligkeit und schlechter Wundheilung verbunden. Offensichtliche klinische Mangelsymptome, die unter dem Begriff Skorbut zusammengefasst werden, treten erst bei Vitamin-C-Plasmaspiegeln unterhalb von 10 µmol/l (0,18 mg/dl) auf. Heute ist allgemein anerkannt, dass subklinische Vitamin-C-Defizite die Langzeitgesundheit negativ beeinflussen. Ein deutsches Konsensuspapier empfiehlt deshalb präventive Vitamin-C-Plasmaspiegel von mindestens 50 µmol/l (0,88 mg/dl) zur Verringerung des Arteriosklerose- und Krebsrisikos (DGE 2000). Die von der DGE empfohlene Vitamin-C-Tagesdosis von 95 mg beziehungsweise 110 mg bezieht sich ausschließlich auf Gesunde. Vitamin C ist eines der wichtigsten körpereigenen Antioxidantien. Ein Mehrbedarf bei Erkrankungen, die mit der Generierung von reaktiven Sauerstoffverbindungen (ROS) einhergehen, ist unbestritten. Er ist beim gegenwärtigen Stand der Erkenntnis nur noch nicht genau bezifferbar. Chronisch entzündliche Erkrankungen wie beispielsweise Arthritis, Allergien, Arteriosklerose, Krebs oder rezidivierende Infektionen sind nachweislich mit einem subklinischen bis klinischen Vitamin-C-Mangel (unter 30 µmol/l oder 0,53 mg/dl) und oxidativem Stress verbunden.[58][59][60][61] Eine ständig zunehmende Anzahl epidemiologischer Studien zeigt den prophylaktischen Wert einer adäquaten diätetischen Vitamin-C-Aufnahme. Hier sind vor allem die Ergebnisse der EPIC-Studie zu nennen, die 2001 in der Zeitschrift „The Lancet“ publiziert wurden. Die Daten von fast 20.000 Männern und Frauen zeigten, dass eine Steigerung der Blutascorbatwerte um 20 µmol/l (0,35 mg/dl) eine 20%ige Reduktion der Mortalität mit sich brachte.[62]
Mangelerscheinungen
Szent-Györgyi identifizierte 1933 das Vitamin C als wirksame Substanz gegen Skorbut.
Nur wenige Wirbeltiere, darunter Trockennasenprimaten (unter anderem der Mensch), Meerschweinchen und Echte Knochenfische sowie einige Familien in den Ordnungen der Fledertiere und Sperlingsvögel, sind nicht zur Biosynthese von Ascorbinsäure aus Glucuronsäure befähigt. Ihnen fehlt das Enzym L-Gulonolactonoxidase.[63] Für diese Lebewesen ist Ascorbinsäure ein Vitamin, also essenziell. Für alle anderen Wirbeltiere ist Ascorbinsäure nur ein Metabolit. Lebewesen, die nicht in der Lage sind, Ascorbinsäure selbst zu synthetisieren, müssen diese in ausreichender Menge über die Nahrung aufnehmen, um nicht an Skorbut zu erkranken. In frisch gelegten Hühnereiern fehlt zwar die Ascorbinsäure, sie wird jedoch ab Brutbeginn hauptsächlich von der Membran des Dottersacks synthetisiert.[64]
Das Umschalten des GLUT-1-Transporters auf Dehydroascorbat-Transport in Erythrozyten erfolgt mittels des Membranproteins Stomatin und dieser Prozess kommt nur in denjenigen Säugetieren vor, die nicht selbst Ascorbinsäure bilden können.[65][66]
Studien, die den tatsächlichen Vitamin-C-Gehalt im Blut des Menschen bestimmen, beobachten häufiger als bislang angenommen eine Unterversorgung: Die NHANES-III-Untersuchung von 1988 bis 1994 stellte fest, dass 10 bis 14 % der untersuchten Amerikaner an einer ernsten Unterversorgung (unter 11 µmol/l) und 17–20 % an einer subklinischen (11–28 µmol/l) Unterversorgung leiden – insgesamt also mehr als ein Viertel der Bevölkerung.[67] Die aktuelle NHANES-Erhebung für den Zeitraum 2003–2004 beobachtet eine erfreuliche Entwicklung: Eine ernste Unterversorgung betrifft nur noch 7,1 % der Bevölkerung. Einschneidend sind immer noch die Einkommensverhältnisse. Menschen mit niedrigem Einkommen leiden im Vergleich zu Gutverdienern doppelt so häufig an einer Unterversorgung (10–17 % versus 5–8 %). Zwei wesentliche Gründe für die insgesamt verbesserte Vitamin-C-Versorgung sind der Rückgang der Anzahl der Passivraucher, durch ein Rauchverbot in öffentlichen Einrichtungen und die zunehmende Einnahme von Vitaminpräparaten. Am subklinischen Mangel (unter 28 µmol/l) änderte sich kaum etwas – er trifft immer noch etwa 20 % der Amerikaner.[68] Der sozioökonomische Einfluss auf eine gesundheitsbewusste Ernährung wird in einer schottischen Untersuchung deutlich: 44 % der Menschen mit niedrigem sozioökonomischen Status wiesen Vitamin-C-Blutspiegel unter 23 µmol/l und 20 % unter 11 µmol/l auf.[61] Aber Nichtrauchen und gute Schulbildung schützen nicht automatisch vor einer Unterversorgung. Eine kanadische Studie bestimmte in der Zeit von 2004 bis 2008 die Vitamin-C-Blutspiegel von knapp 1000 Nichtrauchern im Alter von 20 bis 29 Jahren an einer Campus-Universität. Jeder Dritte zeigte einen subklinischen Vitamin-C-Mangel (unter 28 µmol/l) und jeder Siebte defizitäre Werte unterhalb der Skorbutgrenze (unter 11 µmol/l). Dabei korrelierte der Mangel mit Übergewicht, Bluthochdruck und Entzündungsparametern.[69]
Überdosierung
Für Vitamin C ist die Hypervitaminose, wie sie beispielsweise bei Vitamin A vorkommen kann, sehr selten, da der Körper einen Überschuss an Ascorbinsäure wieder über die Nieren ausscheidet. Wegen mangelnder Daten gibt das BfR keine UL aus, definiert aber einen „Orientierungswert“ von 1000 mg Vitamin C pro Tag.[70]
In einer vom National Institutes of Health (NIH) durchgeführten Studie wurden sieben Freiwillige zunächst mit einer ascorbinsäurearmen Diät ernährt und so ihre körpereigenen Vorräte an Vitamin C aufgebraucht. Als diese danach wieder mit Vitamin C versorgt wurden, begann die renale (über die Niere) Ausscheidung an unverändertem Vitamin C ab etwa 100 mg/d. Die Zufuhr über 400 mg/d wurde – soweit überhaupt im Darm aufgenommen (die Einnahme von Megadosen senkt die Resorptionsquote deutlich) – praktisch vollständig renal ausgeschieden. Ab etwa 1 g pro Tag steigen die Oxalat- und die Harnsäure-Konzentrationen im Urin.[71] Da ein Teil der Ascorbinsäure im Stoffwechsel zu Oxalsäure umgesetzt wird, besteht bei entsprechend disponierten Menschen prinzipiell ein erhöhtes Risiko für Calciumoxalat-Nierensteine (CaC2O4). Schon bei normaler Zufuhr stammen etwa 30 bis 50 % des Plasmaoxalats aus dem Vitamin-C-Abbau. Der Oxalatspiegel im Urin steigt selbst erst an, wenn eine Tagesdosis von etwa 6 g überschritten wird.[5]
Hohe orale Einzeldosen können einen vorwiegend osmotisch bedingten Durchfall auslösen. Die Dosis variiert von Person zu Person, wird mit etwa 5–15 g (1–3 gehäufte Teelöffel) für eine gesunde Person angegeben.[6] Diese Toleranzgrenze kann bei Individuen, die an schweren Erkrankungen leiden, bis auf über 200 g ansteigen.
Bei Menschen mit Glucose-6-Phosphatdehydrogenase-Mangel (G6PD-Mangel, Favismus), einer insbesondere in Afrika sehr weit verbreiteten, erblichen Krankheit, können intravenöse Vitamin-C-Dosen, etwa 30 bis 100 g pro Infusion, zur Hämolyse führen.[72]
Häufig wird Vitamin C, besonders wenn auf nüchternen Magen konsumiert, mit Verdauungsstörungen durch Übersäuerung des Magens in Verbindung gebracht. Dies kann unter anderem vermieden werden, indem Vitamin C nicht als Ascorbinsäure, sondern als Ascorbat (Salz der Ascorbinsäure, zum Beispiel Natriumascorbat) aufgenommen wird. Dies kann zum Beispiel durch die Zugabe von Backpulver (NaHCO3) erreicht werden. Studien haben gezeigt, dass die Resorption von Vitamin C erhöht wird, wenn es zu Fruchtsäften wie zum Beispiel Orangensaft gemischt wird.
Bei der Ratte liegt der LD50-Wert (die Dosis, bei der die Hälfte der Versuchstiere sterben) für Vitamin C bei 11,9 g pro Kilogramm Körpergewicht.[3] Das entspricht bei einem 70 kg schweren Menschen einer Dosis von 833 g.
Therapeutisch und prophylaktisch eingesetzt wird die Überdosierung von Vitamin C zum Beispiel bei Harnwegsinfektionen. Durch die renale Ausscheidung der Ascorbinsäure wird der Urin sauer. In diesem sauren Milieu können die Erreger deutlich schlechter gedeihen.[73] Eine regelmäßig hohe Einnahme von Ascorbinsäure kann jedoch die Bildung von Nierensteinen begünstigen, zumindest ist das Risiko bei den untersuchten Männern doppelt so hoch.[74]
Stoffwechsel im Detail
Ascorbinsäure kann von Menschen, Affen und einigen anderen Tierarten nur mit der Nahrung aufgenommen werden. Im Stoffwechsel der meisten anderen Lebewesen kann sie hingegen auch bedarfsabhängig synthetisiert werden.
Aufnahme mit der Nahrung
Der Transportweg von Vitamin C erfolgt über Enterozytzellen des Darmes. Wie es von dort in den Blutstrom gelangt, ist noch nicht vollständig geklärt.[75] Jedoch ist der Transport von Ascorbat beziehungsweise Dehydroascorbat (DHA) vom Blut in alle anderen Zellen genauer bekannt.
Die Aufnahme von Dehydroascorbat (DHA, vergleiche Abschnitt oben) in das Zellinnere (Zytosol) menschlicher Zellen findet mittels dreier Glucosetransporter statt, GLUT-1, GLUT-3 und GLUT-4. DHA konkurriert dabei mit Glucose, sodass ein Übermaß an Glucose effektiv die Aufnahme von DHA verhindern kann. Das Ascorbat wird zusammen mit je zwei Natriumionen mittels der Transportproteine SVCT1 und SVCT2 ins Zellinnere geschleust.[76][77][78]
Biosynthese
Ascorbinsäure wird von Bakterien, Pflanzen und Wirbeltieren mithilfe verschiedener Enzyme produziert. Ausgangssubstanzen sind hauptsächlich D-Glucose beziehungsweise D-Galactose.
Bei Pflanzen können neben D-Glucose und D-Galactose auch D-Glucuronlacton, D-Galacturonat beziehungsweise dessen Methylester die Biosynthese einleiten.
Biosynthese in Wirbeltieren
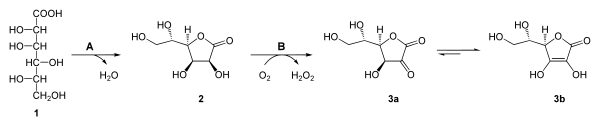
Nach hydrolytischer Abspaltung des UDP bildet sich die D-Glucuronsäure, die durch regioselektive Reduktion durch die Glucuronsäure-Reduktase und NADPH+H+ in L-Gulonsäure (1) (EC 1.1.1.19) überführt wird.
Die Lactonisierung (Ringbildung) zum L-Gulofuranolacton (L-Gulano-1,4-lacton) (2) katalysiert eine Glucono-Lactonase (A) (EC 3.1.1.17). Ihr folgt die selektive Oxidation mit Sauerstoff durch L-Gulono-γ-lacton-Oxidase (B) (EC 1.1.3.8) zu 2-Keto-L-Gulonlacton (3a.)[79] Diese tautomerisiert spontan zur Ascorbinsäure (3b.)
Bei Ratten wurde die Biosynthese am besten untersucht.[7] Die Bildung der Ascorbinsäure beginnt mit der Oxidation von UDP-D-Glucose zu UDP-D-Glucuronsäure durch das Enzym UDP-Glucose-Dehydrogenase (EC 1.1.1.22). Oxidationsmittel ist dabei das NAD+.
Ausnahmen
Trockennasenprimaten (unter anderem der Mensch), Meerschweinchen, Echten Knochenfischen sowie einigen Familien der Fledertiere und Sperlingsvögel fehlt das Enzym L-Gulonolactonoxidase (B in obiger Abbildung) aufgrund eines genetischen Defekts, sodass sie Ascorbinsäure nicht synthetisieren können.[80] Die genetische Mutation bei Trockennasenprimaten trat vor etwa 65 Millionen Jahren auf.[80] Diese Primaten waren seinerzeit in einer Gegend angesiedelt, die ganzjährig reich an Vitamin-C-haltigen Früchten war. Daher hatte dieser bei anderen Tieren letale Defekt keine negativen Auswirkungen. Auch einige Insekten wie die Wanderheuschrecken (Acrididae) können Ascorbinsäure nicht selbständig herstellen.[81]
Funktion
Eine wichtige Funktion der Ascorbinsäure im menschlichen Organismus beruht auf ihrer Eigenschaft als Reduktionsmittel. Sie ist also in der Lage, Elektronen auf andere Moleküle zu übertragen.
Zwei grundsätzliche Aufgaben können unterschieden werden:
Ascorbinsäure als Radikalfänger (Scavenger)
Ascorbinsäure dient im tierischen Organismus als Radikalfänger, da sie in der Lage ist, ebensolche auf andere Moleküle zu übertragen. Die Grafik zeigt nicht den tatsächlichen Reaktionsmechanismus, sondern schematisch die Fähigkeit der Ascorbinsäure, unter Reaktion zur Dehydroascorbinsäure zwei Radikale einfangen zu können (vgl. obige Abbildung).
Bei der Verstoffwechslung des Sauerstoffs in der Zelle kann es zur Bildung des Hyperoxidradikals O2•− kommen, wenn der molekulare Sauerstoff O2 bei der Endreaktion der Atmungskette statt vier Elektronen nur eines erhalten hat. Das Hyperoxidradikal ist aufgrund dieses Elektronenmangels extrem reaktiv und in der Lage, molekulare Zellstrukturen zu schädigen. Die Reaktion mit Ascorbinsäure überführt dieses in Wasserstoffperoxid:[82]
Das Wasserstoffperoxid wird von dem Enzym Katalase abgebaut.[82]
Ascorbinsäure als Cofaktor in Redoxreaktionen
Sowohl Ascorbinsäure als auch deren oxidierte Form (DHA) sind Cofaktoren für viele biochemische Reaktionen. Hierbei stellt Ascorbinsäure Elektronen für Kupfer(I)-abhängige Monooxygenasen beziehungsweise Eisen(III)-abhängige Dioxygenasen bereit. In vitro können auch andere Redoxfaktoren diese enzymatischen Reaktionen katalysieren.
Von Bedeutung ist diese Redoxeigenschaft der Ascorbinsäure beispielsweise bei der Synthese von Collagen im menschlichen Stoffwechsel. Zur Darstellung dieses Strukturproteins muss die Aminosäure L-Prolin zu ihrer oxidierten Form, Hydroxyprolin, umgewandelt werden. Ascorbinsäure dient dazu, das in dieser Reaktion genutzte Reduktionsmittel Fe(II) zu regenerieren. Besteht ein Mangel an Vitamin C, kann die Bildung des Hydroxyprolins bei der Collagensynthese nur begrenzt erfolgen, sodass die typischen Symptome des Skorbuts wie Zahnfleischbluten, Zahnausfall und Hautschäden auftreten.
Recycling der Oxidationsprodukte
Die nach Oxidation entstehenden Produkte Semidehydroascorbinsäure und Dehydroascorbinsäure werden enzymatisch wieder zu Ascorbinsäure reduziert. Die Enzyme Cytochrom b5-Reduktase und Thioredoxinreduktase katalysieren die Umwandlung von Semidehydroascorbinsäure zu Ascorbinsäure im Cytosol, unter Verbrauch von NADH beziehungsweise NADPH. Außerdem kann eine Reduktion über elektronentransferierende Membranproteine stattfinden. Dehydroascorbinsäure wird sowohl spontan mittels Glutathion oder NADPH reduziert als auch enzymatisch über die Glutathiontransferase Omega.[83][84]
Abbau
Der Abbau von Dehydroascorbinsäure wird bei Säugetieren durch Hydrolyse zur physiologisch inaktiven 2,3-Diketogulonsäure eingeleitet. Diese wird entweder zu Oxalat und L-Threonsäure gespalten oder zu Kohlenstoffdioxid, Xylose, Xylulose decarboxyliert.[7] Im Unterschied dazu haben Bakterien wie E. coli enzymatische Stoffwechselwege für den Abbau von Ascorbinsäure und wahrscheinlich auch für Dehydroascorbinsäure.[83]
Nachweis
Um Ascorbinsäure quantitativ nachzuweisen, gibt es zahlreiche colorimetrische Methoden, etwa unter Verwendung von 2,4-Dinitrophenylhydrazin. Ascorbinsäure reagiert mit diesem zu einem Hydrazon, dessen Absorption messbar ist. Darüber hinaus kann 2,2′-Bipyridin zum colorimetrischen Nachweis dienen. Hierbei wird die Reduktionskraft der Ascorbinsäure genutzt, die Fe(III) zu Fe(II) reduziert. Fe(II) bildet dann mit 2,2′-Bipyridin einen farbigen Komplex. Es sind auch einige fluorometrische Nachweismethoden bekannt.
Ascorbinsäure lässt sich auch durch Titration mit Tillmans-Reagenz (2,6-Dichlorphenolindophenol, abgekürzt DCPIP) nachweisen, bei der das Reagenz durch die Ascorbinsäure zu einer Leukoverbindung reduziert wird. Dabei ist ein Farbumschlag von tiefblau zu farblos zu beobachten. Diese Methode eignet sich für eine schnelle Bestimmung, die aber an die Genauigkeit oben genannter Wege nicht heranreicht.[7]
Ascorbinsäure kann auch spezifisch mittels Oxidation durch das Enzym Ascorbinsäure-Oxidase nachgewiesen werden, wobei die Änderung der Lichtabsorption bei einer Wellenlänge von 245 nm gemessen wird.[85]
Die Gehaltsbestimmung wird im Europäischen Arzneibuch durch redoximetrische Titration mit 0,05-molarer Iodlösung unter Zusatz von Stärke durchgeführt (Iodometrie). Dabei verbraucht ein Mol Ascorbinsäure ein Mol Iod, das zu farblosem Iodid umgesetzt wird. Die Färbung durch den blauen Iod-Stärke-Komplex dient der Endpunktbestimmung. Da die zugesetzte Stärkelösung die Reaktion verzögert und einen schleppenden Umschlag verursacht, bietet sich eine Indikation mit Variamin an.[86] Der maßanalytische Faktor beträgt 8,8065 mg Ascorbinsäure / ml 0,05 M Iodlösung.
Literatur
- Beat Bächi: Volksdroge Vitamin C für alle! Pharmazeutische Produktion, Vermarktung und Gesundheitspolitik (1933–1953). Chronos, Zürich 2009, ISBN 978-3-0340-0921-8 (= Interferenzen. Band 14, zugleich Dissertation an der Universität Zürich 2008).[87]
- Lester Packer, Jürgen Fuchs: Vitamin C in Health and Disease. Marcel Dekker Inc illustrated edition 1997, ISBN 0-8247-9313-7.
- Hans Konrad Biesalski: Vitamine, Spurenelemente und Minerale: Indikation, Diagnostik, Therapie. 2. Auflage. Georg Thieme Verlag, 2019, ISBN 978-3-13-242738-9, doi:10.1055/b-0039-168614.
- K. Akhilender Naidu: Vitamin C in human health and disease is still a mystery ? An overview. In: Nutrition Journal. Band 2, Nr. 1, 2003, S. 7, doi:10.1186/1475-2891-2-7, PMID 14498993, PMC 201008 (freier Volltext).
Weblinks
- Ascorbat- und Alderatstoffwechsel. Bei: Kegg-Enzyme.
- DGE-Stellungnahme: Vitaminversorgung in Deutschland (Memento vom 10. September 2013 im Internet Archive)
- B. Jassal: Vitamin C (ascorbate) metabolism. In: reactome.org. (englisch)
- Vitamin C: Mikroskop-Aufnahmen in polarisiertem Licht. – Galerie von Mikrokristallen.
- Höchstmengenvorschläge für Vitamin C in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: Bundesinstitut für Risikobewertung. 2021, abgerufen am 6. Januar 2022.
- Der erfundene Vitamin C-Mangel. In: Quarks. WDR, 27. April 2021, abgerufen am 6. Januar 2022.
Einzelnachweise
- Eintrag zu E 300: Ascorbic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 29. Juli 2020.
- Eintrag zu ASCORBIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Februar 2020.
- Eintrag zu L(+)-Ascorbinsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Oktober 2016. (JavaScript erforderlich)
- DGE: Die Referenzwerte für die Nährstoffzufuhr: Vitamin C, gültig für den Bereich D-A-CH, Stand 2015, abgerufen 28.01.2022.
- M. Zimmermann, C. Erbacher-von Grumbkow (Übers.): Burgersteins Mikronährstoffe in der Medizin: Prävention und Therapie. Ein Kompendium. 3. Auflage, Georg Thieme Verlag, 2003, ISBN 978-3-8304-7162-2, S. 237.
- Vitamin C, Titrating To Bowel Tolerance, Anascorbemia, and Acute Induced Scurvy (Memento vom 28. April 2013 im Internet Archive)
- C. S. Tsao: An overview of ascorbic acid chemistry and biochemistry. In: Lester Packer, Jürgen Fuchs: Vitamin C in Health and Disease. Marcel Dekker Inc illustrated edition 1997, ISBN 0-8247-9313-7, S. 25–58.
- P. Weber: Vitamin C.; Vitamine, Spurenelemente und Mineralstoffe. 2002, S. 57–69.
- Scott and Scurvy. Auf: idlewords.com. 3. Juli 2010, abgerufen am 22. Dezember 2014.
- K. R. Norum, H, J. Grav: Axel Holst og Theodor Frølich – pionerer i bekjempelsen av skjørbuk. In: Tidsskrift for Den norske legeforening. Band 122, Nr. 17, 30. Juni 2002, S. 1686–1687, PMID 12555613.
- A. Harden und S. S. Zilva: The Antiscorbutic Factor in Lemon Juice. In: The Biochemical Journal. 1918, Nr. 12, S. 259–269; PDF (freier Volltextzugriff, engl.)
- J. L. Svirbely und A. Szent-Gyorgyi: The Chemical Nature Of Vitamin C. In: The Biochemical Journal. 1933, Nr. 27, S. 279–285; PDF (freier Volltextzugriff, engl.)
- Patent GB443901: Improvements in or relating to the manufacture of ascorbic acid and its analogues.
- Susanne Schäfer: Hoffmann-La Roche: Hokuspokus mit Langzeitwirkung. In: brand eins. 2018, abgerufen am 2. Mai 2021.
- Markus Grill: Nationalsozialismus: Vitaminschub für den Volkskörper. In: Spiegel online. 19. Januar 2012, unter Bezugnahme auf eine im März 2012 erscheinende Habilitationsschrift von Heiko Stoff. Abgerufen am 22. Dezember 2014.
- René Zipperlen: Wenig sinnvoll, aber viel gekauft: Der Hokuspokus ums Vitamin C. In: Die Tageszeitung: taz. 23. Oktober 2009, ISSN 0931-9085 (taz.de [abgerufen am 2. Mai 2021]).
- Gerhard G. Habermehl, Peter E. Hammann, Hans C. Krebs, W. Ternes: Naturstoffchemie: Eine Einführung. Springer Verlag Berlin, 3. vollst. überarb. u. erw. Auflage 2008, ISBN 978-3-540-73732-2, S. 666.
- Werner Kollath: Die Ordnung unserer Nahrung, 13. Auflage 1987, S. 171.
- Wilhelm Friedrich: Vitamins. Gruyter 1988. ISBN 978-3-11-010244-4; S. 949.
- https://www.naehrwertrechner.de/naehrwerte/Brennnessel/Vitamine/
- Eigenschaften der Apfelbeere. In: Apfelbeere.org. Abgerufen am 22. Dezember 2014 (Tabellen mit Vitamin- und Anthocyangehalt der Apfelbeere).
- Das Vorkommen von Vitamin C. In: chemieunterricht.de. Abgerufen am 22. Dezember 2014.
- Gesellschaft Deutscher Chemiker (GDCh): Weiße Biotechnologie: Status quo und Zukunft. In: Nachrichten aus der Chemie. Dezember 2006. doi:10.1002/nadc.20060541209.
- M. S. Hähnlein: Entwicklung und Charakterisierung von Edelmetallträgerkatalysatoren und Edelmetallnanosolen zur katalytischen Nitrat- und Nitritreduktion sowie zur Sorboseoxidation. Dissertation Technische Universität Braunschweig, 1999.
- J. Emsley, A. Schleitzer (Übers.): Fritten, Fett und Faltencreme: Noch mehr Chemie im Alltag. Wiley-VCH, 2004, ISBN 978-3-527-31147-7.
- Brigitte Osterath: Prozessentwicklung zur Produktion von 2-Keto-L-Gulonsäure, einer Vitamin C-Vorstufe. Dissertation Rheinische Friedrich-Wilhelms-Universität Bonn, 2009, urn:nbn:de:hbz:5N-20434. S. 2.
- T. Sonoyama u. a.: Production of 2-Keto-L-Gulonic Acid from D-Glucose by Two-Stage Fermentation. In: Applied and Environmental Microbiology. Band 43, Nr. 5, Mai 1982, S. 1064–1069, PMID 16346005 (englisch, Volltext [PDF]).
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme, Stuttgart 2008, ISBN 978-3-13-144861-3, S. 569 (eingeschränkte Vorschau in der Google-Buchsuche).
- J. Hvoslef: The Crystal Structure of L-Ascorbic Acid, ‘Vitamin C’. I. The X-ray Analysis. In: Acta Crystallographica, Section B. Structural Crystallography and Crystal Chemistry. 24, S. 23–35, doi:10.1107/S0567740868001664.
- O. Adam, P. Schauder, G. Ollenschläger: Ernährungsmedizin: Prävention und Therapie. 3. Auflage, Elsevier, Urban & Fischer Verlag, 2006, ISBN 978-3-437-22921-3, S. 96.
- Externe Identifikatoren von bzw. Datenbank-Links zu D-Ascorbinsäure: CAS-Nummer: 10504-35-5, PubChem: 54690394, ChemSpider: 12283687, Wikidata: Q27076988.
- Säure-Base-Reaktionen. (PDF; 307 kB), S. 4.
- Braulio Gómez Ruiz et al.: Kinetic modelling of ascorbic and dehydroascorbic acids concentrations in a model solution at different temperatures and oxygen contents. In: Food Research International. Band 106, 1. April 2018, S. 901–908, doi:10.1016/j.foodres.2018.01.051.
- H. Schneemann, G. Wurm, R. Batty, W. Blaschek, W. Reuß: Hagers Handbuch der Pharmazeutischen Praxis. Stoffe A–D, Waren und Dienste. 5. Auflage, Birkhäuser, 1995, ISBN 978-3-540-52688-9, S. 299–301.
- K. Meyer-Rankes, O. Adam, H. Koula-Jenik: Leitfaden Ernährungsmedizin. Elsevier, Urban & Fischer Verlag, 2006, ISBN 978-3-437-56530-4, S. 37.
- W. Bors und G. R. Buettner: The vitamin C radical and its reactions. In: Lester Packer, Jürgen Fuchs: Vitamin C in Health and Disease. Marcel Dekker Inc illustrated edition 1997, ISBN 0-8247-9313-7, S. 76.
- Sagun Kc et al.: Vitamin C enters mitochondria via facilitative glucose transporter 1 (Glut1) and confers mitochondrial protection against oxidative injury. In: FASEB journal: official publication of the Federation of American Societies for Experimental Biology. Band 19, Nr. 12, Oktober 2005, S. 1657–1667, doi:10.1096/fj.05-4107com, PMID 16195374.
- J. Huang et al.: Dehydroascorbic acid, a blood-brain barrier transportable form of vitamin C, mediates potent cerebroprotection in experimental stroke. In: Proceedings of the National Academy of Sciences of the United States of America. Band 98, Nr. 20, 25. September 2001, S. 11720–11724, doi:10.1073/pnas.171325998, PMID 11573006.
- Y. Nishikawa und T. Kurata: Interconversion between dehydro-L-ascorbic acid and L-ascorbic acid. In: Bioscience, Biotechnology, and Biochemistry. Band 64, Nr. 3, März 2000, S. 476–483, doi:10.1271/bbb.64.476, PMID 10803943.
- Y. Nishikawa et al.: Identification of 3,4-dihydroxy-2-oxo-butanal (L-threosone) as an intermediate compound in oxidative degradation of dehydro-L-ascorbic acid and 2,3-diketo-L-gulonic acid in a deuterium oxide phosphate buffer. In: Bioscience, Biotechnology, and Biochemistry. Band 65, Nr. 8, August 2001, S. 1707–1712, doi:10.1271/bbb.65.1707, PMID 11577707.
- A. Deifel: Die Chemie der L-Ascorbinsäure in Lebensmitteln. In: Chemie in unserer Zeit. 27. Jahrg. 1993, Nr. 4, S. 198–207 (doi:10.1002/ciuz.19930270405).
- Shailja Chambial et al. Vitamin C in Disease Prevention and Cure: An Overview. Indian Journal of Clinical Biochemistry. Oktober 2013; 28(4): S. 314–328 (doi:10.1007/s12291-013-0375-3; PMID 24426232).
- H.-K. Biesalki u. a. Ernährungsmedizin – Nach dem Curriculum der Bundesärztekammer. 3. Auflage 2005. Georg Thieme Verlag, ISBN 978-3-13-100294-5, S. 143–147.
- J. D. Campbell et al.: Ascorbic acid is a potent inhibitor of various forms of T cell apoptosis. In: Cellular Immunology. Band 194, Nr. 1, 25. Mai 1999, S. 1–5, doi:10.1006/cimm.1999.1485, PMID 10357874.
- Eva S. Wintergerst et al.: Immune-enhancing role of vitamin C and zinc and effect on clinical conditions. In: Annals of Nutrition & Metabolism. Band 50, Nr. 2, 2006, S. 85–94, doi:10.1159/000090495, PMID 16373990.
- W. R. Thomas, P. G. Holt: Vitamin C and immunity: an assessment of the evidence. In: Clinical and Experimental Immunology. (1978) 32, S. 370–379 (PMC 1541262 (freier Volltext)).
- B. Leibovitz und B. V. Siegel: Ascorbic acid, neutrophil function, and the immune response. In: International Journal for Vitamin and Nutrition Research. Internationale Zeitschrift für Vitamin- und Ernahrungsforschung. Journal International De Vitaminologie Et De Nutrition. Band 48, Nr. 2, 1978, S. 159–164, PMID 357320.
- P. C. Elwood et al.: A randomized controlled trial of vitamin C in the prevention and amelioration of the common cold. In: British Journal of Preventive and Social Medicine. 1976; 30(3), S. 193–196 (PMC 478963 (freier Volltext)).
- H. Hemilä, E. Chalker: Vitamin C for preventing and treating the common cold. In: Cochrane Database of Systematic Reviews. 2013; 1:CD000980. doi:10.1002/14651858.CD000980.
- R. M. Douglas, E. B. Chalker, B. Treacy: Vitamin C for preventing and treating the common cold. In: Cochrane Database of Systematic Reviews. 2000; 2:CD000980.
- Bernd Kerschner: Vitamin C ist bei Erkältungen nutzlos. In: Medizin transparent. 15. September 2017, abgerufen am 20. Januar 2020 (österreichisches Deutsch).
- Deutsche Gesellschaft für Ernährung, abgerufen am 25. November 2015
- Carmel Jacobs et al.: Is there a role for oral or intravenous ascorbate (vitamin C) in treating patients with cancer? A systematic review. In: The Oncologist. Band 20, Nr. 2, Februar 2015, S. 210–223, doi:10.1634/theoncologist.2014-0381, PMID 25601965, PMC 4319640 (freier Volltext).
- Gwendolyn N.Y. van Gorkom et al.: The Effect of Vitamin C (Ascorbic Acid) in the Treatment of Patients with Cancer: A Systematic Review. In: Nutrients. Band 11, Nr. 5, 28. April 2019, doi:10.3390/nu11050977, PMID 31035414, PMC 6566697 (freier Volltext).
- Pascal L. Langlois et al.: Vitamin C Administration to the Critically Ill: A Systematic Review and Meta-Analysis. In: JPEN. Journal of parenteral and enteral nutrition. Band 43, Nr. 3, März 2019, S. 335–346, doi:10.1002/jpen.1471, PMID 30452091.
- J. C. Boffi et al.: Positive modulation of the α9α10 nicotinic cholinergic receptor by ascorbic acid. In: British Journal of Pharmacology. Band 168, Nr. 4, Februar 2013, S. 954–965, doi:10.1111/j.1476-5381.2012.02221.x, PMID 22994414, PMC 3631383 (freier Volltext).
- M. Levine et al.: Vitamin C pharmacokinetics in healthy volunteers: evidence for a recommended dietary allowance. In: Proceedings of the National Academy of Sciences of the United States of America. Band 93, Nr. 8, 16. April 1996, S. 3704–3709, doi:10.1073/pnas.93.8.3704, PMID 8623000.
- J. Lunec, D. R. Blake: The determination of dehydroascorbic acid and ascorbic acid in the serum and synovial fluid of patients with rheumatoid arthritis (RA). In: Free Radical Research Communications. 1985;1(1), S. 31–39; PMID 3880014.
- Kumar Shanmugasundaram u. a., 2001.
- C. L. Long, K. I. Maull, R. S. Krishnan, H. L. Laws, J. W. Geiger, L. Borghesi, W. Franks, T. C. Lawson, H. E. Sauberlich: Ascorbic acid dynamics in the seriously ill and injured. In: Journal of Surgical Research. Februar 2003, 109 (2), S. 144–148. PMID 12643856.
- H. R. Frikke-Schmidt, J. Lykkesfeldt: Role of marginal vitamin C deficiency in atherogenesis: In vivo models and clinical studies. In: Basic & Clinical Pharmacology & Toxicology. 2009; 104 (6); S. 419–433; doi:10.1111/j.1742-7843.2009.00420.x.
- K. T. Khaw, S. Bingham, A. Welch, R. Luben, N. Wareham, S. Oakes, N. Day: Relation between plasma ascorbic acid and mortality in men and women in EPIC-Norfolk prospective study: a prospective population study. European Prospective Investigation into Cancer and Nutrition. In: The Lancet. März 2001; 357(9257), S. 657–663; PMID 11247548.
- G. Drouin, J. R. Godin, B. Pagé: The genetics of vitamin C loss in vertebrates. In: Current genomics. Band 12, Nummer 5, August 2011, S. 371–378, doi:10.2174/138920211796429736, PMID 22294879, PMC 3145266 (freier Volltext).
- S. Englard, S. Seifter: The Biochemical Functions of Ascorbic Acid. In: Annual Review of Nutrition. 6, 1986, S. 365–406, doi:10.1146/annurev.nu.06.070186.002053.
- Cunningham P, Afzal-Ahmed I, Naftalin RJ: Docking studies show that D-glucose and quercetin slide through the transporter GLUT1. In: J. Biol. Chem. Vol. 281, Nr. 9, März 2006, S. 5797–803, doi:10.1074/jbc.M509422200, PMID 16407180 (englisch).
- Montel-Hagen A, Kinet S, Manel N, et al: Erythrocyte Glut1 triggers dehydroascorbic acid uptake in mammals unable to synthesize vitamin C. In: Cell. Vol. 132, Nr. 6, März 2008, S. 1039–48, doi:10.1016/j.cell.2008.01.042, PMID 18358815 (englisch).
- Jeffrey S. Hampl, Christopher A. Taylor, and Carol S. Johnston: Vitamin C Deficiency and Depletion in the United States: The Third National Health and Nutrition Examination Survey, 1988 to 1994. In: American Journal of Public Health. Mai 2004, Vol. 94, No. 5, S. 870–875, doi:10.2105/AJPH.94.5.870, PMID 15117714, PMC 1448351 (freier Volltext).
- R. L. Schleicher, M. D. Carroll, E. S. Ford, D. A. Lacher: Serum vitamin C and the prevalence of vitamin C deficiency in the United States: 2003–2004 National Health and Nutrition Examination Survey (NHANES). In: The American Journal of Clinical Nutrition. November 2009; 90 (5), S. 1252–1263, doi:10.3945/ajcn.2008.27016.
- Leah Cahill, Paul N. Corey, Ahmed El-Sohemy: Vitamin C Deficiency in a Population of Young Canadian Adults. In: American Journal of Epidemiology. 2009, 170 (4), S. 464–471, doi:10.1093/aje/kwp156.
- Höchstmengenvorschläge für Vitamin C in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: BfR. 2021, S. 3, abgerufen am 6. November 2021.
- M. Levine u. a.: Vitamin C pharmacokinetics in healthy volunteers: evidence for a recommended dietary allowance. In: Proceedings of the National Academy of Sciences. Band 93, Nr. 8, 1996, S. 3704–3709, PMID 8623000, PMC 39676 (freier Volltext).
- Intravenous Ascorbate as a Chemotherapeutic and Biologic Response Modifying Agent (Memento vom 9. Januar 2010 im Internet Archive) In: The Center for the Improvement of Human Functioning International.
- Harnwegsinfektion und Blasenentzündung (Zystitis). (Nicht mehr online verfügbar.) Heribert Schorn, 11. Juli 2008, archiviert vom Original am 26. August 2014; abgerufen am 23. Dezember 2014.
- L. K. Thomas, C. Elinder, H. Tiselius, A. Wolk, A. Åkesson: Ascorbic acid supplements and kidney stone incidence among men: A prospective study. In: JAMA Internal Medicine. Band 173, Nr. 5, 2013, S. 386–388, doi:10.1001/jamainternmed.2013.2296.
- John X. Wilson: The physiological role of dehydroascorbic acid. In: FEBS Letters. Band 527, Nr. 1–3, 11. August 2002, S. 5–9, doi:10.1016/S0014-5793(02)03167-8, PMID 12220624.
- S. C. Rumsey et al.: Glucose transporter isoforms GLUT1 and GLUT3 transport dehydroascorbic acid. In: The Journal of Biological Chemistry. Band 272, Nr. 30, 25. Juli 1997, S. 18982–18989, doi:10.1074/jbc.272.30.18982, PMID 9228080.
- W. J. Liang et al.: Vitamin C transport systems of mammalian cells. In: Molecular Membrane Biology. Band 18, Nr. 1, Januar 2001, S. 87–95, doi:10.1080/09687680110033774, PMID 11396616.
- H. Wang et al.: Human Na(+)-dependent vitamin C transporter 1 (hSVCT1): primary structure, functional characteristics and evidence for a non-functional splice variant. In: Biochimica Et Biophysica Acta. Band 1461, Nr. 1, 9. November 1999, S. 1–9, doi:10.1016/s0005-2736(99)00182-0, PMID 10556483.
- John M. C. Gutteridge, Naoyuki Taniguchi: Experimental Protocols for Reactive Oxygen and Nitrogen Species. Oxford University Press, 2000, ISBN 0-19-850668-6.
- Irwin Stone: The Natural History of Ascorbic Acid in the Evolution of the Mammals and Primates and Its Significance for Present Day Man. (Memento vom 3. Oktober 2013 im Internet Archive) 1972.
- Eintrag zu L-Ascorbinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Januar 2013.
- G. Becher, K. Winsel: [Short scientific report. Vitamin C lessens superoxide anion(O2)-induced bronchial constriction]. In: Zeitschrift Fur Erkrankungen Der Atmungsorgane. Band 173, Nr. 1, 1989, S. 100–104, PMID 2552692.
- Carole L. Linster und Emile van Schaftingen: Vitamin C. Biosynthesis, recycling and degradation in mammals. In: The FEBS journal. Band 274, Nr. 1, Januar 2007, S. 1–22, doi:10.1111/j.1742-4658.2006.05607.x, PMID 17222174.
- P. D’Eustachio: Reduction of dehydroascorbate to ascorbate. In: reactome.org.
- Enzymatic Assay of ASCORBATE OXIDASE (Memento vom 26. Juni 2011 im Internet Archive) In: SigmaAldrich.com. (PDF; 18 kB).
- L. Erdey, L. Káplár: Maßanalytische Ascorbinsäurebestimmungen mit Variaminblau als Indicator. In: Fresenius’ Zeitschrift für Analytische Chemie. Band 162, Nr. 3, 1958, S. 180–187, doi:10.1007/BF00456881.
- Rezension von Igor Polianski. In: H-Soz-Kult. 10. Juni 2010.