Tetrachlormethan
Tetrachlormethan (auch Tetrachlorkohlenstoff, Tetra) ist eine chemische Verbindung aus der Reihe der Chlorkohlenwasserstoffe. Bei ihm sind alle Wasserstoffatome des Methans durch Chloratome substituiert. Beide Bezeichnungen sind nach der IUPAC-Nomenklatur korrekt, abhängig davon, ob die Verbindung als organische (Tetrachlormethan) oder anorganische (Tetrachlorkohlenstoff) Verbindung angesehen wird.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
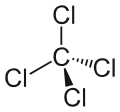 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetrachlormethan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CCl4 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, unangenehm süßlich riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 153,82 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,594 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
76,7 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (0,8 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Dipolmoment |
0[2] | ||||||||||||||||||
| Brechungsindex |
1,4630[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Treibhauspotential |
2019 (bezogen auf 100 Jahre)[7] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−128,2 kJ/mol[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Geschichte
Eine erste Herstellung gelang 1839 dem französischen Chemiker Henri Victor Regnault durch das Erhitzen von Chloroform mit Chlorgas.[9][10][11]
Herstellung
Tetrachlormethan fällt bei der industriellen Herstellung von Chloroform an. Dazu wird Chlor mit Methan oder Chlormethan auf 400–500 °C erhitzt. Bei dieser Temperatur findet eine schrittweise radikalische Substitution bis hin zu Tetrachlormethan statt:
- Methan reagiert mit Chlor unter Bildung von Chlorwasserstoff zunächst zu Chlormethan, und weiter zu Dichlormethan, Trichlormethan (Chloroform) und schließlich Tetrachlormethan.
Das Ergebnis des Prozesses ist eine Mischung der vier Chlormethane, welche durch Destillation getrennt werden können.[12]
Eigenschaften
Physikalische Eigenschaften

Tetrachlormethan ist eine farblose, stark lichtbrechende, süßlich riechende, nicht brennbare, giftige Flüssigkeit mit einem Schmelzpunkt von −23 °C und einem Siedepunkt von 76,7 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,02291, B = 1221,781 und C = −45,739 im Temperaturbereich von 293 bis 350 K.[13] Tetrachlormethan ist mit Ethanol, Ether oder Benzin gut mischbar und es löst Fette, Öle und Harze. Die Mischbarkeit mit Wasser ist begrenzt. Mit steigender Temperatur steigt die Löslichkeit von Tetrachlormethan in Wasser bzw. steigt die Löslichkeit von Wasser in Tetrachlormethan.[14]
Löslichkeiten zwischen Tetrachlormethan und Wasser[14] Temperatur °C 0 10,0 20,5 31,0 41,3 52,5 64,0 75,0 Tetrachlormethan in Wasser in Ma-% 0,089 0,063 0,060 0,072 0,068 0,078 0,096 0,115 Wasser in Tetrachlormethan in Ma-% 0,0086 0,0102 0,0124 0,0156 0,0194 0,0263 0,0284 0,0304
Chemische Eigenschaften
Tetrachlormethan ist sehr reaktionsträge und wird von Säuren und Laugen nicht angegriffen. Bei Kontakt mit Alkalimetallen und Aluminium findet jedoch eine explosionsartige Reaktion statt. Unter Licht- und Wärmeeinwirkung entsteht besonders in Anwesenheit von Feuchtigkeit das Giftgas Phosgen. Tetrachlormethan gehört zu den krebserzeugenden Stoffen und ist wie Chloroform stark leberschädigend. Außerdem ist es schädlich für Wasserorganismen und trägt mit zum Abbau der Ozonschicht bei, da es sich unter UV-Einwirkung aufspaltet: Es entstehen Chlorradikale, die sehr schädlich auf Ozon wirken (Ozonloch in der Arktis und Antarktis).
Verwendung
Tetrachlormethan wurde in frühen Generationen von Feuerlöschern und Anfang bis Mitte des 20. Jahrhunderts für die chemische Reinigung von Textilien verwendet. Heute wird es jedoch aufgrund der großen Toxizität der Substanz nicht mehr eingesetzt.
Wirkung auf den Menschen
Tetrachlormethan ist ein sehr starkes Hepatoxin. Die akute Vergiftung führt zu Leber- und Nierenschäden, die sich im Laufe einiger Wochen bis Monate zurückbilden können. Es wird aber auch von Leberzirrhosen als Spätfolge berichtet. Dauerhafte Exposition führt zu schweren Schädigungen der Leber und der Nieren. Die leberschädigende Wirkung wird durch die gemeinsame Aufnahme von z. B. Ethanol oder Barbituraten noch potenziert. Im Tierversuch wirkt Tetrachlormethan krebserregend, beim Menschen besteht der begründete Verdacht auf kanzerogenes Potential. Toxikologisch relevante Dosen können vermutlich auch über die Haut aufgenommen werden.[1]
Typische akute Symptome nach dem Einatmen der Dämpfe von Tetrachlormethan sind, je nach Konzentration:
- Kopfschmerzen
- Übelkeit und Schwindel
- Störungen des Zentralnervensystems
- Herabsetzung der Sinnesleistungen (Sehschärfe, Gehörempfindlichkeit usw.)
- Bewusstlosigkeit
Bei Hautkontakt kann es mit viel Wasser oder Polyethylenglycol abgewaschen werden.
Sicherheitshinweise / Risikobewertung
Das Herstellen, Inverkehrbringen und Verwenden von Tetrachlormethan ist aufgrund seiner toxischen, krebserregenden und die Ozonschicht schädigenden Wirkung international verboten. Ausgesprochen wurde das Verbot mit der Aufnahme von Tetrachlormethan in das Montreal-Protokoll im September 1997 ("Montrealer Änderungen"), es trat zum 10. November 1999 in Kraft. Die Verwendung ist seitdem nur noch zu Forschungszwecken erlaubt. Das Verbot ist in der Chemikalien-Ozonschichtverordnung geregelt.
Tetrachlormethan wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Tetrachlormethan waren die Besorgnisse bezüglich der Einstufung als CMR-Substanz, Exposition von Arbeitnehmern und hoher (aggregierter) Tonnage. Die Neubewertung lief von 2012 bis 2019 und wurde von Frankreich durchgeführt; anschließend wurde ein Abschlussbericht veröffentlicht.[15][16]
Literatur
- M. Rossberg; W. Lendle; G. Pfleiderer, A. Tögel; T.R. Torkelson, K.K. Beutel: Chloromethanes, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a06_233.pub3.
Weblinks
Einzelnachweise
- Eintrag zu Tetrachlormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Oktober 2018. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- Eintrag zu Carbon tetrachloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 56-23-5 bzw. Tetrachlormethan), abgerufen am 2. November 2015.
- Eintrag zu Carbon tetrachloride in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- V. Regnault: Sur les chlorures de carbone CCl et CCl2 in Ann. Chimie Physique 70 (1839) 104–107.
- V. Regnault: Ueber die Chlorverbindungen des Kohlenstoffs, C2Cl2 und CCl2 in Ann. Pharm. 30 (1839) 350–352.
- Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 153 pdf.
- A. Ohligschläger, K. Menzel, A.T. Kate, J. Ruiz Martinez, C. Frömbgen, J. Arts, A. McCulloch, M. Rossberg, W. Lendle, G. Pfleiderer, A. Tögel, T.R. Torkelson, K.K. Beutel: Chloromethanes, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2019; doi:10.1002/14356007.a06_233.pub4.
- Hildenbrand, D.L.; McDonald, R.A.: The Heat of Vaporization and Vapor Pressure of Carbon Tetrachloride; the Entropy from Calorimetric Data in J. Phys. Chem. 63 (1959) 1521–1523, doi:10.1021/j150579a053.
- R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992) 80–95, doi:10.1021/je00005a024.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Carbon tetrachloride, abgerufen am 1. Mai 2020.

