Monophosphan
Monophosphan, umgangssprachlich unpräzise als Phosphorwasserstoff oder veraltet als Phosphin bezeichnet, gehört zur Gruppe der Phosphane. Monophosphan ist eine chemische Verbindung des Elements Phosphor mit der Summenformel PH3.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Monophosphan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | PH3 | ||||||||||||||||||
| Kurzbeschreibung |
brennbares, giftiges, farb- und geruchloses Gas; durch Verunreinigungen Geruch nach Knoblauch und faulem Fisch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 34,00 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
1,53 kg·m−3 (0 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−87,8 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (330 mg·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Brechungsindex |
1,224 (16,85 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Monophosphan ist ein brennbares, äußerst giftiges, im reinen Zustand geruchloses Gas. Reines Monophosphan ist erst bei 150 °C selbstentzündlich. Durch das Vorhandensein von Diphosphan P2H4 brennt kommerziell erhältliches und im Labor zubereitetes Gas jedoch auch bei Raumtemperatur bei der Zufuhr von Luft; das Diphosphan und andere Phosphane verleihen diesem gewöhnlich nicht ganz reinen Monophosphan einen starken Geruch nach Knoblauch.
Als mutagenes Klastogen kann es als Gift wirken, indem es Chromosomenaberrationen hervorruft und somit eine kanzerogene Wirkung besitzen würde.[5]
Es wurde zuerst von dem Lavoisier-Schüler Philippe Gengembre 1789 dargestellt,[6] in der flüssigen selbstentzündlichen Form von Paul Thénard 1845,[7] der auch die feste Form fand, und die erste direkte Analyse erfolgte durch Ludwig Gattermann 1890.[8]
Der Nachweis von Monophosphan in der Atmosphäre wurde als ein möglicher Hinweis auf Leben auf erdähnlichen Planeten vorgeschlagen, da es spektroskopisch nachweisbar ist und auf der Erde nur biologisch oder künstlich erzeugt wird.[9] Am 14. September 2020 wurde in einer Veröffentlichung bei Nature Astronomy der Nachweis von Monophosphan in der Atmosphäre der Venus bekannt gegeben, wobei ein Mechanismus für die Bildung des Gases in der Venusatmosphäre bisher unbekannt ist.[10] In der Atmosphäre der Gasplaneten Jupiter und Saturn ist Monophosphan seit den 1970er-Jahren bekannt und wird hier wahrscheinlich in den tieferen, heißen Regionen unter hohem Druck gebildet.[11]
Gewinnung und Darstellung
Es gibt zahlreiche Möglichkeiten zur Darstellung von Monophosphan. Zum Beispiel disproportioniert weißer Phosphor (P4) im alkalischen Medium zu Phosphan und Phosphinsäure, welche bei höheren Temperaturen zu Monophosphan und Phosphonsäure disproportioniert, welche wiederum zu Phosphorsäure und Monophosphan disproportioniert:
Diese Methode wird technisch im Autoklaven bei 250 °C durchgeführt.
Analog zur Herstellung von Ammoniak (Haber-Bosch-Verfahren) kann auch eine Synthese aus den Elementen erfolgen:
Monophosphan entsteht auch bei der sauren Hydrolyse von salzartigen Phosphiden und Phosphonium-Salzen, sowie bei der Hydridolyse von Phosphorhalogeniden wie z. B. Phosphortrichlorid mit Lithiumaluminiumhydrid in Ether.
Im Labor wird Monophosphan in annähernd quantitativer Ausbeute durch thermische Zersetzung von kristalliner Phosphonsäure zwischen 200 und 350 °C[12]
oder durch Umsetzung von Aluminiumphosphid mit konzentrierter Schwefelsäure erhalten[13]:
Eigenschaften
Physikalische Eigenschaften
Monophosphan ist in Wasser kaum löslich, die wässrige Lösung reagiert neutral.
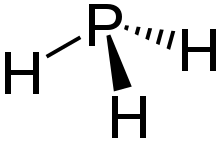
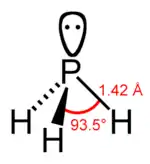
Das Molekül ist trigonal-pyramidal gebaut. Der Winkel zwischen den einzelnen Wasserstoffatomen beträgt 93,5°.[14] Der Abstand zwischen dem Phosphor- und den Wasserstoffatomen beträgt 1,419 Å.
| Kritische Temperatur | 51,9 °C[1] |
| Kritischer Druck | 65,3 bar[1] |
| Gibbs-Energie | 13 kJ/mol |
| Standardentropie | 210 J/(mol·K) |
| Wärmekapazität | 37 J/(mol·K) |
| Verdampfungsenthalpie | 1 kJ/mol |
| Elektrisches Dipolmoment | 1,9·10−30 C·m |
Chemische Eigenschaften
Monophosphan ist eine schwache Base (pKb ~27). Mit Halogenwasserstoffsäuren reagiert es zu unbeständigen Salzen, den sogenannten Phosphoniumsalzen. Bei erhöhter Temperatur zersetzt es sich in die Elemente Wasserstoff und Phosphor.
Mit starken Basen wie Natriumamid oder Butyllithium lassen sich die Wasserstoffatome durch Alkalimetalle ersetzen. Durch Substitution sämtlicher Wasserstoffatome lassen sich die sogenannten Phosphide synthetisieren.
Das Standard-Reduktionspotential beträgt im sauren Milieu −0,063 V, im basischen −0,89 V.
Bei 150 °C entzündet sich reines Monophosphan in Luft und wird zu Phosphorsäure oxidiert:
In Gegenwart von Spuren von Diphosphan mit 0,2 % entzündet sich Monophosphan sofort spontan in Gegenwart von Luft.[15]
Verwendung
Monophosphan wird zur Schädlingsbekämpfung, insbesondere zur Mäuse- und Insektenbekämpfung in Getreidesilos und Lagern von Pflanzenprodukten eingesetzt. Die Begasung kann durch Fachkräfte direkt mit Monophosphangas erfolgen. Häufig werden stattdessen feste Präparate (z. B. mit dem Wirkstoff Aluminiumphosphid AlP oder Calciumphosphid Ca3P2) ausgelegt, die mit der Luftfeuchtigkeit reagieren und so das Monophosphangas freisetzen.
Es wird auch bei der Herstellung von Leuchtdioden zur Dotierung mit Phosphor verwendet. Außerdem wird es zur Synthese diverser organischer Verbindungen verwendet.
Es wurden auch schon Versuche zur Phosphordüngung mittels Monophosphan angestellt.
Sicherheitshinweise
Monophosphan ist ein sehr starkes Nerven- und Stoffwechselgift, das nicht nur bei Säugetieren, sondern auch bei Insekten schon bei niedriger Konzentration hochwirksam ist. Beim Menschen löst es Blutdruckabfall, Erbrechen, Lungenödeme und Koma aus. Außerdem ist Monophosphan durch Spuren von Diphosphan an der Luft selbstentzündlich, so dass bei Handhabung strenge Sicherheitsvorkehrungen notwendig sind.
Nachweis
Monophosphan lässt sich am einfachsten mit sogenannten Prüfröhrchen oder entsprechenden Sensoren nachweisen. Außerdem ist der Geruch von Phosphan (genauer gesagt, der Geruch der enthaltenen Verunreinigungen) ab einer Konzentration von 2 ppm wahrnehmbar.
Literatur
- Produktinformationen der Firma AIR LIQUIDE
- Eintrag zu Phosphane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Juli 2013.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. 60th Edition. CRC Press, Boca Raton FL 1979, ISBN 0-8493-0460-8.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- G. H. Aylward; T. J. V. Findlay: Datensammlung Chemie in SI-Einheiten. 3., erweiterte und neu bearbeitete Auflage. Wiley-VCH, Weinheim u. a. 1999, ISBN 3-527-29468-6.
Einzelnachweise
- Eintrag zu Phosphorwasserstoff in der GESTIS-Stoffdatenbank des IFA, abgerufen am 23. Juli 2016. (JavaScript erforderlich)
- P. G. Sennikov, V. E. Shkrunin, D. A. Raldugin, K. G. Tokhadze: Weak Hydrogen Bonding in Ethanol and Water Solutions of Liquid Volatile Inorganic Hydrides of Group IV-VI Elements (SiH4, GeH4, PH3, AsH3, H2S, and H2Se). 1. IR Spectroscopy of H Bonding in Ethanol Solutions in Hydrides. In: The Journal of Physical Chemistry. Band 100, Nr. 16, Januar 1996, S. 6415–6420, doi:10.1021/jp953245k.
- Eintrag zu Phosphine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Januar 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7803-51-2 bzw. Monophosphan), abgerufen am 2. November 2015.
- Oyeronke A. Odunola, Aliyu Muhammad, Ahsana D. Farooq, Kourosh Dalvandi, Huma Rasheed, Muhammad I. Choudhary, Ochuko L. Erukainure: Comparative assessment of redox-sensitive biomarkers due to acacia honey and sodium arsenite administration in vivo. In: Mediterranean Journal of Nutrition and Metabolism 6, Nr. 2, 2013, S. 119–126, doi:10.1007/s12349-013-0127-1.
- Gengembre, Über eine neue Luft, welche man durch die Wirkung von Laugensalzen auf Kunckels Phosphor erhält, Crells Chemische Annalen, Band 11, 1789, S. 450–457
- Thénard, Mémoire sur les combinaisons du phosphore avec l'hydrogène, Ann. Chim., Reihe 3, Band 14, 1845, S. 5–50
- Gattermann, W. Haussknecht, Untersuchungen über den selbstentzündlichen Phosphorwasserstoff, Berichte der Deutschen Chemischen Gesellschaft, Band 23, 1890, S. 1174–1190
- Clara Sousa-Silva, Sara Seager, Sukrit Ranjan, Janusz Jurand Petkowski, Zhuchang Zhan, Renyu Hu, and William Bains: Phosphine as a Biosignature Gas in Exoplanet Atmospheres. In: Astrobiology. Band 20, Nr. 2, 2020, doi:10.1089/ast.2018.1954. S. a. Preprint (PDF, 4,56 MB) (abgerufen am 15. September 2020).
- Greaves, J.S., Richards, A.M.S., Bains, W. et al.: Phosphine gas in the cloud decks of Venus. In: Nature Astronomy. 2020, doi:10.1038/s41550-020-1174-4.
- Jack A. Kaye, Darrell F. Strobel: Phosphine Photochemistry in the Atmosphere of Saturn. In: Icarus. Band 59, 1984, S. 314--335, doi:10.1016/0019-1035(84)90105-2.
- Sudarshan D. Gokhale and William L. Jolly: Phosphine. In: S. Young Tyree, Jr. (Hrsg.): Inorganic Syntheses. Band 9. McGraw-Hill Book Company, Inc., 1967, S. 56–58 (englisch).
- Robert C. Marriott et al.: Phosphine. In: Aaron Wold and John K. Ruff (Hrsg.): Inorganic Syntheses. Band 14. McGraw-Hill Book Company, Inc., 1973, ISBN 07-071320-0 (defekt), S. 1–4 (englisch).
- M. Binnewies et al.: Allgemeine und Anorganische Chemie. 2. Auflage. Spektrum, 2010, ISBN 3-8274-2533-6, S. 511.
- P. G. Urban, M. J. Pitt (Hrsg.): Bretherick’s Handbook of Reactive Chemical Hazards. 6th edition. Butterworths-Heinemann, Oxford u. a., ISBN 0-7506-3605-X.




