Dampfdruck
Der Dampfdruck ist der Druck, der sich einstellt, wenn sich in einem abgeschlossenen System ein Dampf mit der zugehörigen flüssigen Phase im thermodynamischen Gleichgewicht befindet. Der Dampfdruck nimmt mit steigender Temperatur zu und ist abhängig vom vorliegenden Stoff bzw. Gemisch. Ist in einem offenen System der Dampfdruck einer Flüssigkeit gleich dem Umgebungsdruck, so beginnt die Flüssigkeit zu sieden.
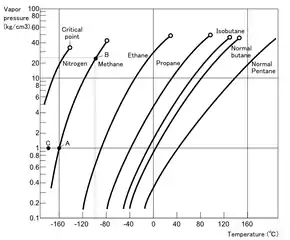
A: Methan siedet bei 1 bar bei −160 °C.
B: Bei −100 °C entwickelt Methan einen Dampfdruck von 25 bar.
C: Bei −170 °C (etwa bei Kühlung durch Flüssigstickstoff) wird Methan bei 1 bar vollständig verflüssigt.
Erläuterung
In einer Flüssigkeit haben die Teilchen bei einer Temperatur über dem absoluten Nullpunkt, sprich größer Null Kelvin, das Bestreben, den Flüssigkeitsverband zu verlassen. Dem entgegen wirken die Oberflächenspannung und der äußere, auf die Flüssigkeit einwirkende Druck. Die Oberflächenspannung verringert sich mit steigender Temperatur, wodurch der Dampfdruck steigt. Am kritischen Punkt ist die Oberflächenspannung Null und der Dampfdruck gleich dem kritischen Druck.
Definitionen
Stoffe können in den drei klassischen Aggregatzuständen fest, flüssig und gasförmig auftreten. Existiert ein Stoff parallel in gasförmiger und in flüssiger Phase, so wird die Gasphase als Dampf bezeichnet. Der Dampfdruck ist also der Druck in einem mehrphasigen System.[2]
In einem geschlossenen System stellt sich ein Gleichgewicht zwischen der flüssigen und der gasförmigen Phase ein. Der Partialdruck einer Komponente wird dann als Dampfdruck bezeichnet. Um zu betonen, dass sich das Gleichgewicht vollständig eingestellt hat, wird auch vom Sättigungsdampfdruck gesprochen.
Ist keine flüssige Phase vorhanden, sondern nur eine gasförmige Phase, handelt es sich nicht um einen Dampfdruck, sondern um einen Partialdruck – im Falle nur einer Komponente in der Gasphase ist dieser gleich dem Gasdruck.
Befinden sich verschiedene Stoffe im betrachteten System, so setzt sich der gemessene Druck der Gasphase aus den Partialdrücken der verschiedenen Stoffe zusammen. Bedingung ist, dass sich diese wie ideale Gase verhalten (Daltonsches Gesetz).
Definition im Sinne der Physik
In Physik und Chemie bezeichnet der Dampfdruck den Partialdruck eines Gases (Mehrkomponentensystem), das im thermodynamischen Gleichgewicht mit seiner flüssigen oder festen Phase steht, er lässt sich über das Raoultsche Gesetz berechnen. Im Einkomponentensystem wird dieser Druck als Gleichgewichtsdruck bezeichnet.
Definition im Sinne der Meteorologie
In der Meteorologie versteht man als Dampfdruck den Partialdruck des Gases (hier in der Regel den Wasserdampfdruck). Der maximale Dampfdruck, der bei Sättigung herrscht, wird identisch zur Definition des Dampfdruckes in der Chemie als Sättigungsdampfdruck bezeichnet.
Wasserdampfdruck
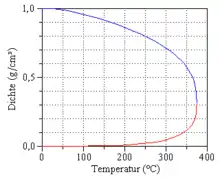
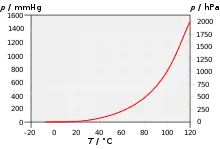
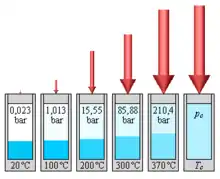
Existieren Wasser und Wasserdampf im thermodynamischen Gleichgewicht nebeneinander, so ist der Druck eine reine Funktion der Temperatur:
Dieser temperaturabhängige und stoffspezifische Druck wird als Dampfdruck und der Graph dieser Funktion als Dampfdruckkurve bezeichnet. Die Dampfdruckkurve endet im kritischen Punkt.
Bei Erhöhung der Temperatur steigen Dampfdruck und Dampfdichte stark an, während die Dichte der Flüssigkeit abnimmt. Die Eigenschaften von Wasser und Dampf werden mit steigender Temperatur immer ähnlicher, bis am kritischen Punkt bei T = Tc = 373,946 °C und p = pc = 22,064 MPa der Unterschied ganz verschwunden ist und nur noch eine einzige Phase existiert. Bei Annäherung an den kritischen Punkt verschwindet die Verdampfungsenthalpie, und es treten starke Dichtefluktuationen auf, erkennbar als kritische Opaleszenz.
Praktische Bedeutung
In einem offenen Topf siedet erhitztes Wasser dann, wenn sein Dampfdruck den Luftdruck der Umgebung übersteigt. Die Siedetemperatur des Wassers ist also vom Luftdruck abhängig und nimmt mit zunehmender Höhe ab, da der natürliche Luftdruck der Erde mit zunehmender Entfernung vom Meeresspiegel kleiner wird. In 2000 m Höhe siedet Wasser bei 93 °C, in 8000 m Höhe bereits bei 74 °C.
Die physikalischen Gesetze zu Dampfdruck und Verdampfung (Dampfdruckkurve, Clausius-Clapeyron-Gleichung etc.) wurden zuerst im Zusammenhang mit der Dampfmaschine untersucht und formuliert. Auch hier gibt es eine Koexistenz von Flüssigkeit und Gas. Man machte sich bei der Dampfmaschine die Tatsache zunutze, dass der Dampfdruck unabhängig von dem Volumen ist, solange man sich im Zweiphasensystem „Flüssigkeit-Gas“ bewegt. Das einzige, was sich bei konstanter Temperatur ändert, ist das Mengenverhältnis „Flüssigkeit-Gas“. Der Druck im Kessel, der den Kolben bewegt, verändert sich also nicht durch die Kolbenbewegung (Kolbenbewegung Volumenänderung im Zylinder). Die Kolbenposition darf jedoch nicht so weit verändert werden, dass eine der Phasen verschwinden würde.
Berechnung
Die Berechnung des Sättigungsdampfdrucks kann bspw. über die Methoden nach Lee-Kesler und Ambrose-Walton erfolgen. Beide Methoden basieren auf dem Korrespondenzprinzip, bei dem kritische Daten und der azentrische Faktor benutzt werden.
Höheren Genauigkeitsanforderungen genügen die Dampfdruckgleichungen, die stoffspezifische, an experimentelle Daten angepasste Parameter verwenden, wie etwa die Wagner- und die Antoine-Gleichung.
Wasserdampfdruck in der Meteorologie
In der Meteorologie wird unter der Bezeichnung Dampfdruck meist der Dampfdruck des Wasserdampfs (Wasserdampfdruck) und somit sein Partialdruck verstanden. Die Dampfdichte entspricht der absoluten Luftfeuchtigkeit.
Der Dampfdruck nach Definition der Meteorologie, also der Partialdruck eines Gases innerhalb eines Gasgemisches, kann durch Umstellung der allgemeinen Gasgleichung mit folgender Formel näherungsweise berechnet werden:
Die einzelnen Formelzeichen stehen für folgende Größen:
- e – Dampfdruck,
- ρi – Dampfdichte (absolute Luftfeuchtigkeit),
- Ri – individuelle Gaskonstante (für Wasserdampf: 461,5 J/(kg K)),
- T – Absolute Temperatur.
Bei einer Lufttemperatur von 20 °C (T = 293,15 K) und maximaler Luftfeuchtigkeit bei dieser Temperatur und Normaldruck (ρi = 0,017 kg/m³) beträgt der so berechnete Dampfdruck etwa 23,39 hPa.
Da der Wasserdampfpartialdruck nur einen kleinen Teil des Luftdrucks ausmacht, ergibt sich nur nach einem recht langen Zeitraum ein thermodynamisches Gleichgewicht, wodurch wesentliche Untersättigungen in der Erdatmosphäre möglich sind, ohne dass das vorhandene flüssige Wasser sofort siedet. Aus diesem Grund und der hohen Dynamik in der Atmosphäre sind thermodynamisch stabile Zustände in der Regel selten oder nur kurz anzutreffen, insbesondere in sehr wetteraktiven Zonen der Erdatmosphäre. Aufgrund des lokal relativ höheren Dampfdrucks über der flüssigen Phase wachsen bei gleichzeitigem Vorhandensein von Wasser und Eis in einer Wolke die Eispartikel auf Kosten der Wassertröpfchen.
Über einer nichtüberhitzten festen Phase ist der Dampfdruck geringer als über einer flüssigen Phase gleicher Temperatur. Stehen beide Phasen über die sie umgebenden Gase miteinander in Kontakt, so wächst daher der Anteil des Feststoffes auf Kosten der Flüssigkeit. Dies liegt darin begründet, dass die stärkere Bindung der Teilchen im Feststoff und die daraus resultierende Schmelzwärme im Falle der Sublimation, also des Phasenübergangs fest-gasförmig, zusätzlich überwunden bzw. aufgebracht werden muss. Dies hat zur Folge, dass es leichter und damit häufiger zur Verdunstung bzw. Verdampfung von Teilchen der flüssigen Phase kommt als zur Sublimation von Teilchen über der festen Phase. Es sind also über der Flüssigkeit mehr Teilchen im gasförmigen Zustand anzutreffen als über dem Feststoff, was den Dampfdruck lokal erhöht und zum Anwachsen der festen Phase führt.
Siehe auch
Literatur
Dampfdruck-Wertetabellen für verschiedene Stoffe:
- K. Scheffler, J. Straub und U. Grigull: Wasserdampftafeln. Thermodynamische Eigenschaften von Wasser und Wasserdampf bis 800 °C und 800 bar. Springer-Verlag, Berlin 1981, ISBN 3-540-10930-7.
- U. Grigull, J. Straub und P. Schiebener: Steam Tables in SI-Units. Wasserdampftafeln. Springer-Verlag, Berlin 1990, ISBN 3-540-51888-6.
- B.I. Lee, M.G. Kesler: A generalized thermodynamic correlation based on three-parameter corresponding states. In: AIChE J. 21, 1975, S. 510, doi:10.1002/aic.690210313.
- K.S. Pitzer, D.Z. Lippmann, R.F. Curl, Jr., C.M. Huggins, D.E. Petersen: The Volumetric and Thermodynamic Properties of Fluids. II. Compressibility Factor, Vapor Pressure and Entropy of Vaporization. In: J. Am. Chem. Soc. 77, 1955, S. 3433, doi:10.1021/ja01618a002.
- W. Wagner, J. Ewers, W. Pentermann: New vapour-pressure measurements and a new rational vapour-pressure equation for oxygen. In: J. Chem. Thermodyn. 8. 1976, S. 1049, doi:10.1016/0021-9614(76)90136-1.
- D. Ambrose, J. Walton: Vapour pressures up to their critical temperatures of normal alkanes and 1-alkanols. In: Pure Appl. Chem. 61, 1989, S. 1395, doi:10.1351/pac198961081395.
Weblinks
- IAPWS (International Association for the Properties of Water and Steam)
- Berechnung von thermodynamischen Größen mit NIST Chemistry Webbook (englisch) http://webbook.nist.gov/chemistry/fluid/
- Video: Dampfdruck, ein Beispiel für ein Phasengleichgewicht. Jakob Günter Lauth (SciFox) 2019, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/40353.
Einzelnachweise
- Die Einheit der y-Achse ist falsch angegeben. Hier könnte kg/cm2 (veraltet) oder besser 10 N/cm2 bzw. bar stehen.
- Physikalische Chemie Eine Einführung nach neuem Konzept mit zahlreichen Experimenten. Wiesbaden 2011, ISBN 978-3-8348-9834-0.
- Faustregel für Wasserstrahlpumpe an Kaltwasser von 5–25 °C
- Karl Stephan, Franz Mayinger: Thermodynamik. Band 1: Einstoffsysteme. Grundlagen und technische Anwendungen. Springer, Berlin/Heidelberg 1998 doi:10.1007/978-3-662-13213-5, (Anhang: Dampftabellen – Tabelle I. Zustandsgrößen von Wasser und Dampf bei Sättigung (Temperaturtafel)).