Peroxomonophosphorsäure
Peroxomonophosphorsäure ist eine Oxosäure des Phosphors. Ihre Salze heißen Peroxomonophosphate.[4] Sie ist neben der Peroxodiphosphorsäure eine der beiden bekannten Peroxophosphorsäuren.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
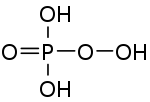 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Peroxomonophosphorsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | H3PO5 | ||||||||||||
| Kurzbeschreibung |
farblose, viskose Flüssigkeit[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 114,00 g·mol−1 | ||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||
| Löslichkeit |
löslich in Acetonitril, Dioxan[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Geschichte
Die beiden Peroxophosphorsäuren wurden 1910 erstmals von J. Schmidlin und P. Massini hergestellt und beschrieben.[5] Die Reaktion zwischen Phosphorpentoxid und hochkonzentriertem Wasserstoffperoxid verläuft allerdings sehr heftig und ist schwer kontrollierbar. Neben der Verwendung von Phosphorpentoxid sind auch Herstellungen aus Metaphosphorsäure und Diphosphorsäure erwähnt.
Eine Methode der Herstellung aus Phosphorpentoxid in inerten Lösungsmitteln wie Diethylether, Isoamylalkohol und Acetonitril wurde 1937 von G. Toennies beschrieben, wobei sich nur die Variante in Acetonitril als geeignet erwies.[6]
Gewinnung und Darstellung
Peroxomonophosphorsäure wird durch die Umsetzung von Phosphorpentoxid mit hochkonzentriertem Wasserstoffperoxid in einem inerten Lösungsmittel wie Acetonitril oder Tetrachlormethan hergestellt.[1][2][7]
Im Gemisch mit Peroxodiphosphorsäure entsteht sie auch bei der Behandlung von Phosphorsäure mit Fluor.[1] Die Verbindung ist nicht kommerziell verfügbar und muss vor der Anwendung hergestellt werden.[2]
Eigenschaften
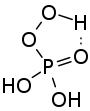
Peroxomonophosphorsäure ist eine farblose, viskose Flüssigkeit. Es erfolgt eine Stabilisierung über eine intramolekulare Wasserstoffbrückenbildung.[2] Die Verbindung stellt eine dreibasige Säure dar. Die drei Säurekonstanten betragen pKS1 = 1,1, pKS2 = 5,5 und pKS3 = 12,8.[8][1] In wässriger Lösung erfolgt eine langsame Hydrolyse zu Wasserstoffperoxid und Phosphorsäure.[8]
Im Überschuss von Wasser kann die Hydrolyse als Reaktion pseudoerster Ordnung betrachtet werden. Die Halbwertszeiten der Zersetzung sind abhängig vom pH-Wert und der Temperatur. Sie betragen etwa 31 Stunden bei 35 °C bzw. 2,5 Stunden bei 61 °C.[8] Die Lösung in Acetonitril zersetzt sich ebenfalls langsam. Bei einer Lagerung bei 5 °C erfolgt in 26 Tagen ein 30%iger Abbau.[2] Durch Neutralisation mit Basen wie Kaliumhydroxid können relativ stabile Salze wie das hygroskopische Kaliumdihydrogenperoxomonophosphat KH2PO5 erhalten werden.[1]
Verwendung
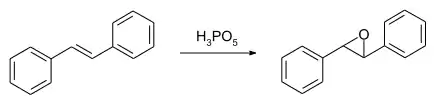
In der organischen Synthese wird die Peroxomonophosphorsäure als elektrophiles Reagenz für Oxidationsreaktionen an Alkenen, Alkinen, Aromaten und Aminen verwendet.[2] Die Herstellung relativ säurestabiler Epoxide kann aus Alkenen erfolgen. So ergibt die Umsetzung mit trans-Stilben das trans-Stilbenoxid. Die Epoxidierung funktioniert nicht mit Alkenen wie Cyclohexen, Styrol oder α-Methylstyrol. Die resultierenden Epoxide werden wegen der Säurestärke der Peroxomonophosphorsäure bzw. der entstehenden Phosphorsäure sofort gespalten. Die Umsetzung mit Styrol ergibt die Phenylessigsäure bzw. mit α-Methylstyrol 2-Phenylpropionsäure.[9]
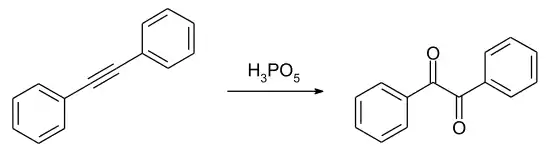
Die Oxidation von Diphenylethin führt bei Raumtemperatur zum Benzil. Hierbei werden Oxirenstrukturen als Intermediate diskutiert.[10]
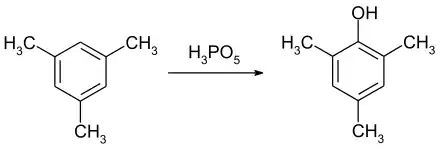
Die Peroxomonophosphorsäure ist ein effektives Reagenz für die Hydroxylierung von Aromaten. Die Umsetzung von Mesitylen zum Mesitol kann schon bei Raumtemperatur innerhalb von 4 Stunden erreicht werden.[11]
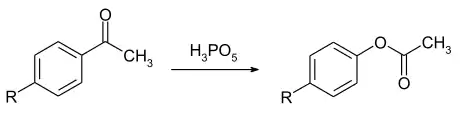
Die Verbindung kann bei Baeyer-Villiger-Oxidationen als wirksames Oxidationsmittel eingesetzt werden. Substituierte Acetophenone können mit hoher Ausbeute bei 30 °C in die entsprechenden Phenylacetate überführt werden. Die Reaktionsgeschwindigkeit ist dabei etwa 100fach höher im Vergleich zum Einsatz von Perbenzoesäure.[12]
Amine wie das N,N-Dimethylanilin werden zu den entsprechenden N-Oxiden oxidiert.[13]
Einzelnachweise
- H. Jakob, S. Leininger, T. Lehmann, S. Jacobi, S. Gutewort: Inorganic Peroxo Compounds. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH Verlag, Weinheim 2007, doi:10.1002/14356007.a19_177.pub2.
- Monoperoxyphosphoric Acid. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. John Wiley and Sons, 1999–2013, abgerufen am 17. September 2015.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Eintrag zu Peroxophosphate. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. September 2015.
- J. Schmidlin, P. Massini: Phosphormonopersäure und Überphosphorsäure. In: Chem. Ber. 43, 1910, S. 1162–1171, doi:10.1002/cber.191004301195.
- G. Toennies: A New Method for the Preparation of Permonophosphoric Acid. In: J. Am. Chem. Soc. 59, 1937, S. 555–557.
- T. Zhu, H. Chang, J. F. Kadla: A new method for the preparation of peroxymonophosphoric acid. In: Can. J. Chem. 81, 2003, S. 156–160, doi:10.1139/v03-010.
- C. J. Battaglia, J. O. Edwards: The Dissociation Constants and the Kinetics of Hydrolysis of Peroxymonophosphoric Acid. In: Inorg. Chem. 4, 1965, S. 552–558, doi:10.1021/ic50026a024.
- Y. Ogata, K. Tomizawa, T. Ikeda: Oxidation of trans-stilbene with peroxymonophosphoric acid. In: J. Org. Chem. 44, 1979, S. 2362–2364, doi:10.1021/jo01328a006.
- Y. Ogata, Y. Sawaki, T. Ohno: Mechanism for oxidation of phenylacetylenes with peroxymonophosphoric acid. Oxirene as an intermediate inconvertible to ketocarbene. In: J. Am. Chem. Soc. 104, 1982, S. 216–219, doi:10.1021/ja00365a039.
- Y. Ogata, Y. Sawaki, K. Tomizawa, T. Ohno: Aromatic hydroxylation with peroxymonophosphoric acid. In: Tetrahedron. 37, 1981, S. 1485–1486, doi:10.1016/S0040-4020(01)92087-3.
- Y. Ogata, K. Tomizawa, T. Ikeda: Kinetics of the Baeyer-Villiger reaction of acetophenones with permonophosphoric acid. In: J. Org. Chem. 43, 1978, S. 2417–2419, doi:10.1021/jo00406a025.
- Y. Ogata, Y. Sawaki, T. Morikawa: Kinetics of the peroxymonophosphoric acid oxidation of aromatic amines. In: J. Org. Chem. 44, 1979, S. 352–355, doi:10.1021/jo01317a009.