Ester
Ester bilden in der Chemie eine Stoffgruppe chemischer Verbindungen, die formal oder de facto durch die Reaktion einer Säure und eines Alkohols oder Phenols unter Abspaltung von Wasser (eine Kondensationsreaktion) entstehen. Es gibt Ester von organischen Säuren (z. B. Carbonsäuren wie Essigsäure, Sulfonsäuren) und solche von anorganischen Säuren (z. B. Phosphorsäure, Schwefelsäure, Borsäure, Kohlensäure).
| Ester |
|---|
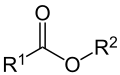 Carbonsäureester |
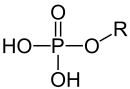 Monoester der Phosphorsäure |
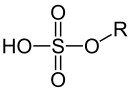 Monoester der Schwefelsäure |
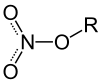 Salpetersäureester |
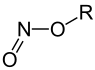 Ester der Salpetrigen Säure |
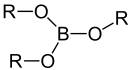 Borsäuretriester |
Die Bezeichnung Ester wurde von dem Chemiker Leopold Gmelin im Jahre 1850 aus dem Begriff „Essigäther“, einem historischen Namen für Ethylacetat, gebildet. Die Dämpfe von Ethylacetat wirken betäubend, ähnlich denen von „Äther“ (Diethylether), daher der Begriff „Essigäther“.
Die Herstellung von Estern wird als Veresterung oder Esterbildung bezeichnet.
Carbonsäureester
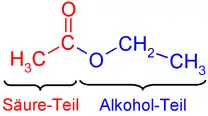
Carbonsäureester sind Ester der Carbonsäuren mit der funktionellen Gruppe –COOR. Sie setzen sich aus einem Säureteil und einem Alkoholteil zusammen.
Carbonsäureester bilden eine in der Organischen Chemie und in der Natur (Fruchtester, Fette, Öle) häufig anzutreffende Stoffgruppe.
Biologisch bedeutende Ester sind die Triglyceride (auch „Glycerol-Triester“, seltener veraltet „Neutralfette“). Diese natürlichen Öle (flüssiger Aggregatzustand) oder Fette (fest) sind fast alle schlecht wasserlöslich, obwohl sie polar sind, denn sie besitzen (bis auf wenige Ausnahmen) drei hydrophobe Alkylgruppen. Je langkettiger die Alkylgruppen sind, desto schlechter ist die Löslichkeit des Triesters in Wasser.
Phosphorsäureester
Phosphorsäureester sind Ester der ortho-Phosphorsäure, die formal oder tatsächlich durch die Reaktion der Säure mit einem Alkohol unter Abspaltung von Wasser entstehen. Nukleinsäuren sind (als Teil ihrer Struktur) Ester der Phosphorsäure mit der Alkoholfunktion von Zuckern (z. B. Ribose oder Desoxyribose). In der Struktur unterscheidet man zwischen Monoester, Diester und Triester der ortho-Phosphorsäure. Unter den Estern der Phosphorsäure und ihren Derivaten sind Verbindungen als potente Insektizide bekannt (z. B. E605). Unter den Derivaten finden sich auch hochtoxische Verbindungen, wie beispielsweise die chemischen Kampfstoffe Sarin, Tabun und Soman.
Schwefelsäureester
Schwefelsäureester oder Alkylsulfate sind Ester der Schwefelsäure. Sie sind in der Natur breit vertreten. (Beispiele: Carrageen, Heparin oder die sogenannten Sulfatide als Bestandteile der Hirnsubstanz). Salze von langkettigen Monoalkylschwefelsäureestern, häufig bezeichnet als Fettalkoholsulfate, finden Verwendung in kosmetischen Produkten als anionische Tenside (Beispiel: Natriumlaurylsulfat).
Dimethylsulfat und Diethylsulfat sind Dialkylester der Schwefelsäure und werden als kraftvolle Reagenzien in der Chemie verwendet, um Methyl- oder Ethylgruppen auf andere Moleküle zu übertragen. Diese Dialkylester der Schwefelsäure sind wegen ihrer alkylierenden Wirkung giftig und karzinogen.
Salpetersäureester
Salpetersäureester sind Ester der Salpetersäure. Die darin enthaltene Nitrogruppe (NO2) ist mesomeriestabilisiert.
Besondere Ester
Es gibt Ester von Säuren, die als freie Säuren instabil sind und nur als Derivate existieren können (z. B. Orthokohlensäureester oder Carbamidsäureester). Auf der anderen Seite kommt es auch vor, dass die Alkoholkomponente eines Esters als freie Verbindung nicht existiert, da sie sich umlagern würde, und nur durch die Esterverbindung mit einer Säure stabilisiert wird (z. B. Vinylacetat).
Beispiele für Ester einiger weiterer Säuren
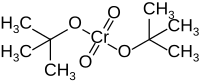
- Sulfonsäureester, die sogenannten Sulfonate
- Nitroglycerin (Sprengstoff und Arzneistoff, chemisch korrekte Bezeichnung ist Glyceroltrinitrat)
- Ester der Salpetrigen Säure lassen sich mittels der Chrétien-Longi-Reaktion herstellen.
- Borsäuretrimethylester (Nachweis von Bor durch grüne Flammenfärbung)
- Kieselsäureester
- Kohlensäurediethylester
- Milchsäureester
- Triphosgen (Synthon für Phosgen)
- Chromsäureester
Verwendung und Vorkommen
Im Folgenden sind nur beispielhafte Fälle genannt, da die Estergruppe in einer Vielzahl von Molekülen vorkommt.
- Fette und fette Öle (Ester von Glycerin und Fettsäuren, z. B. Triglyceride) sind wichtiger Nahrungsbestandteil und Energiespeicherstoff für die meisten tierischen Organismen.
- Monoglyceride (Ester aus äquimolaren Mengen Glycerin und einer Fettsäure) sind Emulgatoren in der Lebensmittelherstellung,
- Biodiesel ist ein Methylester von Fettsäuren.
- Bienenwachs besteht hauptsächlich aus Estern des Myricylalkohols (C30H61OH), z. B. Palmitinsäuremyricylester (C15H31–COO–C30H61).
- Zahlreiche Ester werden als Aromastoffe verwendet, einige bezeichnet man daher auch als Fruchtester.[1] So riecht z. B. Essigsäure-2-butylester [CH3–COO–CH(CH3)C2H5] nach Apfel, Ethansäure-2-methyl-1-propylester [CH3–COO–CH2CH(CH3)2] (Trivialname Essigsäureisobutylester) nach Banane, Ethansäure-2-hexylester [CH3–COO–CH(CH3)(C4H9)] nach Erdbeere.

- Aus dem Celluloseester Cellulosenitrat stellt man rauchloses Treibladungspulver (Schießpulver) her sowie den Kunststoff Celluloid, der heute noch zur Fabrikation von Tischtennisbällen dient.
- Polyester finden Verwendung als Kunststoffe, die sowohl als Werkstoff, wie beispielsweise PET (PolyEthylenTerephthalat), das zur Herstellung von Lebensmittelverpackungen und Getränkeflaschen benutzt wird, als auch in Textilien Anwendung finden.[2]
- Ester finden aber auch in Weichmachern Verwendung.[3] Beispiele hierfür wären Ester der Alkylsulfonsäure Mesamoll und der Phthalsäureester Diethylhexylphthalat (DEHP) als Weichmacher für PVC.
- Arzneistoffe werden häufig verestert, um diese lipophiler zu machen, damit diese leichter Barrieren wie die Blut-Hirn-Schranke passieren können. Durch Metabolisierung entsteht aus diesem Prodrug dann die Wirkform. Ein Beispiel ist das Heroin, welches durch doppelte Acetylierung besser als die Wirkform Morphin in das zentrale Nervensystem und damit an die Opioidrezeptoren gelangt. Auch saure Arzneistoffe wie z. B. ACE-Hemmer werden häufig verestert. Auch Salicylsäure wird zu Acetylsalicylsäure (zur Behandlung von Schmerzen, Entzündungen und Fieber) verestert, um die Substanz magenfreundlicher zu machen. Amylnitrit ((CH3)2CH–CH2–CH2–O–N=O) oder Glyceroltrinitrat wirken, wie auch andere Alkylnitrite und -nitrate, durch Freisetzung von Stickstoffmonoxid relaxierend auf die glatte Gefäßmuskulatur und werden teilweise bis heute zur Behandlung akuter Angina-pectoris-Anfälle oder intensivmedizinisch zur Senkung des Blutdrucks verwendet.
- Ester werden als Insektizide und Chemische Waffen verwendet, z. B. Phosphorsäureester. Zu Ersteren gehören Parathion und Dichlorvos zu zweiteren zählen Sarin (Methylfluorphosphonsäureisopropylester), Soman (Methylfluorophosphonsäure-1,2,2-trimethylpropylester) und Tabun (Dimethylphosphoramidocyanidsäureethylester).
- Schwefelsäureester, genauer Fettalkoholsulfate, wie z. B. Natriumlaurylsulfat, werden als Tenside in Kosmetika verwendet.
- Glycerintrinitrat (auch Nitroglycerin, O2NO–CH2–CH(ONO2)–CH2–ONO2) wird als Sprengstoff und als Arzneistoff verwendet.
- Phorbolester sind im Saft von Wolfsmilchgewächsen enthalten und können neben ausgeprägten Hautverätzungen und Gastroenteritiden auch maligne Tumoren auslösen. Die karzinogene, also krebsfördernde Wirkung scheint durch Stimulation der Proteinkinase C zustande zu kommen, die das Wachstumsverhalten der Krebszellen modifiziert.
Carbonsäureester – Vorkommen in Früchten (Auswahl) als geruchs- und geschmacksgebende Komponente
 Bananen
Bananen Äpfel
Äpfel Birnen
Birnen Erdbeeren
Erdbeeren Orangen
Orangen Kirschen
Kirschen Schwarze Johannisbeeren
Schwarze Johannisbeeren Zitronen
Zitronen Melonen
Melonen.jpg.webp) Himbeeren
Himbeeren Pfirsich
Pfirsich
Weblinks
Einzelnachweise
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 85–86, ISBN 978-3-8348-1245-2.
- M. D. Lechner, K. Gehrke und E. H. Nordmeier: Makromolekulare Chemie. 4. Auflage. Birkhäuser, Basel/Boston/Berlin 2010, ISBN 978-3-7643-8890-4, S. 126–130.
- Fritz Röthemeyer, Franz Sommer: Kautschuktechnologie. 2. Auflage. Hanser, München/Wien 2006, ISBN 978-3-446-40480-9, S. 335–337.