Phosphorsäureester
Phosphorsäureester (auch Alkylphosphate) sind Ester der Orthophosphorsäure, die formal oder tatsächlich durch die Reaktion der Säure und Alkoholen unter Abspaltung von Wasser entstehen. Sie können als organische Phosphate/Organophosphate bezeichnet werden, gehören aber nicht zur Gruppe der Organophosphorverbindungen, da keine Kohlenstoff-Phosphorbindung vorliegt.
Struktur
Man unterscheidet zwischen Monoester, Diester und Triester:
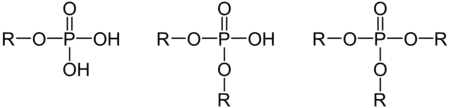
Die einfachsten davon sind jeweils Monomethylphosphat, Dimethylphosphat und Trimethylphosphat.[1]
Phosphorsäureester unterscheiden sich von den Estern der Diphosphorsäuren und Triphosphorsäuren (siehe Pentanatriumtriphosphat), die beide Monoester sind.
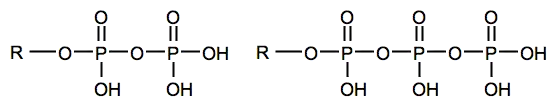
Im Organismus sind Phosphorsäureester lebenswichtig, da sie als Zwischenprodukte zahlreicher Stoffwechselprozesse praktisch an allen biologischen Vorgängen beteiligt sind (siehe z. B. Adenosintriphosphat). Von den Phosphorsäureestern zu unterscheiden sind die ebenfalls zu den Organophosphorverbindungen zählenden, zum Teil hochgiftigen, Thiophosphorsäure- und Dithiophosphorsäureester.
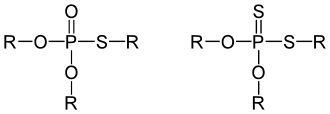
Bedeutung in der Biochemie
Phosphate bzw. Phosphatreste spielen eine wichtige Rolle in der Biochemie lebender Organismen. Sie sind beteiligt am Aufbau biologisch wichtiger Moleküle, etwa der Desoxyribonukleinsäure (DNA). Im Phosphordiester/Phosphortriester-System von Adenosindiphosphat (ADP) und Adenosintriphosphat (ATP) wird ADP durch Übertragung einer Phosphatgruppe „energetisch aufgeladen“ (ADP + Pi + Energie ⇒ ATP), und ATP kann durch Abspaltung einer Phosphatgruppe – an anderer Stelle in der Zelle – wieder Energie abgeben (ATP ⇒ ADP + Pi + Energie). Wichtig in der Biochemie ist auch die Phosphorylierung, d. h., die selektive Übertragung von Phosphat auf Proteine. Kovalent an Proteine gebundenes Phosphat wirkt als molekularer Schalter und ermöglicht Regulation von metabolischen Vorgängen. Übertragen werden sie hier von der großen Klasse der Proteinkinasen, wieder abgespalten von Proteinphosphatasen.
Weitere Beispiele:
Verwendung (allgemein)
Phosphorsäureester dienen in Kunststoffen und Lacken als Weichmacher, Flammschutzmittel, Härter, als Beiz- und Haftmittel beim Aufbringen von Farben und Lacken, in der Metalloberflächenbehandlung als reinigende, korrosionshemmende und haftvermittelnde Substanzen, als Hilfsmittel für Textilien und Papier, als Putz- und Reinigungsmittel, Hydraulik-Flüssigkeit (Skydrol), Öl- und Treibstoffadditive.
Verwendung als Pestizide und chemische Kampfstoffe
Organophosphorverbindungen und Phosphorsäureester sind die umfangreichste und vielfältigste Gruppe von Wirkstoffen gegen Insekten (Insektizide) und Milben (Akarizide). Beispiele von Insektiziden dieser Substanzklasse sind Phoxim, Dichlorvos (DDVP), Fenthion, Chlorpyrifos, Parathion (E 605) und seine Methyl- und Ethyl-Derivate, sowie Tetraethylpyrophosphat (Bladan).
Geschichte
Die Entwicklung dieser Verbindungsklasse begann Anfang 1900 durch August Michaelis und Alexander Arbusow, welche die Begründer der klassischen Phosphorchemie sind. Die biologische Wirkung der organischen Phosphorsäureester wurde jedoch erst Mitte der 1930er-Jahre von Gerhard Schrader erkannt, der bei der Suche nach Akariziden und Insektiziden die Kampfstoffe Tabun (1936) und Sarin (1939) synthetisierte. Später wurden die Nervenkampfstoffe Soman und VX entwickelt.
Eigenschaften
- leicht hydrolysierbar (durch Wasser spaltbar) und auch leicht enzymatisch und abiotisch abbaubar
- teilweise sehr gut fettlöslich (lipophil)
- hohe Toxizität und damit verbunden geringe Aufwandmenge
- große Variabilität der Verbindungen, d. h., es sind viele verschiedene Verbindungen möglich, so dass die Entstehung von Resistenzen vermindert wird.
Giftwirkung
Die Giftwirkung beim Menschen beruht auf einer Hemmung des esteratischen Zentrums (irreversibel) der Acetylcholinesterase und führt damit zunächst zu einer Acetylcholin-Überflutung mit muscarin- und nicotinartigen Symptomen (s. dazu auch Acetylcholinrezeptoren und cholinerge Krise). Im Folgenden kommt es durch die ständigen Nervenimpulse zu Verkrampfungen und anschließend Tod durch Atemstillstand. Die Toxizität der einzelnen Verbindungen ist allerdings sehr unterschiedlich. Weitere Symptome sind verlangsamter Herzschlag, verengte Pupillen, erhöhter Speichelfluss und Atemnot, ebenso wie Übelkeit, Durchfall und Urininkontinenz. Zur Antagonisierung wird in der Notfallmedizin Atropin und Obidoximchlorid verabreicht.
Darstellung und Gewinnung
Industriell werden Phosphorsäureester durch die Umsetzung von Ethern und Alkoholen mit Phosphorpentoxid hergestellt. Die Umsetzung mit Ethern führt zu den Triestern.[2]
Mit Alkoholen werden Mono- und Diester gebildet.[2]
Literatur
- Irmo Stark: Insektizide und Nervengase: Vergiftung und Therapie, Chemie in unserer Zeit, 18. Jahrg. 1984, Nr. 3, S. 96–106, doi:10.1002/ciuz.19840180304.
Einzelnachweise
- Ronald A. Hites, Jonathan D. Raff: Umweltchemie Eine Einführung mit Aufgaben und Lösungen. John Wiley & Sons, 2017, ISBN 978-3-527-67297-4, S. 224 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ralf Steudel: Chemie der Nichtmetalle, Synthesen – Strukturen – Bindung – Verwendung, 4. Auflage, 2014 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-030439-8, S. 408–409, doi:10.1515/9783110307979.377.