Ammoniummagnesiumphosphat
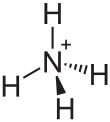
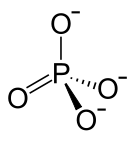
Ammoniummagnesiumphosphat ist ein Salz aus Ammonium- und Magnesiumkationen und Phosphatanionen mit der Formel (NH4MgPO4 · x H2O). Es wird auch als Tripelphosphat bezeichnet.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
  | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ammoniummagnesiumphosphat | ||||||||||||||||||
| Summenformel | NH4MgPO4 | ||||||||||||||||||
| Kurzbeschreibung |
weiße Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 137,32 g·mol−1 (wasserfrei) | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
Die Verbindung kommt als Mineral Struvit beispielsweise in Guano vor und stammt oft aus menschlichen oder tierischen Abfallstoffen. Die Verbindung findet sich im Urinsediment. Des Weiteren kann sich Ammoniummagnesiumphosphat bei der Biogasproduktion in Trockenfermentations-Anlagen bilden.
Eigenschaften

Ammoniummagnesiumphosphat bildet farblose, in Wasser unlösliche, aber säurelösliche, stark lichtbrechende Kristalle, die in der Sargdeckel- oder sehr selten auch in Farnkrautform auftreten.[3]
Verwendung
Ammoniummagnesiumphosphat bildet sich bei der Nachweisreaktion von Magnesiumionen (Mg2+) mit Diammoniumhydrogenphosphat.[4]
Einzelnachweise
- Datenblatt Ammonium magnesium phosphate hydrate bei AlfaAesar, abgerufen am 7. Dezember 2019 (PDF) (JavaScript erforderlich).
- Phillip Barak and Alysa Stafford: STRUVITE: A RECOVERED AND RECYCLED PHOSPHORUS FERTILIZER (Memento vom 20. Juni 2010 im Internet Archive), abgerufen am 2. April 2014
- Giovanni B. Fogazzi et al.: Urinalysis: Core Curriculum 2008. In: American Journal of Kidney Diseases. Vol. 51, Issue 6, 2008, S. 1052–1067, doi:10.1053/j.ajkd.2007.11.039.
- E. Schweda: Jander/Blasius: Anorganische Chemie I – Einführung & Qualitative Analyse. 17. Auflage. Hirzel, 2012, ISBN 978-3-7776-2134-0, S. 301.
