Zahnkaries
Die Zahnkaries (von lateinisch caries ‚Morschheit‘, ‚Fäulnis‘) oder kurz Karies ist eine multifaktoriell bedingte destruierende Erkrankung der Zahnhartgewebe, Zahnschmelz und Dentin. Sie entsteht unter Beteiligung von Mikroorganismen und geht von einer durch Säureeinwirkung „entkalkten“ Zahnoberfläche aus. Weitere Bezeichnungen sind auch Zahnfäule oder Zahnfäulnis (lateinischer Fachausdruck: Caries dentium).
| Klassifikation nach ICD-10 | |
|---|---|
| K02.- | Zahnkaries |
| ICD-10 online (WHO-Version 2019) | |
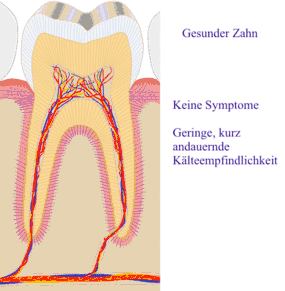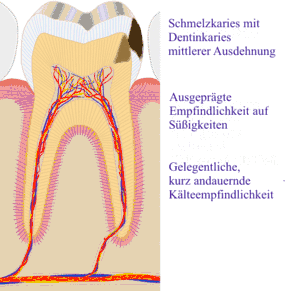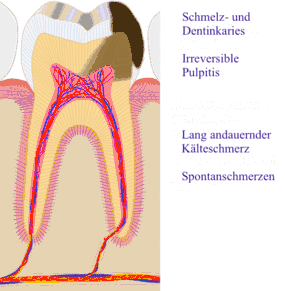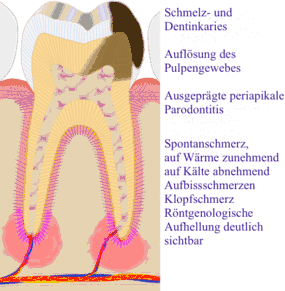
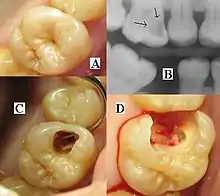
B) Röntgenologische Diagnostik
C) Eröffnung der Kavität
D) Caries profunda mit Eröffnung der Pulpa
Ätiologie
Es gibt mehrere Theorien zur Entstehung von Karies. Ausgangspunkt moderner Kariestheorien war die chemoparasitäre Theorie nach Willoughby D. Miller (1890), wonach Lactobazillen (im Zusammenwirken mit Kohlenhydraten und Speichel) bis in die 1960er Jahre als Ursache angesehen wurden.[1] In der Folge entwickelte sich die spezifische Plaquehypothese, gefolgt von einem Paradigmenwechsel, der zur ökologischen Plaquehypothese geführt hat.[2] Demnach kommt es auf Grund mehrerer pathogener Faktoren zur Zerstörung der Zahnhartgewebe in mehreren Stufen.
Karies wird durch eine Störung der Homöostase der oralen Mikroflora, nämlich durch eine selektive Begünstigung potenziell pathogener Mikroorganismen, wie des Streptococcus mutans, und durch eine zuckerreiche Ernährung verursacht. Es handelt sich demnach nicht um eine exogene Infektion, die zur Erkrankung führt. Die Bakterien sind auch bei Gesunden ein Teil der physiologischen endogenen Flora, die durch die Veränderung bestimmter Faktoren pathologisch werden kann. In seltenen Fällen ist Streptococcus mutans, einer der wichtigsten kariesfördernden Erreger, nicht Teil der Mundflora oder nur sehr schwach vertreten, wodurch die Wahrscheinlichkeit der Erkrankung geringer ist.[3] Wenn eine azidogene und azidurische Spezies begünstigt wird und deren metabolische Aktivität durch häufigen Zuckerkonsum organische Säuren bildet, führt dies wiederum zu einer Begünstigung der Demineralisation der Zahnhartsubstanzen und damit zur Karies.[4]
Die Mundhöhle eines Ungeborenen ist zunächst steril, bereits bei der Geburt erfolgt der erste Kontakt mit vaginalen und fäkalen Mikroorganismen. Innerhalb kurzer Zeit entwickelt sich eine natürliche Bakterienflora ähnlich der Erwachsener. Die Übertragung der kariogenen Erreger erfolgt durch Speichelkontakt. Die Kolonisierung mit dem bedeutendsten kariogenen Keim S. mutans erfolgt in manchen Fällen erst nach Durchbruch der Milchzähne.[5] Die häufigste Übertragung erfolgt über den Milchflaschensauger zwischen Mutter und Kind (Löffel oder Schnuller abschlecken, Vorkosten, Temperaturprüfung der Milch), aber auch durch andere Übertragungswege wie Küssen, gemeinsames Benutzen von Geschirr, Husten.[6]
Es gibt seltene vererbte Krankheitsbilder. Beispielsweise die Amelogenesis imperfecta, eine angeborene Störung der Zahnschmelzbildung, die mit einer erhöhten Kariesanfälligkeit einhergeht.
Biologische Grundlagen
Die Zähne sind von einem Biofilm (Plaque) umgeben, der zahlreiche Mikroorganismen enthält. Einige davon können niedermolekulare Kohlenhydrate aus der Nahrung zu organischen Säuren verstoffwechseln und zu einer Senkung des pH-Wertes führen. Sinkt der pH-Wert am Zahn unter einen kritischen pH-Wert (5,2–5,7 für Zahnschmelz bzw. 6,2–6,7 für Zahnzement und Wurzeldentin), können Mineralien wie Kalziumphosphate aus den Zahnhartsubstanzen herausgelöst werden; der Zahn wird demineralisiert.[7] Wird dieser Prozess nicht gestoppt oder umgekehrt, führt die Entmineralisierung des Schmelzes zur Bildung einer kariösen Läsion. Karies ist das Ergebnis einer ökologischen Veränderung des Biofilms. Sie kann somit als Verschiebung des dynamischen Gleichgewichtes zwischen den in der Zahnhartsubstanz gebundenen Mineralsalzen und denjenigen, die im Biofilm beziehungsweise im Speichel gelöst sind, definiert werden.[8]
An Karies kann man erkranken, wenn vier Hauptfaktoren[9] zusammenwirken:
- Krankheitsanfälligkeit des Zahnes
- Plaque mit kariogenen Bakterien
- niedermolekulare Kohlenhydrate (besonders in Zucker und gezuckerten Speisen enthalten)
- genügend Zeit
Neben diesen Hauptfaktoren gibt es diverse Nebenfaktoren: Zahnstellung, Zahnfehlbildungen, Speichelfluss und -zusammensetzung, genetische Faktoren und die Zusammensetzung der Nahrung.
In der Plaque siedeln sich Laktobazillen und verschiedene Streptokokkenarten an. Herausragend ist S. mutans. Zucker aus der Nahrung wird von diesen Bakterien zu Milchsäure abgebaut. Nur Mikroorganismen, die diesen Stoffwechselprozess beherrschen (azidogene Mikroorganismen) und in stark saurem Milieu überleben können (azidurische Mikroorganismen), vermehren sich dann weiter. Zahnbeläge von Personen, die viel und häufig Zucker konsumieren, haben deshalb eine andere Mikrobiota.
Neuere Forschung hat ergeben, dass ein Zusammenspiel des S. mutans mit dem Pilz Candida albicans existiert, wodurch das Bakterium seine Virulenz verändert. Der Pilz produziert Signalmoleküle, die Gene des Bakteriums zur Produktion zelleigener Antibiotika anregen. Ferner kann das Bakterium durch den Pilz fremdes Erbgut aufnehmen. Auch die Produktion klebriger Substanzen, einer wichtigen Voraussetzung für die Haftung des S. mutans auf dem Zahn, wird durch den Pilz unterstützt.[10]
Wurde die Säureeinwirkung nicht mikrobiell, sondern etwa durch Zufuhr von Fruchtsäuren verursacht, so wirkt dies ebenfalls zahnschädigend, hat aber eher das Krankheitsbild der Zahnerosion zur Folge.
Stadien
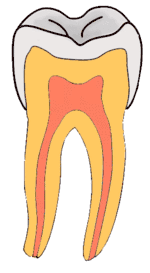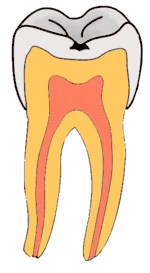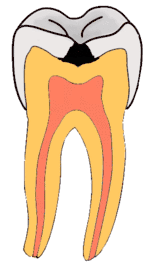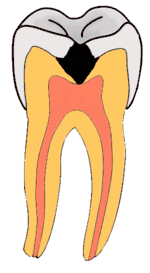
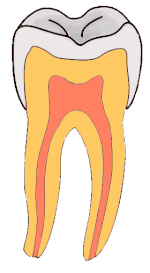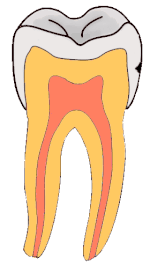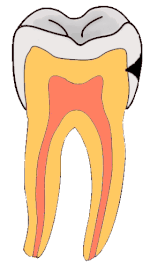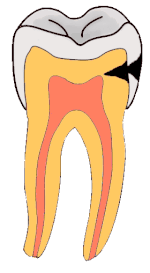
Stadien der Karies reichen von der Initialkaries über die Dentinkaries bis zur Caries penetrans. Sie werden mittels spezieller Sonden diagnostiziert.
Initialkaries
Als Kariesvorstufe (Initialkaries) bilden sich zuerst Entkalkungen. Diese sind makroskopisch als weiße Flecken (englisch white spot, lat. macula alba) erkennbar. Durch Einlagerungen von Farbpigmenten aus der Nahrung werden diese Flecken oft dunkel (lat. macula fusca).
Karies, welche sich nur auf den Schmelz begrenzt, muss nicht in jedem Fall behandelt werden. Solange die Schmelz-Schicht nur angegriffen, aber insgesamt noch intakt ist, kann durch geeignete Fluoridierungsmaßnahmen und eine Änderung der Ernährung (nach Ernährungsberatung) die Läsion remineralisiert werden, dabei werden die Hydroxidionen im Apatit durch das Fluorid zu Fluorapatit ersetzt.
Wird eine Karies im Anfangsstadium, d. h. solange nur der Zahnschmelz (Caries superficialis) befallen ist, nicht remineralisiert, dringt sie in das Dentin (Zahnbein) vor. Bereits diese Dentinkaries (Caries media) kann zu Zahnschmerzen führen.
Da Dentin wesentlich weicher als Zahnschmelz ist, breitet sich die Karies unterhalb der Schmelz-Dentin-Grenze in die Breite aus. Der so unterminierte Zahnschmelz an den Rändern des kariösen Defektes bricht nach gewisser Zeit beim Kauen ein. Die Karies wird da oft erstmals wahrgenommen, obwohl sie schon seit längerer Zeit existiert.
Als Approximalkaries bezeichnet man eine Karies, die an den Kontaktstellen nebeneinander stehender Zähne, demnach im Zahnzwischenraum, entsteht.
Caries profunda
Bei der Caries profunda (lat. tiefe Zahnkaries) ist die Kariesläsion bis über 2/3 der Dentinschicht in Richtung der Pulpa vorgedrungen. Die Läsion besteht dann
- aus der Destruktionsschicht, in der Bakterien nicht nur Mineral aufgelöst, sondern auch die Proteinmatrix zersetzt haben,
- der Zone der bakteriellen Penetration, in der Bakterien in die Dentinkanälchen eingedrungen sind,
- der Demineralisationszone (Mineralverlust durch Säureeinwirkung)
- und der Transparenzzone. In dieser haben die Odontoblasten mehr Mineral in den Dentinkanälchen abgelagert, um den Fortschritt der Karies zu verzögern. Im mikroskopischen Dünnschliff erscheint diese Schicht durchsichtig, da die optischen Grenzflächen (mineralisiertes Dentin und Kanalinhalt) wegen der Mineralablagerung verschwunden sind.
Caries penetrans
Bei der Caries penetrans (durchdringende Zahnfäule) hat der Defekt durch das Dentin hindurch die Pulpa (im Volksmund: „Zahnnerv“) erreicht, so dass eine Verbindung zwischen Mundhöhle und Pulpencavum (Hohlraum, in dem sich die Pulpa befindet) entstanden ist.
Diagnose
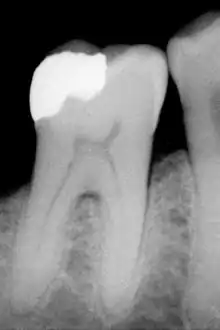
Die Präsentierung von Karies ist sehr variabel, allerdings sind die Risikofaktoren und Stadien der meisten Erscheinungsbilder identisch. Je nach Lokalisation ist die Karies entweder direkt sichtbar, oder kann erst durch diagnostische Werkzeuge (Röntgen, Sonden, Laser) sichtbar gemacht werden.[11] Die primäre Diagnosestellung beim Zahnarzt erfolgt in erster Linie durch Inspektion mit einer starken Lichtquelle, einem zahnärztlichen Spiegel und einer Sonde in Kombination mit Druckluft. Die Ergebnisse der Inspektion werden mit Röntgenbildern verglichen, die Karies in den nicht-zugänglichen Bereichen der Zähne (Fissuren, Kontaktpunkte zwischen den Zähnen) sichtbar machen können. Hierzu werden Bissflügelaufnahmen angefertigt.[12] Der Einsatz von Sonden zur Kariesdiagnose, insbesondere solcher mit spitzen Enden, wird in der Fachliteratur kontrovers diskutiert.[13] Karies im frühen Stadium kann durch den Einsatz von Fluoriden gestoppt werden, solange sich noch keine Kavität gebildet hat. Solche Bereiche könnten durch spitze Sonden einbrechen, wodurch die erkrankte Stelle nicht mehr allein durch Fluoridierung remineralisiert werden kann.[14]
Verbreitung
Zahnkaries gilt als die am weitesten verbreitete Krankheit beim Menschen.[15] In Deutschland ist nur etwa ein Prozent der Erwachsenen kariesfrei.[16] Die Vierte Deutsche Mundgesundheitsstudie (DMS IV; 2010) ergab, dass 70,1 % der Kinder (12 Jahre) und 46,1 % der Jugendlichen (15 Jahre) ein Gebiss ohne Karieserfahrung haben.[17] Vergleichbar mit anderen Ländern, sinkt das Vorkommen von Karies mit der Zugehörigkeit zu einer höheren sozialen Schicht.[18]
Für Karies sind in erster Linie die Ernährung (insbesondere Zucker) und mangelnde Zahnpflege verantwortlich, die genetische Ausprägung eines Menschen hat hingegen keinen wesentlichen Einfluss. Auch wenn die Zusammensetzung des menschlichen oralen Mikrobioms durch den genetischen Hintergrund beeinflusst wird, sind potenziell kariogene Bakterienstämme von genetischen Faktoren unabhängig. Der Zusammenhang zwischen menschlichem oralen Mikrobiom und genetischem Hintergrund einer Person nimmt weiterhin mit dem Alter ab.[19][20]
Auf einem Symposium im Vorfeld des Kongresses der Europäischen Arbeitsgemeinschaft für Kariesforschung (ORCA) wurde festgestellt, dass Verbesserungen in der Mundgesundheit und eine Reduzierung der Ungleichheiten in der Mundgesundheit durch eine sektoren- und disziplinübergreifende Zusammenarbeit erreicht wird sowie über Strategien, die sich auf die vorgelagerten, zugrunde liegenden Determinanten von Munderkrankungen konzentrieren.[21]
Karies nach Strahlentherapie
Erkranken Patienten an malignen Tumoren im Kopf-Hals-Bereich, so kommt in etwa 50 Prozent der Fälle ionisierende Strahlung zur Tumorelimination zum Einsatz (Strahlentherapie). Obwohl die heute übliche fraktionierte Bestrahlung die Folgen einer Strahlentherapie auf die Speicheldrüsen etwas einschränkt, gibt es bisher keine zuverlässige Methode, die Strahlung so zu beherrschen, dass Nebenwirkungen vollkommen ausgeschlossen werden können. Betroffen sind Haut und Schleimhaut, Muskulatur, Speicheldrüsen, Knochen und Zähne. Eine Schädigung der Speicheldrüsen führt zu Mundtrockenheit, auch radiogene Xerostomie genannt, in deren Folge eine oft sehr schmerzhafte Entzündung der Mundschleimhaut (Mukositis) auftreten kann. Das Risiko einer sogenannten Strahlenkaries steigt bei diesen Patienten durch den Wegfall der neutralisierenden und remineralisierenden Wirkung des Speichels extrem an.
Um das Risiko einer Strahlenkaries zu verringern, sollte vor Beginn der Radiotherapie eine vollständige Sanierung des Gebisses erfolgen. Außerdem sollten bereits in dieser Phase die Zahnpflege und die Kooperationsbereitschaft des Patienten durch umfangreiche und wiederholte Mundhygieneinstruktionen verbessert werden. Während der Bestrahlungsphase muss täglich eine professionelle Mundreinigung durchgeführt werden.[22] Zur Verminderung von Strahlenschäden an den Mundschleimhäuten können Strahlenschutzschienen eingesetzt werden. Doch Mundhygienemaßnahmen alleine können das Auftreten der Strahlenkaries nicht verhindern. Speichelersatzmittel sind als ein wertvolles Mittel gegen die Mundtrockenheit anzusehen, haben aber keine kariesprophylaktische Wirkung. Sie können sogar Schäden an der Zahnhartsubstanz hervorrufen, da sie zum Teil einen niedrigen pH-Wert haben und damit erosiv wirken. Die regelmäßige lokale Fluoridierung während und nach der Bestrahlung ist eine zentrale Begleittherapie für Kopf-Hals-bestrahlte Patienten.
Folgen und Komplikationen
Da die Kariesläsion sich der Pulpa nähert, können bakterielle Endotoxine zur Entzündung der Pulpa führen. Der Patient nimmt das durch erhöhte Kälte- und Wärmeempfindlichkeit wahr, da die Endotoxine die Reizschwelle der Nervenfasern herabsetzen. In diesem Stadium kann durch eine zahnärztliche Behandlung die Entzündung rückgängig gemacht werden (Entfernen der Karies, Anbringen einer bakterienhemmenden Unterfüllung (auf der Basis von Ca(OH)2) und einer dichten Restauration). Wird der Entzündungsvorgang nicht unterbrochen, kann die Pulpa unwiderruflich angegriffen werden (irreversible Pulpitis), es kommt zu spontanen, zum Teil heftigen Schmerzen einer odontogenen Infektion. Erreichen die Bakterien die Pulpa, entstehen lokale Abszesse, und die Pulpa stirbt ab (Pulpengangrän). In diesem Fall hilft nur noch eine Wurzelkanalbehandlung oder, wenn der Zahn nicht mehr restauriert werden kann, die Extraktion.
Bildet sich an bereits behandelten (gefüllten) Stellen erneut Karies, so spricht man vom Kariesrezidiv oder der Sekundärkaries. Bei der Sekundärkaries handelt es sich um eine kariöse Erkrankung durch jegliche restaurative Maßnahme, beispielsweise an einem überstehenden, unpolierten oder schadhaften Füllungs- oder Kronenrand.
Vorbeugung
Ernährungsweise und Neutralisierung von Säuren
Die beste Möglichkeit, Karies vorzubeugen, ist eine Beschränkung der Zuckeraufnahme. Dadurch wird die Veränderung der Mundflora in Richtung einer kariogenen Plaque verhindert. Die American Dental Association (US-amerikanische Zahnärztliche Vereinigung)[23] und die Europäische Kinderzahnärztliche Akademie[24] empfehlen, den Konsum zuckerhaltiger Getränke einzuschränken sowie Säuglingen und Kleinkindern keine zuckerhaltigen Flüssigkeiten zum Einschlafen zu geben.
Von großer Wichtigkeit für die Zahngesundheit sind ausreichende Pausen zwischen den Mahlzeiten (oder dem Trinken zuckerhaltiger Getränke), in denen der Speichel die Säuren neutralisieren und die angegriffene Zahnsubstanz remineralisieren kann. Es kommt also nicht so sehr auf die Menge des konsumierten Zuckers an, sondern vor allem auf die Häufigkeit und Dauer des Zuckerkonsums. Eine über den Tag verteilte Dosis eines zuckerhaltigen Erfrischungsgetränkes erhöht das Kariesrisiko beträchtlich, da dadurch dem Zahnschmelz die Regenerationsphasen genommen werden. Nicht nur Zucker, sondern auch Fruchtsäuren stellen eine Gefahr für die Zähne dar, wobei sich dies vor allem als Zahnerosion niederschlägt. Ein ausreichender Speichelfluss ist für die Gesunderhaltung von Zähnen und Mundschleimhäuten unerlässlich. Jede Beeinträchtigung des Speichelflusses bedeutet neben einer Vielzahl von unangenehmen Begleiterscheinungen auch immer eine Erhöhung des Kariesrisikos. Ein gänzliches Versiegen des Speichelflusses kann innerhalb kürzester Zeit zur kariösen Zerstörung der Zähne führen.
Zähneputzen
.jpg.webp)
Eine Möglichkeit, entstandene Plaque zuverlässig zu entfernen, ist die Reinigung der Zähne mit der Zahnbürste und in den Zahnzwischenräumen mit Zahnseide oder, bei größeren Abständen zwischen den Zähnen, mit der Zahnzwischenraumbürste. Mundspülungen, auch Chlorhexidindigluconat, können eine Neubildung der Plaque verzögern, aber nicht verhindern. Eine gründliche Entfernung der Zahnbeläge kann die Demineralisation verhindern. Häufig wird empfohlen, unmittelbar nach den Mahlzeiten nicht die Zähne zu putzen, da der Zahnschmelz bereits angelöst ist und durch das Reinigen leichter abgetragen werden kann. Neueste Untersuchungen deuten allerdings darauf hin, dass ein Abwarten des Zähneputzens nach der Mahlzeit sogar kontraproduktiv sein kann und daher nicht zu empfehlen ist.[25]
Fluoride, Xylit und Polyphenole
Als gute Möglichkeit, die Entstehung von Karies zu verhindern, wird die Prophylaxe mit Fluorid angesehen. Fluorid fördert die Remineralisation, härtet die oberste Schmelzschicht und hemmt das Bakterienwachstum.[26] Das Bundesinstitut für Risikobewertung (BfR) rät nur eine Form der Fluoridprophylaxe anzuwenden.[27] Hierbei sollten Fluoridpräparate abgesetzt werden, sobald mit dem Zähneputzen mit fluoridierter Zahnpasta begonnen wird.
Im Vordergrund steht heutzutage die lokale Verabreichung von Fluoriden zur Kariesprophylaxe und nicht mehr die Gabe von Fluoridtabletten. Letztere sollten nur gelutscht werden, um die lokale Wirkung zu erzeugen.[28] Neben Fluoridpräparaten trägt auch der Zusatz von Fluoriden im Speisesalz zur Aufnahme bei. Die Fachgesellschaften der Kinderärzte wie das DGKJ empfehlen daher für Kinder im Säuglings- und Kleinkindalter eine tägliche Zufuhr eines Fluoridsupplementes, bis eine regelmäßige Fluoridexposition in angemessener Menge durch größere Verzehrsmengen fluoridangereicherten Speisesalzes und durch fluoridierte Zahnpasta erreicht werde.[27]
Unter anderem in Finnland wurde seit den 1970er-Jahren der Einsatz von Xylit systematisch erforscht. Eine mögliche antikariogene Wirkung wird dadurch erklärt, dass die kariogenen S. mutans das Xylit nicht verstoffwechseln können und damit absterben bzw. weniger Säuren produzieren. Weiterhin werden sie auch daran gehindert, als Plaquebakterien an der Zahnoberfläche anzuheften. Das Xylit kann mittels Kaugummi, Lutschpastillen und xylitenthaltende Zahnpasta freigesetzt werden. Eine Metastudie der Cochrane Collaboration aus dem Jahr 2015 hat eine mögliche Verringerung von Karies bei Kindern durch fluorhaltige Zahnpasta mit Xylit (im Vergleich zu nur fluoridhaltiger Zahnpasta) untersucht.[29] Schlussfolgerungen über eine vorbeugende Wirkung seien aufgrund der schlechten Qualität der Belege und methodischer Mängel wenig aussagekräftig.[30] Die Aussagekraft anderer xylithaltiger Produkte ist durch die sehr schlechte Qualität nicht gegeben. Der karieshemmende Nutzen Xylits ist größtenteils unklar, Xylit kann teilweise zu Blähungen und Durchfall führen.[30][31]
Polyphenole aus roten Weintrauben hemmen die Bakterienart S. mutans, die zum Aufbau von Zahnbelägen (Plaque) und sogenannten Biofilmen auf den Zähnen beiträgt. Durch ihre bakterizide Wirkung hemmen Polyphenole die schädlichen Auswirkungen der Bakterien und wirken so auch vorbeugend gegen Zahnkaries.[32]
Mikrobielle Aspekte
Eine Studie der University of Pennsylvania ergab zudem, dass der Hefepilz C. albicans zu einer Förderung der Plaqueproduktion führt und somit das Kariesrisiko erhöht. Versuche mit Ratten zeigten eine Häufung von Zahnschäden durch die Kombination der Hefepilze und Streptokokken.[33]
Eine weitere neuartige Entwicklung ist die Verwendung von speziellen Milchsäurebakterien, zum Beispiel als Hauptbestandteil von Zahnpasta: der Lactobacillus paracasei gegen Karieserreger.[34] Diese sind in der Lage, Kariesbakterien gezielt zu erkennen, an diesen anzudocken und danach leicht zu entfernen.
Zahnarztbesuch
Die Vorsorgeuntersuchung zur frühzeitigen Erkennung von krankhaften Zuständen sollte zweimal im Jahr stattfinden. Die Gruppenprophylaxe betrifft ausgewählte größere Bevölkerungsgruppen (z. B. Untersuchungen von Schulkindern durch Schulzahnärzte), während die Individualprophylaxe sich auf Einzelpersonen bezieht.[35]
Gesetzlich Versicherten in Deutschland bestätigt der Behandler in einem Bonusheft, dass der Patient die regelmäßige Vorsorgeuntersuchung wahrgenommen hat. Patienten, die über 18 Jahre alt sind, müssen in ihrem Bonusheft einmal pro Jahr einen Zahnarztbesuch belegen können. Kinder und Jugendliche bis 18 Jahre sollen zweimal pro Jahr zur Vorsorgeuntersuchung beim Zahnarzt. Ist das Bonusheft fünf Jahre lang lückenlos geführt, erhöht sich der Festzuschuss von 60 auf 70 Prozent der durchschnittlichen Kosten der Regelversorgung. Können Sie die entsprechenden Termine zehn Jahre lückenlos nachweisen, erhöht sich der Zuschuss der Krankenkasse auf 75 Prozent.[36] Gesetzliche Grundlage ist § 22 SGB V.[37]
Impfung
An einer Impfung gegen Karies wird derzeit noch geforscht.
Therapie
Die Entkalkung („macula alba“ [weißer Fleck]) als Vorstufe der Karies lässt sich durch intensive Fluoridierung mit speziellen Fluoridpräparaten remineralisieren und so zum Verschwinden bringen. Oft setzen sich jedoch im Laufe der Zeit in diese Entkalkung dunkle Farbpigmente aus der aufgenommenen Nahrung ab, so dass aus dem „weißen Fleck“ ein „dunkler Fleck“ („macula fusca“) wird. Diese Flecken sind vorzugsweise an den Kontaktpunkten zu den Nachbarzähnen (approximal) zu finden.
Kariesinfiltration
Eine neuartige Behandlungsmethode, die Kariesinfiltration, soll beginnende approximale Karies oder beginnende Flächenkaries ohne „Bohren“ stoppen. Das Prinzip der Kariesinfiltration beruht auf der Penetration eines niedrigviskosen Kunststoffs (Infiltranten) in den Läsionskörper einer Karies. Nach Aushärtung verschließt der Infiltrant die Läsionsporen und stellt somit eine Diffusionsbarriere für Säuren und niedermolekulare Kohlenhydrate dar.[38][39][40]
Konservative Therapieformen
Spätere Stadien der Karies, die mit einer Kavität („Loch“) einhergehen, müssen anders versorgt werden: Die betroffene Zahnhartsubstanz muss ausgeräumt und der Zahn mit einem Füllungsmaterial (beispielsweise Glasionomerzement, Komposit, Amalgam, Inlay) versorgt werden.
Bei stärkerer Zerstörung des Zahnes kommt ein Onlay oder eine Überkronung, und falls die Bakterien die Pulpa bereits erreicht haben, eine Wurzelkanalbehandlung oder eine Entfernung des Zahnes in Frage. Der entfernte Zahn sollte möglichst umgehend ersetzt werden (Brücke oder Implantat), um Veränderungen des Kiefers bzw. der Zahnstellung zu verhindern.
Belassen kariösen Restdentins
Nach einhundert Jahren, in denen die vollständige Entfernung kariösen Dentins als State-of-the-art galt, wird nach neueren Untersuchungen dem Belassen von kariösem Restdentin im pulpennahen Bereich der Vorzug gegeben. Im Mittelpunkt der Behandlung pulpennaher Defekte steht der Erhalt der verschlossenen Pulpa. Eine komplette Kariesentfernung führt häufiger zur Eröffnung der Pulpa als das Belassen von Restkaries. Dem pulpennahen Dentin wird dabei Gelegenheit gegeben, Tertiärdentin zu bilden. Pulpennahes Dentin wird dabei mit Kalziumhydroxid oder Glasionomerzement abgedeckt. Das Verfahren wird – oft eher aus Marketinggründen – als minimalinvasiv bezeichnet. Um kariöses Dentin im notwendigen Umfang exkavieren zu können, gibt es zahlreiche selbstlimitierende Verfahren.
Diese arbeiten entweder mit aktivem Feedback:
- Fluorescence Aided Caries Excavation (FACE)
- drehmomentkontrollierte Bohrer
- fluoreszenzgesteuerter Laser
oder mit passivem Feedback:
- chemomechanisch: Carisolv
- proteolytische Enzyme
- rotierende Polymerinstrumente
Aktive Feedback-Verfahren sind zu bevorzugen, da sich dabei der gewünschte Endpunkt des Exkavierens einstellen lässt und der Zustand des verbleibenden Dentins berücksichtigt werden kann.[41] Nach einer aktuellen Studie mit hoher Evidenz wird die Prognose der Pulpa durch unvollständige Kariesentfernung in einem Schritt, also mit anschließendem definitivem Kavitätenverschluss, verbessert.[42]
Ältester Nachweis von Zahnkaries
Karies kommt nicht nur beim Menschen vor. Sie tritt auch bei anderen Primaten mit unterschiedlicher Häufigkeit auf. Im Jahr 2021 wurde eine Untersuchung veröffentlicht, die zu dem Ergebnis kam, dass bereits bei Microsyops latidens, einem Primaten (oder nahen Primatenverwandten) aus dem Unteren Eozän, Karies aufgetreten sei. Mit einem Alter von etwa 54 Millionen Jahren ist dies der früheste Nachweis von Karies bei einem Säugetier. Dabei wurden auch starke Schwankungen in der Karieshäufigkeit festgestellt. Es wird vermutet, dass M. latidens sich zeitweise vermehrt von Früchten oder anderer zuckerhaltiger Nahrung ernährte, da sich aufgrund von Klimaschwankungen das Nahrungsangebot veränderte.[43][44]
Siehe auch
- Erosion (Zahnmedizin)
- Meth-Mund
- Nursing-Bottle-Syndrom (Kariesentstehung durch dauerhaftes Nuckeln an Saugflaschen bei Kindern)
- Zahnverlust
- Zahnwurm
Literatur
- Elmar Hellwig, Joachim Klimek, Thomas Attin: Einführung in die Zahnerhaltung – Prüfungswissen Kariologie, Endodontologie und Parodontologie. 6., überarb. Auflage. Dt. Zahnärzte-Verlag, Köln 2013, ISBN 978-3-7691-3448-3.
- Dominik Groß: Zahnkaries. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 1523 f.
- C. Hayes: The effect of non-cariogenic sweeteners on the prevention of dental caries: a review of the evidence. In: J Dent Educ., Band 65, 2001, S. 1106–1109. PMID 11699985 jdentaled.org (PDF)
- S3-Leitlinie Fluoridierungsmaßnahmen zur Kariesprophylaxe der Dt. Ges. f. Zahn-, Mund- und Kieferheilkunde. In: AWMF online (Stand 02/2013)
Weblinks
Einzelnachweise
- Willoughby D. Miller: The microorganisms of the human mouth. S. S. White and Co, Philadelphia 1890 (Reprinted: Karger, Basel 1973).
- P. D. Marsh: Dental diseases–are these examples of ecological catastrophes? In: International journal of dental hygiene. Band 4 Suppl 1, September 2006, S. 3–10, ISSN 1601-5029. doi:10.1111/j.1601-5037.2006.00195.x. PMID 16965527.
- S. Duchin, J. Van Houte: Colonization of Teeth in Humans by Streptococcus mutans as Related to Its Concentration in Saliva and Host Age. In: Infect Immun. Nr. 20(1), 1978, S. 120–125.
- O. Fejerskov: Changing paradigms in concepts on dental caries: consequences for oral health care. In: Caries research. Band 38, Nummer 3, 2004 May-Jun, S. 182–191, ISSN 0008-6568. doi:10.1159/000077753. PMID 15153687. (Review)
- A. K. L. Wan, W. K. Seow, D. M. Purdie, P. S. Bird, L. J. Walsh, D. I. Tudehope: A Longitudinal Study of Streptococcus mutans Colonization in Infants after Tooth Eruption. In: Journal of Dental Research. Nr. 82(7), 2003, S. 504–508.
- A. Sharma u. a.: Dermatoglyphic interpretation of dental caries and its correlation to salivary bacteria interactions: An in vivo study. In: JISPPD. Band 27, Nr. 1, 2009, S. 17–21. PMID 19414969 doi:10.4103/0970-4388.50811.
- Elmar Hellwig, Joachim Klicke, Elmar Hellwig, Joachim Klimek, Thomas Attin: Einführung in die Zahnerhaltung. Deutscher Ärzte-Verlag, 2013, ISBN 978-3-7691-3448-3, S. 24 (Google Books).
- G. Allais: Karies, Die biologischen Faktoren. (PDF; 130 kB) In: Bayerisches Zahnärzteblatt. 03/2008, S. 50–58.
- D. Raab: Karies – Entstehung und Prophylaxe. In: Dentalhygiene Journal. 2, 2014, S. 6–7. zwp-online.info (PDF; 184 kB)
- H. Sztajer, S. P. Szafranski, J. Tomasch, M. Reck, M. Nimtz, M. Rohde, I. Wagner-Döbler: Cross-feeding and interkingdom communication in dual-species biofilms of Streptococcus mutans and Candida albicans. In: The ISME journal. Band 8, Nummer 11, November 2014, S. 2256–2271, ISSN 1751-7370. doi:10.1038/ismej.2014.73. PMID 24824668.
- X.-Q. Shi, U. Welander, B. Angmar-Månsson: Occlusal Caries Detection with KaVo DIAGNOdent and Radiography: An in vitro Comparison. In: Journal of the European Organization for Caries Research. Nr. 34(2), 2000, S. 151–158.
- Clinical Diagnosis of Dental Caries: A North American Perspective. (PDF)
- Thomas J. Hilton: Fundamentals of Operative Dentistry: A Contemporary Approach, Fourth Edition. 4. Auflage. Quintessence Pub Co, 2013, ISBN 978-0-86715-528-0.
- J. C. Hamilton: Should a dental explorer be used to probe suspected carious lesions? Yes--an explorer is a time-tested tool for caries detection. In: J Am Dent Assoc. Band 136, Nr. 11, 2005, S. 1526–1528, doi:10.4103/1305-7456.110157.
- Dominik Groß: Zahnkaries. In: Werner E. Gerabek u. a. (Hrsg.): Enzyklopädie Medizingeschichte. Walter de Gruyter, Berlin / New York 2005, S. 1523 f.
- Thomas Kocher: Zur Lage der Zähne der Nation. (PDF) Universitätsklinikum Greifswald, Zentrum für Zahn-, Mund- und Kieferheilkunde, abgerufen am 24. Mai 2016 (PDF).
- Deutsche Mundgesundheitsstudie (DMS IV; 2010). (PDF) Deutsche Gesellschaft für Zahn-, Mund- und Kieferheilkunde (PDF; 191 kB).
- R. G. Watt, S. Listl, M. A. Peres, A. Heilmann (Hrsg.): Social inequalities in oral health: from evidence to action. International Centre for Oral Health Inequalities Research & Policy, London.
- Zahngesundheit: Sind die Gene schuld an häufiger Karies? Abgerufen am 26. Januar 2019.
- Karen E. Nelson, Chris L. Dupont, Marcus B. Jones, Sarah K. Highlander, Jeffrey M. Craig: Host Genetic Control of the Oral Microbiome in Health and Disease. In: Cell Host & Microbe. Band 22, Nr. 3, 13. September 2017, ISSN 1931-3128, S. 269–278.e3, doi:10.1016/j.chom.2017.08.013, PMID 28910633, PMC 5733791 (freier Volltext) – (Online [abgerufen am 26. Januar 2019]).
- A. Heilmann, A. Sheiham u. a.: Common Risk Factor Approach – Ein integrierter bevölkerungsbezogener und evidenzbasierter Ansatz zum Ausgleich sozialer Ungleichheiten in der Mundgesundheit. In: Das Gesundheitswesen. doi:10.1055/s-0035-1548933.
- W. Dörr, J. Haagen: Behandlung der oralen Mukositis in der Onkologie. (Memento vom 23. November 2015 im Webarchiv archive.today)
- Oral Health Topics: Baby Bottle Tooth Decay. hosted on the American Dental Association website. Page accessed August 14, 2006.
- A Guide to Oral Health to Prospective Mothers and their Infants, hosted on the European Academy of Paediatric Dentistry website. Page accessed August 14, 2006.
- Europastudie zu Überempfindlichkeit und Säureschäden: 30 Minuten Karenz sind unnötig. In: zm-online.de. 16. September 2015, abgerufen am 8. Januar 2018.
- Tanya Walsh et al.: Fluoride toothpastes of different concentrations for preventing dental caries. In: The Cochrane Database of Systematic Reviews. Band 3, 4. März 2019, S. CD007868, doi:10.1002/14651858.CD007868.pub3, PMID 30829399, PMC 6398117 (freier Volltext).
- Für gesunde Zähne: Fluorid-Vorbeugung bei Säuglingen und Kleinkindern. (PDF) Stellungnahme Nr. 015/2018 des BfR. In: BfR. 31. Mai 2018, abgerufen am 7. September 2020.
- Fluoridierungsmaßnahmen zur Kariesprophylaxe (PDF; 182 kB) Information der Bundeszahnärztekammer und der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde, Stand 4/2013.
- Philip Riley et al.: Xylitol-containing products for preventing dental caries in children and adults. In: The Cochrane Database of Systematic Reviews. Nr. 3, 26. März 2015, S. CD010743, doi:10.1002/14651858.CD010743.pub2, PMID 25809586.
- Bernd Kerschner: Xylit gegen Karies: Nutzen größtenteils unklar. In: Medizin transparent. 12. Dezember 2016, abgerufen am 14. März 2021.
- Schützen Kaugummis mit Xylit vor Karies? - Verbraucherzentrale. In: Verbraucherzentrale. 24. April 2017, abgerufen am 14. März 2021.
- Hyun Koo u. a.: Chemical characterization of red wine grape (Vitis vinifera and Vitis interspecific hybrids) and pomace phenolic extracts and their biological activity against Streptococcus mutans. In: Journal of Agricultural and Food Chemistry. Band 55, Nr. 25, 2007, S. 10200–10207. PMID 17999462 Siehe auch: Die Kraft des Weins. In: wissenschaft.de. 4. Januar 2008, abgerufen am 8. September 2019 (Polyphenole aus Weintrauben wirken gegen Bakterien, die Karies auslösen können.).
- M. L. Falsetta, M. I. Klein u. a.: Symbiotic Relationship between Streptococcus mutans and Candida albicans Synergizes Virulence of Plaque Biofilms In Vivo. In: Infection and Immunity. Band 82, Nummer 5, Mai 2014, S. 1968–1981, ISSN 1098-5522. doi:10.1128/IAI.00087-14. PMID 24566629.
- BASF pro-t-action™ Lactobazillus anti-caries für die Mundhygiene. (Memento vom 2. Februar 2011 im Internet Archive)
- Regelmäßig zur Vorsorge-Untersuchung, zahn.de, BLZK. Abgerufen am 28. September 2019.
- Gut vorbereitet zum Zahnarzt, zahn.de, BLZK. Abgerufen am 10. Februar 2022.
- Individualprophylaxe-Richtlinien des Bundesausschusses der Zahnärzte und Krankenkassen über Maßnahmen zur Verhütung von Zahnerkrankungen (PDF; 45 kB) vom 4. Juni 2003. B. 13, Bundesanzeiger Nr. 226 (S. 24 966) vom 3. Dezember 2003.
- H. Meyer-Lueckel, O. Fejerskov, S. Paris: [Novel treatment possibilities for proximal caries]. In: Schweizer Monatsschrift für Zahnmedizin = Revue mensuelle suisse d’odonto-stomatologie = Rivista mensile svizzera di odontologia e stomatologia / SSO. Band 119, Nummer 5, 2009, S. 454–461, ISSN 0256-2855. PMID 19579836. (Review).
- S. Paris, H. Meyer-Lueckel: Inhibition of caries progression by resin infiltration in situ. In: Caries Research. Band 44, Nummer 1, 2010, S. 47–54, ISSN 1421-976X. doi:10.1159/000275917. PMID 20090328.
- F. Schwendicke, S. Seddig: Micro-hardness and mineral loss of enamel lesions after infiltration with various resins: influence of infiltrant composition and application frequency in vitro. In: Journal of Dentistry. Band 41, Nummer 6, Juni 2013, S. 543–548, ISSN 1879-176X. doi:10.1016/j.jdent.2013.03.006. PMID 23571098.
- K.-H. Kunzelmann, J. H. Koch: Kariesexkavation, Neue Erkenntnisse und selbstlimitierende Methoden. In: zm. 101, Nr. 13 A, 1. Juli 2011, (1860).
- D. Ricketts, T. Lamont: Operative caries management in adults and children. In: The Cochrane database of systematic reviews. Band 3, 2013, S. CD003808, ISSN 1469-493X. doi:10.1002/14651858.CD003808.pub3. PMID 23543523. (Review).
- Elena Bernard: Prähistorische Primaten mit süßem Zahn. Auf: wissenschaft.de. 9. September 2021. Abgerufen am 4. Oktober 2021.
- Keegan R. Selig, Mary T. Silcox: The largest and earliest known sample of dental caries in an extinct mammal (Mammalia, Euarchonta, Microsyops latidens) and its ecological implications. In: Nature Science Reports 11, 15920 (2021) vom 9. September 2021. doi:10.1038/s41598-021-95330-x (freier Volltext). Abgerufen am 4. Oktober 2021.