Positronen-Emissions-Tomographie
Die Positronen-Emissions-Tomographie (PET; von altgriechisch τομή tome ‚Schnitt‘ und γράφειν graphein ‚schreiben‘) ist ein bildgebendes Verfahren der Nuklearmedizin.
Es handelt sich dabei um eine Variante der Emissionscomputertomographie. PET erzeugt Schnittbilder von lebenden Organismen, indem es die Verteilung einer schwach radioaktiv markierten Substanz (Radiopharmakon) im Organismus sichtbar macht und so biochemische und physiologische Funktionen abbildet (funktionelle Bildgebung). Sie beruht auf der gleichzeitigen Detektion (Aufspüren) zweier Gammastrahlungsphotonen, die nach dem Zerfall eines Positronen emittierenden (aussendenden) Radionuklids entstehen (β+-Zerfall). Die PET wird heute nahezu ausschließlich zusammen mit einer CT oder MRT als Hybridverfahren durchgeführt.
Prinzip
PET
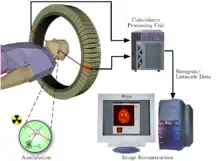

Basierend auf dem Prinzip der Szintigrafie wird dem Patienten zu Beginn einer PET-Untersuchung ein Radiopharmakon verabreicht, meist durch Injektion in eine Armvene. Radiopharmaka sind als Spürsubstanzen verwendete Medikamente, die unterhalb einer physiologisch wirksamen Dosierung eingesetzt werden, und als wesentlichen Bestandteil Radionuklide enthalten, die Positronen emittieren (-Strahlung). Die im Körper emittierten Positronen haben nur eine im Bereich von Nanosekunden liegende Lebensdauer und geraten fast unverzögert in eine Wechselwirkung mit einem Elektron. Dabei entsteht eine sekundäre Vernichtungsstrahlung (Annihilation), bei welcher zwei hochenergetische Photonen (Energie je 511 keV) in genau entgegengesetzte Richtungen, also mit einem Winkel von 180 Grad zueinander, ausgesandt werden. Das PET-Gerät enthält viele, meist ringförmig um den Patienten angeordnete Detektoren für die Photonen. Durch eine schnelle Elektronik werden nur solche Zerfallsereignisse gezählt, die auf exakten Koinzidenzen zwischen je zwei gegenüberliegenden Detektoren beruhen. Aus der zeitlichen und räumlichen Verteilung dieser registrierten Zerfallsereignisse wird auf die räumliche Verteilung des Radiopharmakons im Körperinneren geschlossen und eine Serie von Schnittbildern errechnet.
Im Gegensatz zu den auf Transmission basierenden Tomografieverfahren beruht die Bildentstehung bei PET und SPECT auf Emission und bildet somit die Verteilung des zuvor injizierten Radiopharmakons im Körper ab. Daraus ergibt sich eine primär funktionelle Abbildung und erst in zweiter Linie, in Abhängigkeit von der dargestellten Funktion, eine morphologische Abbildung. Deshalb liegt die Bedeutung der Anwendung von PET u. a. in der Beantwortung von Fragestellungen nach Stoffwechselvorgängen (z. B. Glukosestoffwechsel), Rezeptorstatus (z. B. Dopamin-Rezeptoren), oder Oberflächen-Antigen-Eigenschaften (z. B. PSMA-Status). Wichtige, klinische Anwendungen liegen in der Onkologie, Neurologie sowie Kardiologie.
Kombinierte PET/CT-Geräte für die Diagnostik am Menschen in Forschung und Klinik werden von den Firmen Canon Medical Systems, General Electric, Hitachi, Mediso, Siemens Healthineers und bis zum Jahr 2021 auch von Philips angeboten; ausschließlich für PET geeignete Geräte wurden nur bis zum Jahr 2003 gebaut.
Vergleich mit SPECT
Bei der Einzelphotonen-Emissionscomputertomographie (SPECT) wird für die Bestimmung der Strahlrichtung der zu messenden Photonen ein Kollimator benötigt. Da dieser einen Großteil der entstehenden Photonen ausblendet, kann nur etwa 1 Zehntausendstel der emittierten Photonen nachgewiesen werden. Bei der PET kann dagegen durch das Messprinzip des Koinzidenznachweises auf eine physikalische Kollimation verzichtet werden, was zu einer um ca. einen Faktor 100 verbesserten Ausbeute, höheren Zählraten und somit zu verbesserter Bildstatistik mit höherer Bildqualität und gesteigerter räumlicher Auflösung führt.[1] Da die Absorption der Photonen nur von der Dicke des durchstrahlten Gewebes, nicht jedoch vom Entstehungsort der Photonen abhängt,[2] ermöglicht dies zudem eine genaue Quantifizierung der Tracerverteilung im Untersuchungsvolumen, was mit der SPECT nicht möglich ist.[3]
Radionuklide
Das meist verwendete Nuklid für Radiopharmaka in der PET ist das radioaktive Isotop 18F des Fluors. Es wird mit Hilfe eines Zyklotrons hergestellt und kann aufgrund seiner Halbwertszeit von etwa 110 Minuten auch dann eingesetzt werden, wenn am Untersuchungsort kein Zyklotron besteht und das Radiopharmakon erst von der Produktionsstätte zum Untersuchungsort transportiert werden muss. Es wird aus diesem Grund bei über 90 % aller PET-Untersuchungen eingesetzt.
| Nuklid | Halbwertszeit |
|---|---|
| 11C | 20,3 Minuten |
| 13N | 10,1 Minuten |
| 15O | 2,03 Minuten |
| 18F | 110 Minuten |
| 68Ga | 68 Minuten |
| 82Rb | 75 Sekunden |
Neben 18F werden hauptsächlich 11C, 13N, 15O, 82Rb oder 68Ga eingesetzt.[4] Dies sind radioaktive Isotope der Elemente Kohlenstoff, Stickstoff, Sauerstoff, Rubidium und Gallium.
68Ga und 82Rb werden traditionell als Generator-Radioisotope eingesetzt. Das Radioisotop entsteht hier durch Zerfall eines instabilen Mutterisotops in einem sogenannten Radionuklidgenerator, in dem es sich anreichert (→ Gallium-68-Generator). Erst neuere Entwicklungen erlauben es, auch 68Ga in speziell darauf ausgerichteten Zyklotron-Einrichtungen herzustellen[5]. Alle anderen genannten PET-Nuklide werden ausschließlich mit Hilfe eines Zyklotrons hergestellt.
Das verwendete Radionuklid hat Einfluss auf die kritischen Leistungsparameter des PET-Gerätes: Während kurzlebige Nuklide verlangen, dass der PET-Scanner die damit einhergehenden hohen Zählraten bei Aktivitäten von mehreren Gigabecquerel (GBq) verarbeiten kann, ist bei 18F, meist in Form von Fluordesoxyglucose appliziert, die Sensitivität des Systems gefordert, da die injizierte Aktivität hier meist nur zwischen 100 und 350 Megabecquerel (MBq) liegt.
Die Bedeutung der Halbwertszeit soll anhand einer Rechnung erläutert werden: Nach 60 Minuten ist von einer Anfangsaktivität von 1000 MBq 11C nur etwa ein Achtel übrig. 60 Minuten sind bei einem Radiopharmakon auf 11C-Basis ungefähr drei Halbwertszeiten (exakt: 60/20,3 = 2,956). In diesem Beispiel entspricht die Restaktivität nach einer Stunde 1000 MBq × 1/22,956 = 128 MBq. Die Verwendung von 11C erfordert daher, dass sich ein Zyklotron in relativer Nähe des PET-Systems befindet. Werden 13N oder 15O eingesetzt, muss sich das Zyklotron in unmittelbarer Nähe des PET-Scanners befinden. Ein radiopharmazeutischer Produktionsbetrieb mit Zyklotron erfordert eine Investition im zweistelligen Millionenbereich, was die Nutzung der genannten Nuklide für die PET auf entsprechend eingerichtete Zentren beschränkt.
Radiopharmaka
Radiopharmaka sind Medikamente, die mit einem Radionuklid markiert sind und die der Organismus nicht von ihren nichtradioaktiven Pendants unterscheiden kann. Sie nehmen daher am gewöhnlichen Stoffwechsel teil, werden aber in einer Konzentration verwendet, die den jeweilig zu messenden Stoffwechsel quantitativ nicht beeinflusst (Tracer-Prinzip). Aufgrund seines radioaktiven Zerfalls kann die Menge und die Verteilung des Radionuklids im Körper gemessen und dargestellt werden.
Anreicherungsmechanismus
Der Nobelpreisträger Otto Warburg erkannte schon im Jahre 1930, dass Tumorzellen aufgrund eines erhöhten Stoffwechsels meist mehr Glucose verbrauchen als normale Körperzellen (Warburg-Effekt). 18F-Fluordesoxyglucose (FDG) wird über den Glucosetransporter von Zellen genauso aufgenommen wie Glucose, obwohl an einer Stelle des Moleküls eine Hydroxygruppe durch das Radionuklid 18F ersetzt ist. Da das im nächsten Stoffwechselschritt intrazellulär aus der Phosphorylierung von FDG entstehende FDG-6-Phosphat nicht weiter verstoffwechselt wird, findet eine Anreicherung statt („metabolic trapping“), die proportional zum aktuellen Stoffwechselzustand der Zellen ist. Dies ist besonders für die frühe Diagnose von Krebserkrankungen von Vorteil, wenn noch keine tumorbedingte Größenzunahme erfolgt ist, die für die Erkennung in anderen Schnittbildverfahren notwendig ist. Die Verteilung von FDG im Körper erlaubt neben dem Auffinden von Tumoren und Metastasen aber auch generell Rückschlüsse auf den Glucosestoffwechsel von Geweben. Das Anreicherungsprinzip anderer Radiopharmaka gehorcht ähnlichen Mechanismen: Wo immer das Radiopharmakon angereichert wird, wird dies durch einen erhöhten radioaktiven Zerfall an dieser Stelle im PET-Bild sichtbar. Cholin wird für die Biosynthese von Zellmembranen benötigt. In den Zellen wird Cholin phosphoryliert und als Phosphorylcholin in Phospholipide eingebaut. Tumorzellen haben durch ihre schnellere Vermehrung einen erhöhten Bedarf an Cholin. Als Cholin-Tracer werden [18F]Cholin und [11C]Cholin benutzt. Thymidin-Tracer eignen sich zur Markierung von DNA, die von Tumorzellen verstärkt verdoppelt wird. Man benutzt hierfür 14C-, 3H-, 11C-und 18F-markiertes Thymidin, die wie natürliches Thymidin in die DNA eingebaut werden.
Typische Anwendungsgebiete ausgewählter Radiopharmaka
| Nuklid | Radiopharmakon | Anwendungsgebiet |
|---|---|---|
| 11C | [11C]-Cholin | Prostatakrebsdiagnostik[6] (wurde weitestgehend durch 18F-Cholin ersetzt) |
| [11C]-Pittsburgh compound | Pittsburgh compound B zur Alzheimer Frühdiagnostik (noch in Entwicklung)[7] | |
| [11C]-S-Methyl-L-Methionin | Sichtbarmachung der Proteinbiosynthese (Diagnostik niedriggradig maligner Gliome) | |
| [11C]Acetat | Visualisierung des Sauerstoffverbrauchs des Herzmuskels | |
| 13N | [13N]L-Glutaminsäure | Darstellung des Aminosäurenstoffwechsels |
| [13N]Ammoniak | Darstellung der Herzmuskeldurchblutung | |
| 15O | [15O]Wasser | Darstellung der Durchblutung (Perfusion) |
| [15O2] | Darstellung der Sauerstoffaufnahme und Verteilung | |
| 18F | [18F]-Cholin | Prostatakrebsdiagnostik |
| [18F]-PSMA-1007[8] | Prostatakrebsdiagnostik; hat eine größere Sensitivität als F18-Cholin[9] | |
| [18F]-Fluoruracil | Darstellung von Tumoren und für die Therapiekontrolle | |
| [18F]-Fluorethyltyrosin | Darstellung von Hirn-Tumoren (in Kombination mit [11C]-S-Methyl-L-Methionin) | |
| [18F]-Natriumfluorid | Darstellung des Knochenstoffwechsels | |
| [18F]-2-Fluor-2-desoxy-D-glucose | Darstellung von Glucosetransport und Glucoseumsatz | |
| [18F]-6-Fluoro-DOPA | Darstellung des präsynaptischen Dopamin-Pools zur Diagnostik neuroendokriner Tumore (beispielsweise medulläres Schilddrüsenkarzinom) | |
| [18F]-Florbetaben, -Florbetapir, -Flutemetamol | Tracer für Amyloid-beta zur Früherkennung der Alzheimer-Krankheit (für das Radiopharmazeutikum Amyvid besteht seit Anfang des Jahres 2013 eine Zulassung in Europa[10]) | |
| 68Ga | DOTATOC | Somatostatin-Rezeptorbildgebung neuroendokriner Tumoren: Pankreastumor, Meningeom, kleinzelliges Bronchialkarzinom oder Karzinoid[11] |
| 82Rb | [82Rb]-Chlorid | Darstellung der Herzmuskeldurchblutung |
Die PET-Untersuchung
Indikationen
Wegen der hohen Kosten und zum Strahlenschutz sollen PET-Untersuchungen nur bei nachgewiesenem Nutzen durchgeführt werden. Für welche Indikationen eine PET sinnvoll ist, wird beispielsweise von der Deutschen Gesellschaft für Nuklearmedizin detailliert bewertet.[12] International akzeptierte Indikationen sind gegenwärtig:[13][14]
| Krankheit | Kostenübernahme für |
|---|---|
| Solitärer Lungenrundherd | Charakterisierung |
| nicht kleinzelliges Bronchialkarzinom | Charakterisierung |
| Oesophaguskarzinom | Primärstaging, Diagnose, Staging, Re-Staging |
| Kolorektales Karzinom | Diagnose, Staging und Re-Staging |
| steigender CEA-Wert | Tumorlokalisation |
| Lymphom | Diagnose, Staging und Re-Staging |
| Melanom | Diagnose, Staging und Re-Staging |
| Mammakarzinom | Restaging, Therapieverlaufs- oder Diskussion einer
Therapieregimeänderung beim metastasierten Mammakarzinom |
| Kopf-Hals-Karzinom | Diagnose, Staging und Re-Staging |
| follikuläres Schilddrüsenkarzinom | Re-Staging des Rezidivs oder Resttumors |
| Basalganglienerkrankungen | frühe Differenzialdiagnose des Morbus Parkinson, frühe Diagnose von Multisystemdegenerationen, |
| Demenz | Frühdiagnostik der primären Demenzen |
| Epilepsie | Lokalisation des epileptogenen Fokus im Rahmen der präoperativen
Epilepsiediagnostik bei Temporallappenepilepsien (mit F-18-FDG) |
Möglicherweise kann die PET-Untersuchung während der Chemotherapie einen Vorteil für Patienten mit einem Hodgkin-Lymphom darstellen. Bei dem Vergleich von PET-negativen (= gute Prognose) und PET-positiven (= schlechte Prognose) Patienten erhielten Aldin et al. die folgenden Ergebnisse: Die Evidenz ist sehr ungewiss bezüglich der Wirkung des Effekts von negativen und positiven interimsmäßig durchgeführten PET Untersuchungen auf das progressionsfreie Überleben bei einer Beobachtungszeit von 3 Jahren. Negative interimsmäßige PET-Untersuchungen erzielen eventuell eine Erhöhung des progressionsfreien Überlebens im Vergleich zu positiven Untersuchungsergebnissen, wenn der angepasste Effekt gemessen wird. Negative interimsmäßige PET Resultate können zu einer ausgeprägten Erhöhung des Gesamtüberlebens im Vergleich zu positiven Resultaten führen, wenn der Beobachtungszeitraum 3 Jahre beträgt und auch, wenn der angepasste Effekt gemessen wird.[15]
Ablauf
Der Proband erhält das Radiopharmakon per Injektion oder Inhalation. Im Falle einer FDG-PET-Untersuchung werden je nach Patientengewicht und Gerät (2D- oder 3D-Scanner) 150 bis 700 MBq injiziert;[16] anschließend muss der Patient etwa 50 bis 75 Minuten[16] ruhen, damit der Tracer genügend Zeit hat, sich an relevanten Stellen im Körper anzureichern (Uptake-Phase). Bei der FDG-PET soll der Patient zum Zeitpunkt der Untersuchung nüchtern sein. Während der Untersuchung soll er ruhig liegen und nicht frieren, da sonst die Erhöhung des Zuckerstoffwechsels als Anreicherung in Muskulatur und braunem Fettgewebe sichtbar würde. Bei der Untersuchung wird der Patient auf einem beweglichen Tisch so positioniert, dass der zu untersuchende Körperabschnitt im Sichtbereich der Detektoren liegt.
Der axiale Sichtbereich der Detektoren – auch Field of View (FOV) genannt – liegt bei kommerziellen Systemen im Bereich von etwa 15 bis 20 cm. Bei Aufnahmen, die einen größeren Teil des Körpers abdecken, ist es daher nötig, mehrere sogenannte Bettpositionen aufzunehmen. Je nach Gerätetyp ist die Überlappung der Bettpositionen unterschiedlich groß und liegt zwischen circa 1,5 und 5 cm. Für eine Ganzkörperaufnahme ergeben sich daher etwa 8 bis 12 Bettpositionen. Meist werden jedoch nur Teilkörperaufnahmen durchgeführt. Pro Bettposition liegt die Aufnahmedauer je nach Gerät, verwendetem Tracer, injizierter Dosis und Körpergewicht des Patienten bei zwei bis vier Minuten. Nach Ablauf dieser Zeit fährt das Gerät automatisch zur nächsten Bettposition.
Beim PET/CT wird der Patient unmittelbar hintereinander durch beide Detektorringe (Gantries) von CT und PET gefahren. Da der CT-Datensatz für die Rekonstruktion der PET-Daten benötigt wird, wird in der Regel zunächst eine CT-Aufnahme durchgeführt und die PET-Aufnahme daran angeschlossen. So kann bereits nach Beendigung der Aufnahme der ersten Bettposition mit der Bildrekonstruktion begonnen werden. Würde zunächst der PET-Datensatz aufgenommen, müsste mit dem Beginn der Bildrekonstruktion der PET-Daten gewartet werden bis der CT-Datensatz rekonstruiert ist und zu unerwünschten Verzögerungen im Arbeitsablauf führen, denn die Rekonstruktion eines Ganzkörper-PET-Datensatzes benötigt je nach Gerät und Rechenmethode ca. 10–45 Minuten Zeit. Eine laufende CT-Aufnahme ist für den Patienten daran erkennbar, dass der Tisch bewegt wird, während gleichzeitig ein Motorengeräusch hörbar ist, das in erster Linie von der Rotationsbewegung von Röhre und Detektorsystem stammt. Die Gantries sind bei einigen Systemen im selben Gehäuse untergebracht und nicht einzeln von außen sichtbar. Die errechneten Bilder werden im Computer automatisch fusioniert.
Bei PET/CT-Geräten ist die CT-Aufnahme für die Berechnung schwächungskorrigierter PET-Bilder zwingend erforderlich, jedoch reicht ein so genannter Low-Dose-CT-Scan hierfür aus. Bei einigen Geräten kann für die Errechnung der Schwächungsmap jedes CT-Protokoll, also auch eine diagnostische CT-Aufnahme genutzt werden; einige Geräte fordern zwingend die zusätzliche Durchführung eines dedizierten Low-Dose-Scans, selbst wenn vom Patienten bereits eine Hoch-Dosis-CT-Aufnahme existiert.
Befundung
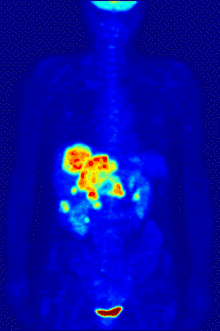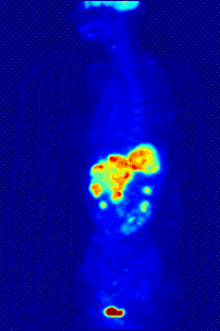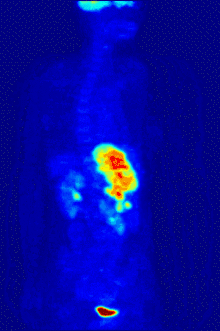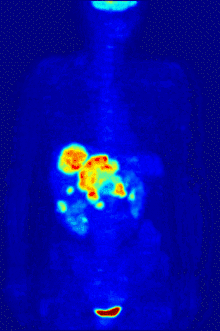
Die Befundung des PET- oder PET/CT-Bildes erfolgt durch Betrachtung der rekonstruierten Schnittbilder (axial, koronar oder sagittal). Bei PET/CT-Geräten ist die Darstellung von PET und CT verknüpft, so dass automatisch die Position des korrelierenden PET-Bildes gezeigt wird, wenn der Bildkursor im CT-Bild verschoben wird.
Für eine Übersichtsdarstellung wird ein sogenanntes MIP-Bild (Maximum Intensity Projection) herangezogen. In dieser Darstellung ist das gesamte Untersuchungsobjekt abgebildet und man erlangt einen schnellen Überblick über Regionen erhöhter Aufnahme. Zur nochmals besseren Visualisierung kann man das MIP um sich selbst rotieren lassen, um das Untersuchungsobjekt von allen Seiten zu zeigen.
Die Quantifizierung von Regionen mit gesteigertem Uptake erfolgt über den so genannten Standardized Uptake Value, abgekürzt SUV. Der SUV-Wert beschreibt die Nuklidanreicherung unter Berücksichtigung von Nuklidzerfall, verabreichter Dosis und Patientengewicht, um damit eine zeit- und gewichtsunabhängige Quantifizierung zu erhalten.
Bei der Beurteilung einer Anreicherung muss zwischen physiologischem und pathologischem Uptake unterschieden werden. Ein Uptake kann ganz unterschiedliche Ursachen haben: Ein Tumor kann ebenso zu einer FDG-Anreicherung führen wie das Heilen einer Wunde, ein Entzündungsvorgang, eine einfache Muskelanspannung oder ein frierender Patient.[16]
Die sogenannte Total Lesion Glycolysis (TLG) wird vom SUV abgeleitet, es ist der mittlere SUV-Wert mal Tumorvolumen und beschreibt im Gegensatz zum SUV nicht den maximalen oder mittleren Glukoseumsatz an einer bestimmten Stelle, sondern den Glukoseumsatz der gesamten Läsion.[17]
Strahlenexposition
Da PET auf der Verabreichung einer radioaktiven Substanz beruht, muss die Indikation wie bei allen mit ionisierender Strahlung arbeitenden Bildgebungsverfahren (beispielsweise CT, Angiografie) zurückhaltend gestellt werden.
Die Strahlenexposition einer reinen PET-Untersuchung mit [18F]-FDG liegt bei etwa 7 mSv für die PET, wenn 350 MBq injiziert werden und zwischen 3 und 10 mSv für die CT. Die Strahlenbelastung durch den CT hängt wesentlich davon ab, ob dieser nur zur Lokalisation oder auch für die Diagnostik verwendet werden soll.[18] Die Strahlenbelastung durch das PET allein liegt damit in der Größenordnung einer Computertomografie des Thorax. Dabei ist jedoch zu bemerken, dass die Referenzdosis älterer, etwa bis zum Jahr 2000–2005 üblicher 2D-Scanner für einen 70-kg-Patienten bei 370 MBq liegt, die der heute üblichen 3D-Scanner bei 200 MBq.[19]
Wie bei allen Untersuchungsverfahren mit ionisierenden Strahlen muss auch bei der PET die Strahlenmenge in Relation zu der gewonnenen Information gesetzt werden. Es ist bei einer Strahlendosis von 1 Sievert (Sv), der 100 Menschen ausgesetzt sind, mit 5 Todesfällen durch Strahlenkrebs zu rechnen, für über 60-Jährige gilt ein Wert von 1,2 Todesfällen pro Sievert. Man müsste also 100.000 PET-Untersuchungen durchführen, um 35 Todesfälle an Strahlenkrebs (nach einer mittleren Latenzzeit von etwa 15 Jahren für Leukämie und etwa 40 Jahren für solide Tumoren) zu verursachen, das heißt etwa eine auf 3000 Untersuchungen.
Dabei ist zu berücksichtigen, dass die Mehrzahl der PET-Untersuchungen bei onkologischen Fragestellungen erfolgt, also bei Patienten mit zum Teil erheblich eingeschränkter Lebenserwartung.
Als Beispiel: eine PET-Untersuchung erfolgt zum Staging bei einem Patienten mit nicht-kleinzelligem Bronchialkarzinom (Fünf-Jahres-Überlebensrate von 15 %[20]). Hier ist das theoretische Risiko für den Patienten, 20 oder 30 Jahre später an einem strahleninduzierten Zweittumor zu erkranken, zu vernachlässigen. Dagegen führt die PET-Untersuchung in 11 bis 37 % der Fälle bei dieser Erkrankung zu einer wesentlichen Änderung und damit in der Regel zu einer Verbesserung des therapeutischen Vorgehens.[21]
Um die Strahlenbelastung für krebskranke Kinder zu reduzieren, empfehlen Kinderradiologen und Nuklearmediziner des Universitätsklinikum Leipzig die kombinierte Diagnostik von PET und MRT. Bei gleicher Aussagekraft sei dieses schonender, auch wenn es deutschlandweit nur in sieben Zentren verfügbar ist.[22]
Kosten und Kostenübernahme
PET gehört zu den teuersten bildgebenden Verfahren in der modernen Medizin. Die Kosten einer PET-Untersuchung können bis zu 1500 Euro betragen.[23] Eine Ganzkörper-PET/CT kostet in Deutschland beispielsweise ca. 1.123 Euro (Stand: April 2008). Dies ist gegenüber einer Ganzkörper-MRT mit 575 Euro etwa der doppelte Preis.[24] Die reinen Gerätekosten für ein PET-Gerät liegen je nach Ausstattung zwischen 1,5 und 3 Millionen Euro.[23]
Ein großer Teil der für die Diagnostik notwendigen Radiopharmaka muss mittels eines Zyklotrons hergestellt werden, wodurch beim produzierenden Betrieb hohe Kosten verursacht werden. Da die Produktion von Radiopharmaka dem Arzneimittelgesetz unterliegt, kommen sämtliche Auflagen und Gesetze zur Anwendung, denen ein Arzneimittel herstellender Betrieb unterliegt, so dass die Gesamtinvestitionen für die Produktion von Radiopharmaka bei etwa zehn Millionen Euro liegen.
Die Gesetzliche Krankenversicherung in Deutschland übernimmt die Kosten für eine PET-Untersuchung im Gegensatz zur Praxis in anderen europäischen Staaten in der Regel nur, wenn der Patient stationär aufgenommen bzw. behandelt wird. Der medizinische Dienst der Krankenkassen lehnt jedoch immer häufiger eine Kostenübernahme ab, wenn der Patient nur zur Durchführung einer PET/CT stationär aufgenommen wurde, also wenn keine andere Diagnostik durchgeführt wurde oder wenn nicht direkt im Anschluss mit der Therapie begonnen wurde.
Seit 2007 werden in Deutschland die Kosten einer PET-Untersuchungen für die Diagnostik des nichtkleinzelligen Lungenkarzinoms (NSCLC) von den gesetzlichen Krankenkassen übernommen, jedoch existierten zunächst keine EBM-Nummern, so dass die routinemäßige Abrechnung sich schwierig gestaltete. Seit 1. Januar 2009 ist zum NSCLC auch das kleinzellige Lungenkarzinom (SCLC) hinzugekommen. Der gemeinsame Bundesausschuss hat für den Fall eines unklaren Resttumors die 18F-FDG PET /CT als Regelleistung im ambulanten Bereich der gesetzlichen Krankenkassen eingeführt.[25]
Seit Oktober 2010 werden unter bestimmten Bedingungen die Kosten für die PET-Diagnostik auch beim malignen Lymphom übernommen.[26]
Seit dem 1. Januar 2016 vergütet die Gesetzliche Krankenversicherung (GKV) in Deutschland die Kosten für eine PET- oder PET/CT-Untersuchung als neue vertragsärztliche Leistung bei den oben genannten Indikationen. Der EBM wurde um einen neuen Abschnitt 34.7 mit den Gebührenordnungspositionen (GOP) 34700 bis 34703 erweitert.[27] Am 2. November 2017 wurde die Qualitätssicherung in einer Vereinbarung zu PET und PET/CT angepasst.[28][29]
Sensitivität und Spezifität der PET in der Diagnostik
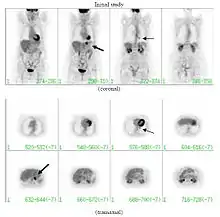
Sensitivitäts- und Spezifitätsangaben bezogen sich anfangs oft auch auf Studien, die noch mit reinen PET-Scannern durchgeführt wurden. Reine PET-Geräte hatten sowohl eine schlechtere Bildauflösung (5–8 mm) als auch eine schlechtere Bildqualität (Bildrauschen) als die heute verfügbaren PET/CT-Geräte, die Auflösungen von bis unter 4 mm erreichen.
Die Bildqualität wird daneben auch von der notwendigen Untersuchungszeit beeinflusst. Mit einem reinen PET-Scanner benötigte man bis zu 90 Minuten für eine Aufnahme, ein moderner PET/CT-Scanner benötigt für ein qualitativ besseres Bild nurmehr ca. 15 Minuten. Bewegt sich der Patient während der Aufnahme, wird das Bild unscharf. Falsch negative Befunde sind häufig darauf zurückzuführen, dass die Läsion kleiner ist, als das Gerät darzustellen vermag. Ein großes Problem zur Zeit der reinen PET-Geräte war auch, physiologische Tracer-Anreicherungen von pathologischen Anreicherungen zu unterscheiden, da die eindeutige anatomische Zuordnung einer Anreicherung nicht oder nur schwer möglich war. Die Einführung der PET/CT brachte hier große Fortschritte.[30] Die Spezifität der PET-Diagnostik erfordert organspezifische Tracer. Da diese in der Regel nicht zwischen entzündlichem und entartetem Gewebe unterscheiden können, muss vor einer Metastasensuche mittels PET ein histologisch gesicherter Befund des Primärtumors vorliegen.
Lungenkrebs
In der Mehrzahl der durchgeführten Studien erreichte die PET (NICHT PET/CT) bei der Primärdiagnostik des Bronchialkarzinoms eine Gesamt-Sensitivität von etwa 92 % bei einer Spezifität von 90 % im Nachweis von Herden größer als 7 mm. Falsch negative Diagnosen sind meist auf einen hohen Serum-Glukose-Spiegel zurückzuführen und treten bisweilen bei kleinen Herden auf, die aufgrund von Atembewegungen in der Lungenspitze keinen deutlichen SUV-Wert ergeben.[30]
Brustkrebs
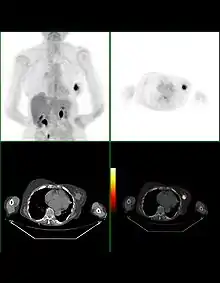
Die Leistung von PET/CT bei der Brustkrebsdiagnostik hängt vom histologischen Typ und der Größe der zu detektierenden Läsion ab. Tumoren lobulärer Histologie, tubuläre Karzinome und kleine (< 1 cm) In-situ-Karzinome zeigen einen geringen FDG-Uptake und sind daher schwerer zu entdecken. Die verfügbare Auflösung des Aufnahmegerätes ist auch hier ein kritischer Parameter.
Bei Tumoren größer als 1 cm, wie auch bei der Detektion befallener Lymphknoten wird eine Sensitivität von größer als 90 % berichtet. PET scheint jedoch die Zahl befallener Lymphknoten zu unterschätzen; die Sensitivität hängt ebenso von der Gesamttumorlast ab. Eine große Studie berichtet von nur 60 % Sensitivität bei 80 % Spezifität bei der Detektion axillärer Lymphknoten.
Bei der Verlaufsbeobachtung (Staging) im Rahmen einer laufenden Chemotherapie spielt die PET/CT eine große Rolle. Ebenso empfiehlt sie sich bei strahlendichten bzw. großen Brüsten, die mit anderen Verfahren nur unzureichend beurteilt werden können, zum Auffinden und Beurteilen von (Knochen-)Metastasen, sowie zur Diagnostik von Rezidiven.[30]
Darmkrebs
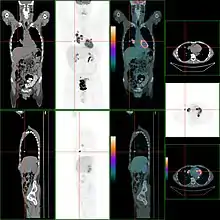
Die Detektierbarkeit von Tumoren und Metastasen des Darmkrebs wird durch den Umstand beeinträchtigt, dass sich FDG durch physiologische Prozesse ohnehin im Darm anreichert, was das Signal-Rausch-Verhältnis verschlechtert. Hier hat die PET/CT eine signifikant bessere Diagnostik im Vergleich zur reinen PET gebracht, da sie die anatomische Zuordbarkeit von Anreicherungen stark verbessert hat.
Metastudien haben gezeigt, dass die PET/CT in Bezug auf Sensitivität und Spezifität der CT, der MRT und dem Ultraschall überlegen ist. Eine Studie berichtet von 94 % Sensitivität und 87 % Spezifität. Bei Patienten mit CEA-Anstieg, bei denen die Computertomographie keine Tumorlokalisation ermöglichte, zeigte die PET eine Sensitivität von über 80 %. Eine klare Stärke der PET liegt in der frühen Diagnostik des Ansprechens einer Chemotherapie, wo sie „Responder“ (Tumor spricht auf die Chemotherapie an) und „Non-Responder“ sehr früh zu klassifizieren vermag.[30]
Kopf-Hals-Karzinom
In einigen Studien wurden bei bekannten Tumoren Sensitivitäten von 90 bis 100 % angegeben. Falsch negative Befunde ergaben sich bei sehr kleinen Läsionen sowie bei schleimbildenden Tumoren. Bei Speicheldrüsentumoren beträgt die Sensitivität weniger als 70 %. Die PET ist hier der MRT unterlegen. Beim Staging von Lymphknotenmetastasen bei bekanntem Kopf-Hals-Karzinom ist die PET der MRT deutlich überlegen (90 % Sensitivität vs. 75 %). Die PET ist beim Restaging von Kopf-Hals-Tumoren (zum Evaluieren des Therapie-Ansprechens) das geeignetste Diagnoseverfahren.
Falsch positive Befunde ergeben sich durch Lymphknoten in der Kopf-Hals-Region, die im Rahmen einer Therapie eine entzündliche Reaktion zeigen. Im Kopf-Hals-Bereich findet auch „physiologischer“ (normaler) FDG-Uptake statt (beispielsweise in den Speicheldrüsen). Daher besteht – wie auch beim Darmkrebs – die prinzipielle Gefahr, physiologische Anreicherungen (falsch-positiv) für tumorassoziiert und Anreicherungen in Tumorgewebe fälschlicherweise (falsch-negativ) für physiologische Anreicherungen zu halten.[30]
Hautkrebs (beispielsweise malignes Melanom)
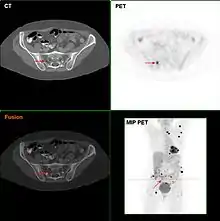
In der Literatur werden Sensitivitätsangaben der PET (nicht PET/CT) von 80–100 % gemacht, wobei falsch negative Befunde bei sehr kleinen Läsionen (< 3 mm) beobachtet wurden. Die Sensitivität des Verfahrens wird somit von der Bildauflösung des PET-Scanners begrenzt. Die Spezifität wird mit etwa 80 % angegeben. Die PET(/CT) eignet sich sehr gut zur Detektion von Metastasen. Hautkrebs gehört zu den metabolisch aktivsten Tumorentitäten und zeigt aus diesem Grund oft sehr hohe FDG-Anreicherungen.[30]
Prostatakrebs
In einer Studie, in der 67 Patienten mit histologisch gesichertem Prostatakrebs teilgenommen hatten, wurden die Ergebnisse der PET/CT mit den histologischen Befunden korreliert. Es wurde eine Sensitivität der 11C-Cholin PET/CT zum Auffinden von Lymphknotenmetastasen von 80 %, eine Spezifität von 96 %, und eine Genauigkeit von 93 % angegeben.[31] Seit etwa dem Jahr 2013 ist für die Diagnose des Prostatakrebs ein neuer Tracer verfügbar. Hierbei wird das prostataspezifische Membranantigen (PSMA) an das Radionuklid 68Ga gekoppelt.[32]
Knochenmetastasen
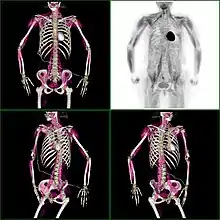
Knochenmetastasen unterschiedlicher Tumorerkrankungen können mit PET/CT sehr gut nachgewiesen werden. Das Verfahren ist sensitiver als die SPECT und erheblich sensitiver als die planare Skelettszintigrafie, jedoch auch aufwändiger und somit teurer. Je nach Tumorentität werden unterschiedliche Tracer verwendet, meist jedoch FDG und Natriumfluorid, beim Prostatakrebs auch 11C- oder 18F-Cholin. Metabolische Aktivität des Tumors ist mit Hilfe des Tracers FDG, die Reaktion des Knochens auf den Tumor mit der Natriumfluorid-PET/CT meist gut darstellbar (siehe Bildbeispiele).[33]
 HDP-Skelettszintigramm eines Patienten mit Nierenkrebs: Die Knochenmetastasen im Halswirbelkörper 7 und in der Lendenwirbelsäule (LWK 1&2) sind aufgrund der geringen Auflösung der planaren Skelettszintigrafie nur zu erahnen.
HDP-Skelettszintigramm eines Patienten mit Nierenkrebs: Die Knochenmetastasen im Halswirbelkörper 7 und in der Lendenwirbelsäule (LWK 1&2) sind aufgrund der geringen Auflösung der planaren Skelettszintigrafie nur zu erahnen. SPECT-Aufnahme des HDP Skelettszintigramms desselben Patienten; von den beiden Metastasen in der Lendenwirbelsäule ist nur eine einzige Läsion erkennbar; die Läsion in der Halswirbelsäule ist nicht dargestellt.
SPECT-Aufnahme des HDP Skelettszintigramms desselben Patienten; von den beiden Metastasen in der Lendenwirbelsäule ist nur eine einzige Läsion erkennbar; die Läsion in der Halswirbelsäule ist nicht dargestellt.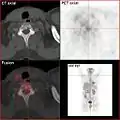 FDG-PET desselben Patienten: Die osteolytische Knochenmetastase im Halswirbelkörper reichert FDG nicht an und ist nur im CT erkennbar. Die beiden weiteren Knochenmetastasen in der Lendenwirbelsäule werden dagegen auch in der FDG-PET/CT dargestellt.
FDG-PET desselben Patienten: Die osteolytische Knochenmetastase im Halswirbelkörper reichert FDG nicht an und ist nur im CT erkennbar. Die beiden weiteren Knochenmetastasen in der Lendenwirbelsäule werden dagegen auch in der FDG-PET/CT dargestellt.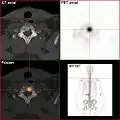 Natriumfluorid-PET/CT desselben Patienten: Die osteolytische Knochenmetastase in der Halswirbelsäule zeigt einen extremen Uptake und ist klar erkennbar. Die beiden weiteren Knochenmetastasen in der Lendenwirbelsäule stellen sich in der PET/CT-Aufnahme ebenfalls sehr gut dar.
Natriumfluorid-PET/CT desselben Patienten: Die osteolytische Knochenmetastase in der Halswirbelsäule zeigt einen extremen Uptake und ist klar erkennbar. Die beiden weiteren Knochenmetastasen in der Lendenwirbelsäule stellen sich in der PET/CT-Aufnahme ebenfalls sehr gut dar.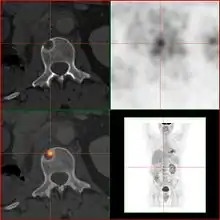 Vergleich derselben Läsion des vorgenannten Patienten: Die FDG-PET/CT-Aufnahme zeigt die Stoffwechselaktivität des Tumors.
Vergleich derselben Läsion des vorgenannten Patienten: Die FDG-PET/CT-Aufnahme zeigt die Stoffwechselaktivität des Tumors.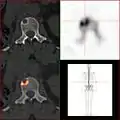 Vergleich ein und derselben Läsion des vorgenannten Patienten: Die Natriumfluorid-PET/CT-Aufnahme zeigt die Stoffwechselaktivität des Knochens als Reaktion auf den Tumor.
Vergleich ein und derselben Läsion des vorgenannten Patienten: Die Natriumfluorid-PET/CT-Aufnahme zeigt die Stoffwechselaktivität des Knochens als Reaktion auf den Tumor.
Eine falsch positive, diffuse FDG-Aufnahme kann im Knochenmark als Reaktion auf eine kurz zuvor erfolgte Chemotherapie beobachtet werden. Bei der PET-Bildgebung mit Natriumfluorid (NaF) ist zu beachten, dass auch nach einer erfolgreichen Therapie im Knochen eine Anreicherung zu beobachten sein kann, die in diesem Fall nicht die Aktivität des Tumors, sondern die Reparaturaktivität der Osteoblasten (knochenbildenden Zellen) darstellt.[33]
Geschichte der PET und Ausblick auf künftige Entwicklungen
Die Erfindung der PET wird gemeinhin den amerikanischen Physikern Michel Ter-Pogossian und Michael E. Phelps zugesprochen, die ihre Ergebnisse 1975 publizierten.[34][35] Die Grundlagen wurden vom Neurowissenschaftler Louis Sokoloff gelegt, der mit Martin Reivich Anfang der 1970er zeigte, dass sich radioaktive Glucose-Analoga gut zur Aufzeichnung der Gehirnaktivität eigneten. Er verwendete das Isotop Kohlenstoff-14, Alfred P. Wolf schlug stattdessen das Isotop Fluor-18 vor im Tracer FDG (synthetisiert von Wolf und Joanna Sigfred Fowler). Die Substanz wurde zuerst 1976 von dem Neurowissenschaftler Abass Alavi (* 1938) für einen PET-Scan von menschlichen Gehirnen verwendet.[36]
Gordon Brownell und W. H. Sweet lokalisierten am Massachusetts General Hospital jedoch bereits Anfang der 1950er Jahre einen Hirntumor mit Hilfe von positronenbasierter Bildgebungstechnik[37][38] und eine computergestützte Bildrekonstruktion auf Basis einer schwächungskorrigierten, gefilterten Rückprojektion wurde von David Chesler schon im Jahr 1970 ebendort erstellt.[38]
Vom PET zum PET/CT
PET ist bei der richtigen Fragestellung ein hochsensitives Verfahren; Aktivitätsanreicherungen lassen sich jedoch anatomisch nicht immer gut lokalisieren, da in PET-Bildern in erster Linie Stoffwechselprozesse aufgezeigt werden; hinzu kommt die begrenzte Ortsauflösung von etwa 4–6 mm.
Ein PET/CT-Gerät kombiniert die hohe Ortsauflösung (von bis zu 0,35 mm) und detailreiche Anatomiedarstellung des CT-Geräts mit den hochsensitiven Stoffwechselinformationen aus der PET.
Seit dem Jahre 2001 sind daher Geräte auf dem Markt, die einen PET-Scanner mit einem Computertomographen (CT) kombinieren. Das weltweit erste Gerät dieser Art wurde vom Unternehmen General Electric an der Universität Zürich im März des Jahres 2001 installiert,[39] das deutschlandweit erste Gerät wurde von Siemens Ende des Jahres 2001 an der Universitätsklinik Essen in Betrieb genommen.[40]
Bei PET/CT-Systemen werden die für die Schwächungskorrektur der PET-Daten nötigen Korrekturmaps aus den Hounsfield-Werten der CT-Daten errechnet. Bei reinen PET-Scannern war hierfür eine eigene Strahlenquelle nötig, mit deren Hilfe diese Schwächungsmap erstellt wurde. Da die Aufnahme des CT-Scans erheblich schneller erfolgt als die früher nötige Transmissionsaufnahme mit Strahlenquelle, ergibt sich daraus eine deutliche Verkürzung der Aufnahmedauer von bis zu 40 %. Die Untersuchungszeit für Ganzkörperaufnahmen liegt bei PET/CT-Systemen im Bereich von 15 bis 30 Minuten.
PET/CT-Geräte für den klinischen Einsatz haben reine PET-Scanner auf dem Neugerätemarkt bereits ab dem Jahr 2004 vollständig verdrängt.
Als noch einige ältere reine PET-Scanner im Einsatz waren (s. u.), wurde eine Überlagerung (sogenannte Soft-Fusion bzw. Koregistrierung) von CT-Bildern und PET-Daten auch mittels Software berechnet. Dies geschieht mit Hilfe gemeinsamer Referenzpunkte wie etwa Knochenstrukturen oder anhand externer Positionsdaten. Nachteil der nachträglichen Fusion der Bilddaten ist, dass das für die Bildfusion verwendete CT-Bild nicht zur Rekonstruktion der PET-Daten (eines reinen PET-Scanners) herangezogen wurde, die Bildqualität des resultierenden PET/CT-Bildes daher schlechter als die eines dedizierten PET/CT ist.
Auch eine Bildfusion von PET-Aufnahmen mit MRT-Bildern ist möglich, was u. a. in der Strahlentherapie genutzt wird.
Time of Flight
Bereits seit den frühen 1980er Jahren wird an dieser Methode zur Steigerung des Signal-Rausch-Abstands geforscht.[41] Philips war im Jahr 2006 der erste Hersteller, der beim Gemini-TF dieses Messprinzip bei einem klinischen PET/CT-System für die Diagnostik am Menschen nutzte.[42][43] Am EANM 2008 wurde von Siemens mit dem Biograph mCT ein PET/CT-System vorgestellt, für das ab Ende 2009 die TOF-Messung verfügbar war.[44] Im Rahmen des SNM 2009 stellte General Electric mit dem Discovery 690 ebenfalls ein mit der Time-of-Flight-Technik arbeitendes Gerät vor.[45]
Hybridgerät aus PET und MRT
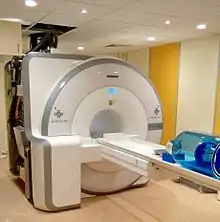
Als relativ junge Entwicklung ist die Kombination von PET und MRT in einem gemeinsamen Gerät als neue diagnostische Methode für den klinischen Einsatz etabliert worden. Eines der ersten Hybridgeräte aus PET und MRT mit einer magnetischen Flussdichte von 3 Tesla wurde bereits 2007 im Forschungszentrum Jülich installiert; 2009 wurde dort ein Hybridgerät mit einer Flussdichte von 9,4 Tesla in Betrieb genommen.[46] An der Universität Tübingen ist seit Mitte 2007 ebenfalls ein solches PET/MRT-Hybridgerät im Einsatz, das für die Hirndiagnostik verwendet wird.[47] Der nächste Schritt, nämlich der Einsatz der kombinierten PET/MRT auch für Ganzkörperuntersuchungen wurde von Philips und Siemens beschritten, die entsprechende Geräte erstmals auf dem RSNA 2010 zeigten und in München, Tübingen bzw. Dresden installierten.[48] Sie ermöglichten kombinierte PET/MRT-Untersuchungen durch eine vollständige Integration von PET und MRT (Siemens) oder durch die Nutzung einer gemeinsamen Patientenliege, welche zwischen den zwei in einem Abstand von knapp 3 Metern installierten Tomographen montiert war (Philips). Diese Patientenliege positionierte den Patienten sukzessiv in beiden Tomographen. Das Gesamtsystem ermöglichte sodann durch Nutzung entsprechender Software kombinierte PET/MRT-Untersuchungen ohne die Notwendigkeit zur Repositionierung des Patienten. Der bei diesem Verfahren inhärente geringe Zeitversatz (etwa 10 Minuten) zwischen den PET- und MRT-Untersuchungen (sequentielle Bildgebung) wurde hierbei für viele Fragestellungen, vor allem im onkologischen Bereich, als irrelevant betrachtet. Insbesondere für spezielle neurologische und kardiologische Fragen ist es allerdings von Vorteil, beide Untersuchungen möglichst synchron durchzuführen, wie es mit einem vollintegrierten PET/MR-Gerät möglich ist[49]. Zwischenzeitlich wurde das teilintegrierte Geräte-Konzept verlassen; die aktuell von Siemens Healthineers und GE Healthcare verfügbaren PET/MR-Geräte der zweiten Generation sind ausschließlich vollintegriert.
Bei simultan messenden PET/MR-Systemen können die normalerweise in PET-Scannern eingesetzten Photomultiplier aufgrund des für die MR-Bildgebung nötigen Magnetfelds nicht verwendet werden; für die Detektion der PET-Signale werden daher Avalanche-Photodioden[50] oder Silizium-Photomultiplier (SiPM) eingesetzt. Silizium-Photomultiplier sind aufgrund ihrer physikalischen Eigenschaften auch für die Anwendung der Time-of-Flight-Technik geeignet.
Die CT-Bilddaten einer PET/CT sind unter anderem die Grundlage für die Streustrahlungs- und Absorptionskorrektur. Hounsfield-Einheiten sind letztlich Schwächungseinheiten, die über Lookup-Tabellen den Absorptionskoeffizienten der 511-keV-Photonen zugeordnet werden können.
Herausforderungen bei der Konstruktion eines PET/MR-Gerätes bestehen daher u. a. auch darin, diese Information aus einem MR-Bild abzuleiten und die PET-Strahlung ohne Leistungseinbußen des Gesamtsystems abzuschirmen.[51]
Die Kombination der Modalität CT mit der Modalität PET führte dazu, dass sich die Gesamt-Aufnahmezeit drastisch verkürzte, die Bildqualität der PET-Aufnahme erheblich verbesserte und die Überlagerung der beiden Bilder im klinischen PET-Hauptanwendungsgebiet – der Onkologie – einen signifikanten diagnostischen Mehrwert bedeutete.
Die Akquisition von MRT-Bilddaten erfordert eine erheblich längere Akquisitionsdauer als Computertomographien, sodass zunächst vermutet wurde, dass die Kombination PET/MR durch die damit verbundene Verlängerung der Untersuchung im Vergleich zur PET/CT einen Rückschritt darstellen und die Anwendung in der Praxis beeinträchtigen würde. Bei simultaner Aufnahmetechnik erhöht aber die für die MRT benötigte Zeit auch die für die PET nutzbare Aufnahmezeit, was zu einer deutlichen Qualitätsverbesserung der PET genutzt werden kann und auch Aussagen zur zeitabhängigen Verteilung im abgebildeten Volumen erlaubt. Zusätzlich wurden Verfahren entwickelt, bei denen die in der MRT aufgezeichnete Ortskodierung zur Bewegungskorrektur der PET-Aufnahmen genutzt werden. Fortschritte in der Sequenzentwicklung der MRT für Ganzkörperaufnahmen haben dazu geführt, dass der relative Nachteil hinsichtlich der Gesamt-Aufnahmezeit verkleinert werden konnte. Insbesondere bei Fragestellungen, für welche eine MRT ohnehin indiziert und geplant wird, bietet die Kombinationsuntersuchung einen Zeit- und auch Kostenvorteil im Vergleich zu getrennten Untersuchungen. Da die integrierte PET/MR im Gegensatz zur PET/CT eine zeitgleiche Untersuchung beider Modalitäten ermöglicht, besteht hier insbesondere bei der Abbildung von bewegten Organen (Herz, Lunge, Leber, Darm) ein klinisch relevanter Vorteil.
Forschungsthemen
Trotz der langen Historie der PET wird weltweit an der Verbesserung des Verfahrens gearbeitet.
Aktuelle Forschungen:
- Durch die verhältnismäßig langen Aufnahmezeiten, die selbst bei modernen Geräten bei 15 bis 30 Minuten liegen, lässt sich die Bewegung der Patienten im Scanner nicht verhindern. Im Bereich des Thorax findet aufgrund von Atmung und Herzschlag praktisch immer Bewegung statt. Wegen der stetig steigenden Ortsauflösung neuer Positronen-Emissions-Tomographen wird dieses Problem immer auffälliger, denn die Bilder sehen stellenweise verwackelt aus. Es gibt daher weltweit immer mehr Forschungsgruppen, die sich diesem Thema widmen und versuchen, mit Hilfe von Bewegungserfassungssystemen (sog. Motion-Tracking) die Bewegung des Patienten während der Untersuchung aufzuzeichnen, um anschließend die Rohdaten der Aufnahme so zu modifizieren, dass nahezu bewegungsfreie Schnittbilder erzeugt werden können.[52][53][54] Es gibt auch einige Verfahren, die gänzlich ohne Bewegungserfassungssysteme auskommen.[55][56]
- Bei der kombinierten simultanen PET/MRT-Bildgebung für Kleintiere finden derzeit Forschungen zu neuen Detektortechnologien und Integrationskonzepten statt.[57][58] Ziele sind hierbei die Steigerung der Orts- und Zeitauflösung, der Sensitivität sowie die Vermeidung der auftretenden Interferenz im Falle simultaner PET-MRT-Bildgebung. Hierzu sind die Forschungen der EU-FP7-geförderten Projekte HYPERImage, SUBLIMA und das vom EU-NRW-Ziel-2-Programm geförderte Projekt ForSaTum zu nennen, die prototypische Scanner mit analogen und digitalen Silizium-Photomultipliern (SiPMs) realisiert haben.
- Experimentelle Entwicklungen zur Steigerung der Ortsauflösung von PET sind – bisher nur anwendbar für kleine Tiergehirne (Ratten) – bis zur praktischen Anwendung fortgeschritten; hier ist zum Beispiel die internationale Zusammenarbeit von Forschungsinstituten im Rahmen der Crystal Clear Collaboration zu nennen. Diese vom CERN beherbergte Kollaboration zur Entwicklung von Detektoren für die Hochenergiephysik hat im Rahmen von Technologietransferprojekten eine neue Generation von Scannern, darunter ClearPET und ClearPEM, entwickelt. Ortsauflösungen von etwa < 1,6 mm sind erreichbar.[59][60][61]
- Im Rahmen der Partikeltherapie ist es wünschenswert, die genaue Energieabgabe an den Patienten zu überwachen. Dies soll vor allem Fehlbestrahlungen vermeiden. Während der Bestrahlung kommt es zur Kernfragmentation im Gewebe und als Folge zur Erzeugung prompter Teilchen, darunter auch Positronenemittern. Diese können mit einem geeigneten, während der Bestrahlung eingesetzten PET-Gerät gemessen werden. Das so gewonnene Bild liefert Information über die Position der Positronenemitter und somit auch der Kernfragmentation, welche Rückschlüsse auf den Ort der Energieabgabe erlaubt.
Potential der Technologie
Einer der limitierenden Faktoren heutiger PET ist die geringe Sensitivität aktueller Systeme. Im Kapitel Sensitivität wurde beschrieben, dass die besten PET-Geräte im Jahr 2010 Sensitivitätswerte von knapp zehn Zählschritte pro Sekunde und Kilobecquerel erreichten. Dies bedeutet, dass von 1000 Annihilationen in Detektornähe lediglich zehn erfasst werden, was einer Ausbeute von einem Prozent entspricht. Das Verhältnis der gemessenen Aktivität zur gesamten Patientenaktivität liegt gar im Bereich von weit unter 1 ‰, denn es werden ja immer nur die Ereignisse gemessen, die sich im Gesichtsfeld des Detektors befinden. Es ist anzunehmen, dass künftig eine schnellere Echtzeitsignalverarbeitung und ein erweitertes Gesichtsfeld zum Einsatz kommen werden. Dies wird die Sensitivität und den Signal-Rausch-Abstand der Geräte weiter steigern, was den Einsatz von schwach anreichernden und kurzlebigen Tracern erlaubt sowie die Untersuchungszeit erheblich senkt.
Eine solche Erweiterung des Gesichtsfelds kann durch die Verwendung von zweckbestimmten Systemen geschehen, welche nahe am zu untersuchenden Organ angebracht sind. Dies ist zum Beispiel bei der Positronenemissionsmammographie (PEM) der Fall. Der einzige aktuell kommerziell erhältliche Positronenemissionsmammograph, Naviscan Flex, erreicht so eine normalisierte Sensitivität von 0,15 %.[62] Von konkurrierenden Designs sowie in der Entwicklung befindlichen Hirn- oder Prostatascannern werden ähnliche oder bessere Leistungen erwartet. Eine andere Möglichkeit wäre die Erweiterung des axialen Gesichtsfelds eines Ganzkörperscanners. Das Hauptproblem besteht dabei in der großen Anzahl zu verwendender Detektoren und in der Folge auszulesender Kanäle, welche mit aktueller Technik nicht kosteneffizient bewältigbar ist. Weiter müsste das Problem der vermehrt zu erwartenden Streukoinzidenzen gelöst werden. Im Februar 2007 wurde zum Beispiel Dario Crosetto ein Patent für eine solche Technik zugesprochen, bei der das axiale Gesichtsfeld auf rund 120 cm (statt der heute üblichen 15 bis 20 cm) erweitern würde. Er beschreibt darin ebenfalls eine neue Detektorelektronik, welche im Falle technischer Machbarkeit die oben beschriebenen Probleme bewältigen könnte.[63][64]
Im Jahre 2018 wurde von der Universität Kalifornien, Davis (UCDavis) ein Ganzkörperscanner vorgestellt. Neben einer im Vergleich zu konventionellen Systemen 20 bis 40-fach höheren Sensitivität (je nach Vergleichsmaßstab) bietet er auch eine räumliche Auflösung im Bereich von und unter 3 mm, sowie die Möglichkeit, dynamische PET Aufnahmen anzufertigen, die die Verteilung und die Anreicherung des Tracers über den gesamten Körper zeigen. Außerdem kann man mit dem Gerät auch noch zehn Stunden nach Injektion des Tracers Bilder mit diagnostisch verwertbarer Aussagekraft gewinnen. Mit Hilfe von 500.000 Detektorelementen deckt er ein Gesichtsfeld von 1,94 m Länge ab.[65]
Forschungseinrichtungen
Im deutschsprachigen Raum befasst man sich u. a. in folgenden nicht-universitären Forschungseinrichtungen mit der Weiterentwicklung und den Grenzen der PET:
- Deutsches Krebsforschungszentrum Heidelberg
- Forschungszentrum Jülich, Physik der Medizinischen Bildgebung (INM-4)
- Helmholtz-Zentrum Dresden-Rossendorf
- Max-Planck-Institut für neurologische Forschung
Ähnliche Verfahren
Literatur
- O. Schober, W. Heindel: PET-CT. Georg Thieme Verlag, 2007, ISBN 3-13-143221-7.
- J. Ruhlmann u. a.: PET in der Onkologie: Grundlagen und klinische Anwendung. Springer, 1998, ISBN 3-540-64632-9.
- K. Wienhard u. a.: PET: Grundlagen und Anwendungen der Positronen-emissions-tomographie. Springer, 1989, ISBN 0-387-19451-7.
- E. E. Kim u. a. (Hrsg.): Clinical Pet: Principles and Applications. Springer 2004, ISBN 0-387-40854-1.
- Marcus Bauser, Lutz Lehmann: Positronen-Emissions-Tomographie. In: Chemie in unserer Zeit. Band 46, Nr. 2, 2012, S. 80–99, doi:10.1002/ciuz.201200564.
- M. Vogel: Blick in den Körper. In: Physik Journal. Band 15, Nr. 1, 2016, S. 42–43. (Guter, kompakter Übersichtsartikel)
Weblinks
- PET – Positronenemissionstomographie: Ein Blick in den Stoffwechsel. Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg. 17. Mai 2010. Abgerufen am 4. September 2014.
- PET – modernes Diagnose-Verfahren im Kampf gegen Krebs. Deutsche Gesellschaft für Nuklearmedizin e. V. und Berufsverband Deutscher Nuklearmediziner e. V. (PDF; 369 kB)
- Möglichkeiten und Grenzen der PET-Tumor-Diagnostik
- PET-Standort in der Nähe finden. Deutsche Gesellschaft für Nuklearmedizin
- Nuclear Medicine Information – PET Themensammlung (englisch)
Einzelnachweise
- Bernd J. Krause, Andreas K. Buck, Markus Schwaiger: Nuklearmedizinische Onkologie. ecomed Medizin, 2007, ISBN 978-3-609-76308-8, S. 20.
- Siehe Technik der Positronen-Emissions-Tomographie, Abschnitt Korrektur der Messdaten, Unterabschnitt Absorptionskorrektur
- L. Geworski: Voraussetzungen für die Quantifizierung in der Emissions-Tomographie. Habilitationsschrift, Humboldt-Universität zu Berlin, 2003.
- H. Herzog: Methods and applications of positron-based medical imaging. In: Radiation Physics and Chemistry. Band 76, Nr. 2, 2007, S. 337–342, doi:10.1016/j.radphyschem.2006.03.063.
- Bryce J. B. Nelson, John Wilson, Susan Richter, M. John M. Duke, Melinda Wuest: Taking cyclotron 68Ga production to the next level: Expeditious solid target production of 68Ga for preparation of radiotracers. In: Nuclear Medicine and Biology. Band 80-81, 1. Januar 2020, ISSN 0969-8051, S. 24–31, doi:10.1016/j.nucmedbio.2020.01.005 (sciencedirect.com [abgerufen am 29. Mai 2020]).
- Website der Klinik für Nuklearmedizin der Universität Ulm
- Artikel in medscape.com
- Jens Cardinale, René Martin, Yvonne Remde et al.: Procedures for the GMP-Compliant Production and Quality Control of [18F]PSMA-1007: A Next Generation Radiofluorinated Tracer for the Detection of Prostate Cancer. In: MDPI.com. Pharmaceuticals 2017, 10(4), 77, 27. September 2017, abgerufen am 22. November 2018.
- Schwenck, J. Rempp, H. Reischl, G. et al.: Comparison of 68Ga-labelled PSMA-11 and 11C-choline in the detection of prostate cancer metastases by PET/CT. In: European Journal of Nuclear Medicine and Molecular Imaging. Volume 44, Nr. 1, Januar 2017, S. 92–101.
- Amyvid now approved by European regulators. In: Dotmed.com, 16. Januar 2013.
- Gallium-68 Peptiddiagnostika. DKFZ
- Leitlinien. Website der Deutschen Gesellschaft für Nuklearmedizin, abgerufen am 25. November 2013
- Fachinformationen. Website des PET Zentrums des Universitätsklinikums Ulm
- PET-CT Zentrum Linz (Memento vom 27. Februar 2011 im Internet Archive)
- Angela Aldin, Lisa Umlauff, Lise J Estcourt, Gary Collins, Karel GM Moons: Interim PET-results for prognosis in adults with Hodgkin lymphoma: a systematic review and meta-analysis of prognostic factor studies. In: Cochrane Database of Systematic Reviews. 13. Januar 2020, doi:10.1002/14651858.CD012643.pub3 (wiley.com [abgerufen am 16. Juli 2020]).
- P. D. Shreve u. a.: Pitfalls in Oncologic Diagnosis with FDG PET Imaging: Physiologic and Benign Variants. In: Radiographics 19/1999, S. 61–77. PMID 9925392
- Usefulness and limits of the SUV for tumor characterisation and patient monitoring in FDG/PET (PDF; 4,3 MB)
- Strahlenschutz bei der Anwendung der Positronen-Emissions-Tomographie/Computer-Tomographie (PET/CT); Stellungnahme der Strahlenschutzkommission (Memento vom 14. Januar 2012 im Internet Archive) (PDF 850 kB).
- Bekanntmachung der diagnostischen Referenzwerte für radiologische und nuklearmedizinische Untersuchungen vom 10. Juli 2003. Bundesamt für Strahlenschutz (PDF; 84 kB)
- Peter Hien: Praktische Pneumologie. Springer DE, 1. Januar 2012, ISBN 978-3-642-10209-7, S. 421.
- Website der Klinik für Nuklearmedizin der Universität Ulm.
- Hirsch, FW et al.: PET/MR in children. Initial clinical experience in paediatric oncology using an integrated PET/MR scanner. doi:10.1007/s00247-012-2570-4.
- Die Positronen-Emissions-Tomografie (PET) (Memento vom 3. März 2006 im Internet Archive) (PDF; 893 kB) Diagnoseklinik München, S. 7. (2006).
- C. Plathow, M. Walz, M. P. Lichy, P. Aschoff, C. Pfannenberg, H. Bock, S. M. Eschmann, C. D. Claussen, H. P. Schlemmer: Kostenüberlegungen zur Ganzkörper-MRT und PET-CT im Rahmen des onkologischen Stagings. In: Der Radiologe. Band 48, Nr. 4, 20. September 2007, S. 384–396, doi:10.1007/s00117-007-1547-z, PMID 17891370.
- Richtlinie Methoden vertragsärztliche Versorgung (PET beim kleinzelligen Lungenkarzinom). Gemeinsamer Bundesausschuss
- PET/Computertomographie (CT) bei malignen Lymphomen. Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden Krankenhausbehandlung (PDF; 240 kB).
- Beschluss des Bewertungsausschusses nach § 87 Abs. 1 Satz 1 SGB V in seiner 369. Sitzung am 15. Dezember 2015 zur Änderung des Einheitlichen Bewertungsmaßstabes (EBM) mit Wirkung zum 1. Januar 2016.
- Qualitätssicherung: Vereinbarung zu PET und PET/CT angepasst, KBV. Abgerufen am 14. Februar 2018.
- Abschnitt 34.7 „Diagnostische Positronenemissionstomographie (PET), Diagnostische Positronenemissionstomographie mit Computertomographie (PET/CT)“ in EBM aufgenommen., KBV, 1. Januar 2016. Abgerufen am 14. Februar 2018.
- Sally F. Barrington, Michael N. Maisey, Richard L. Wahl: Atlas of Clinical Positron Emission Tomography. Second Edition, Hodder Arnold 2006, S. 24, 25 ISBN 0-340-81693-7
- Igle J. de Jong, MD1,2, Jan Pruim, PhD2, Philip H. Elsinga, PhD2, Willem Vaalburg, PhD2, Han J. Mensink, PhD1, Department of Urology: Preoperative Staging of Pelvic Lymph Nodes in Prostate Cancer by 11C-Choline PET. 2 PET Center, Groningen University Hospital, Groningen, The Netherlands
- Die PSMA-PET/CT Website des Bundesverbandes Prostatakrebs Selbsthilfe e.V.
- Paul Shreve, David W. Townsend: Clinical PET-CT in Radiology Integrated Imaging in Oncology Springer Science+Business Media, LLC 2011 ISBN 978-0-387-48900-1, Chapter 32: PET-CT of Bone Metastases, by James A.Scott and Edwin L. Palmer
- Michel M. Ter-Pogossian, Michael E. Phelps, Edward J. Hoffman, Nizar A. Mullani: A Positron-Emission Transaxial Tomograph for Nuclear Imaging (PETT). In: Radiology. Band 114, Nr. 1, 1975, S. 89–98, doi:10.1148/114.1.89.
- Michael E. Phelps, Edward J. Hoffman, Nizar A. Mullani, Michel M. Ter-Pogossian: Application of Annihilation Coincidence Detection to Transaxial Reconstruction Tomography. In: J Nucl Med. Band 16, Nr. 3, 1. Februar 1975, S. 210–224 (Abstract [abgerufen am 19. Februar 2011]).
- Derek Lowe, Das Chemiebuch, Librero 2017, S. 450
- Epileptologie-bonn.de (PDF)
- Gordon L. Brownell: A history of positron imaging (Memento vom 18. Dezember 2011 im Internet Archive) (PDF; 997 kB).
- Im Jahr 1998 bewilligtes Projekt: Positronen-Emissions-Scanner. (Memento des Originals vom 2. Dezember 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Gebert-Rüf Stiftung, abgerufen 25. November 2013.
- Ronald Nutt erhält Ehrendoktorwürde für seine Forschungen zur PET. Pressemeldung der DGN, 2008.
- Michael Haas: PET Evens the Score in PET/CT. In: Imaging Technology News, Juli/August 2007.
- Gemini TF auf der Website von Philips Medizin Systeme
- Performance of Philips Gemini TF PET/CT Scanner with Special Consideration for Its Time-of-Flight Imaging Capabilities.
- Website von Siemens Medical.
- Discovery PET/CT 690 for Exploration. (Memento vom 2. Dezember 2013 im Internet Archive) ITN, 16. Juni 2009.
- "9komma4" – ein Tomograf der Extraklasse. In: Deutsche Welle online, 29. April 2009, abgerufen 25. November 2013.
- Informationsdienst der Wissenschaft Online
- Pressemeldung Auntminnie-Meldung.
- Presseinformation Klinikum rechts der Isar und Siemens AG (PDF; 656 kB).
- Dan Harvey: Simultaneous Acquisition – A PET Detector Inside an MRI Bore Makes It Feasible. (Memento vom 22. April 2008 im Internet Archive) Radiology Today 8 (3):16, 12. Februar 2007.
- Thorsten M. Buzug, Dietrich Holz, Jens Bongartz, Matthias Kohl-Bareis, Ulrich Hartmann, Simone Weber: MRI Based Attenuation Correction for Brain PET Images. In: Advances in Medical Engineering. Band 114. Springer, Berlin/Heidelberg 2007, ISBN 978-3-540-68763-4, S. 93–97, doi:10.1007/978-3-540-68764-1_15.
- Helmholtz-Zentrum Dresden-Rossendorf: Korrektur von Kopfbewegungen in der PET (Memento vom 24. Februar 2013 im Internet Archive)
- Motion-free PET: Compensating for patient respiration in whole-body PET/CT imaging (Memento des Originals vom 18. Februar 2009 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis..
- Feng Qiao, Tinsu Pan, John Clark, Osama Mawlawi: Anatomy based PET image reconstruction for a motion influenced volume. Rice University, Houston, Texas; MD Anderson Cancer Center, Houston, Texas.
- Ralph A. Bundschuh, Axel Martinez-Moeller, Markus Essler, Maria-Jose Martinez, Stephan G. Nekolla, Sibylle I. Ziegler, Markus Schwaiger: Postacquisition Detection of Tumor Motion in the Lung and Upper Abdomen Using List-Mode PET Data: A Feasibility Study. In: J Nucl Med. Band 48, Nr. 5, 1. April 2007, S. 758–763, doi:10.2967/jnumed.106.035279.
- R. Brinks, M. Busch: Local Compensation for Respiratory Motion in List-mode PET. In: Th. Buzug, et al.: Advances in Medical Engineering. Springer Proceedings in Physics. 2007.
- Volkmar Schulz, Bjoern Weissler, Pierre Gebhardt, Torsten Solf, Christoph W. Lerche, Peter Fischer, Michael Ritzert, V. Mlotok, Claudio Piemonte, B. Goldschmidt, S. Vandenberghe, A. Salomon, T. Schaeffter, P. K. Marsden: SiPM based preclinical PET/MR insert for a human 3T MR: first imaging experiments. In: Nuclear Science Symposium and Medical Imaging Conference (NSS/MIC), IEEE. Oktober 2011, S. 4467–4469, doi:10.1109/NSSMIC.2011.6152496.
- Jakob Wehner, Bjoern Weissler, Peter Dueppenbecker, Pierre Gebhardt, David Schug, Walter Ruetten, Fabian Kiessling, Volkmar Schulz: PET/MRI insert using digital SiPMs: Investigation of MR-compatibility. In: Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 734, Teil B, 11. Januar 2014, S. 116–121, doi:10.1016/j.nima.2013.08.077.
- ClearPET offers improved insight into animal brains. In: CERN Courier. Band 45, Nr. 6, Juli/August 2005, S. 27, 28.
- The Crystal Clear Collaboration. – von „High Energy Physics“ zu „Medical Imaging“
- GATE – Geant4 Application for Emission Tomography.
- Weidong Luo, Edward Anashkin, Christopher G. Matthews: Performance Evaluation of a PEM Scanner Using the NEMA NU 4 – 2008 Small Animal PET Standards. In: IEEE Transactions on Nuclear Science. 57, 2010, S. 94–103, doi:10.1109/TNS.2009.2036847.
- Patent US7180074: Method and apparatus for whole-body, three-dimensional, dynamic PET/CT examination. Veröffentlicht am 20. Februar 2007, Erfinder: Dario B. Crosetto.
- D. B Crosetto: The 3D complete body screening (3D-CBS) features and implementation. In: Nuclear Science Symposium Conference Record, 2003 IEEE. Band 4, 2004, ISBN 0-7803-8257-9, S. 2415–2419, doi:10.1109/NSSMIC.2003.1352382.
- Explorer der UCLA Davis