Elektrochemie
Elektrochemie bezeichnet mehrere verschiedene Teilgebiete innerhalb der Chemie. Sie ist zum einen eine Synthesemethode, präparative Elektrochemie oder Elektrolyse oder Elektrosynthese, zum anderen ist sie ein Teilgebiet der Physikalischen Chemie, welches sich mit dem Zusammenhang zwischen elektrischen und chemischen Vorgängen befasst. Weiterhin gibt es elektrochemische Methoden in der Analytischen Chemie. Die Technische Chemie kennt neben großtechnisch angewandten elektrochemischen Synthesemethoden noch die Batterie- und Brennstoffzellentechnik sowie die Galvanotechnik. Wie schnell elektrochemische Prozesse ablaufen wird durch die Elektrochemische Kinetik beschrieben.

Inhalt
Wenn eine chemische Reaktion mit einem elektrischen Strom verknüpft ist, so ist dies ein elektrochemischer Vorgang. Entweder wird die Redoxreaktion durch eine von außen angelegte elektrische Spannung erzwungen (Elektrolyse), oder es wird durch die chemische Reaktion geeigneter Substanzen eine messbare Spannung hervorgerufen (galvanisches Element). Diese Spannungen sind charakteristisch für die jeweiligen Reaktionen und sind auf einer Skala dokumentiert, der elektrochemischen Spannungsreihe. Der direkte Elektronenübergang zwischen Molekülen, Ionen oder Atomen ist kein elektrochemischer Vorgang; typisch für die Elektrochemie ist die räumliche Trennung von Oxidation und Reduktion.
Elektrochemische Reaktionen laufen in einer galvanischen Zelle ab und immer als Redoxreaktionen. Bei der Elektrolyse und dem Aufladen eines Akkumulators wird dabei Energie zugeführt, beim Entladen einer Batterie oder bei Stromentnahme aus einer Brennstoffzelle erhält man elektrische Energie, die bei reversiblen Prozessen der Reaktionsenthalpie entspricht.
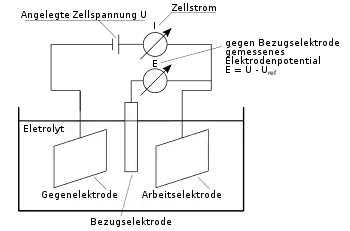
Der bei solchen Reaktionen auftretende Strom ist eine leicht zu erfassende Kenngröße, die zur Kontrolle sehr wertvoll ist. Es wird oft eine Strom-Spannungs-Kennlinie aufgenommen, die den gemessenen Strom bei Variation der Spannung darstellt. Die Gestalt einer solchen Kennlinie hängt neben den üblichen Reaktionsparametern (Konzentration der beteiligten Stoffe, Temperatur, Größe der reaktiven Grenzflächen) auch von der Geschwindigkeit der Spannungsveränderung ab.
Die für die Elektrochemie entscheidenden Redox-Vorgänge laufen dabei an der Phasengrenze Elektrode-Elektrolyt ab. Man kann daher definieren: Elektrochemie ist die Wissenschaft der Vorgänge an der Phasengrenze zwischen einem Elektronenleiter (Elektrode) und einem Ionenleiter (Elektrolyt).
Geschichte


Einen wichtigen Anstoß zur Entwicklung der Elektrochemie gaben die Versuche von Luigi Galvani mit Froschschenkeln: die Muskeln kontrahierten, wenn sie mit verschiedenen Metallen Kontakt hatten. Alessandro Volta stellte 1799 die erste funktionierende Batterie der Neuzeit her. Diese war – lange vor der Entwicklung des Generators – eine äußerst wichtige Strom- und Spannungsquelle, die viele bedeutsame Entdeckungen ermöglichte, besonders auch die erstmalige Darstellung der Metalle Natrium, Kalium, Barium, Strontium, Calcium und Magnesium in den Jahren 1807 und 1808 durch Humphry Davy.
Johann Wilhelm Ritter lieferte Ende des 18. Jahrhunderts wichtige Beiträge zum Thema Galvanismus und konstruierte einen einfachen Akkumulator. Michael Faraday, der die Begriffe Elektrode, Elektrolyt, Anode, Kathode, Anion und Kation einführte, entdeckte 1832 die Grundgesetze der Elektrolyse. Im Jahr 1959 erhielt Jaroslav Heyrovský für die Entwicklung eines elektrochemischen Analyseverfahrens, der Polarographie, den Nobelpreis für Chemie.
Schon in den Jahren 1887/1894 erkannte Wilhelm Ostwald, dass leistungsfähige Brennstoffzellen für die Energieversorgung ein gewaltiges Zukunftspotential bieten müssten. Zu den wichtigen Entwicklungen des 20. Jahrhunderts gehört dementsprechend die Fortentwicklung der Brennstoffzelle, zunächst vor allem für Anwendungen im Weltraum: Für das Apollo-Programm, das 1969 zur Mondlandung führte, wurden Wasserstoff-Brennstoffzellen entwickelt, die auch trinkbares Wasser für die Astronauten lieferten. Auch im Space Shuttle dienten Wasserstoff-Brennstoffzellen zur Stromversorgung.
Anwendungen
- Herstellung chemischer Substanzen
- Reduktion von Metallsalzen zur Herstellung unedler Metalle, vor allem durch Schmelzelektrolyse, z. B. zur Herstellung von Lithium, Natrium, Kalium, Calcium, Magnesium und Aluminium
Der elektrische Strom wirkt hier als Reduktionsmittel. Da die Spannung variiert werden kann, kann die Reduktionskraft angepasst werden. Der elektrische Strom ist das stärkste Reduktionsmittel der Chemie, mit dem auch die Kationen der unedelsten Metalle reduziert werden können.
Die elektrolytische Metallabscheidung wird auch in der Galvanotechnik genutzt. - Oxidation von Anionen, z. B. von Halogeniden, etwa zur Herstellung von Fluor und Chlor in der Chloralkalielektrolyse
- Der elektrische Strom erlaubt Redoxreaktionen ohne die Zugabe von Reduktions- oder Oxidationsmitteln. Viele weitere Redoxreaktionen können daher elektrolytisch besonders elegant ausgeführt werden oder werden erst ermöglicht. Erwähnt seien in der präparativen organischen Elektrochemie die Elektrofluorierung, die Dimerisierung von Acrylnitril zu Adipodinitril oder die Kolbe-Elektrolyse. Früher war außerdem die elektrochemische Grignard-Reaktion zur Herstellung von Bleitetraethyl von Bedeutung.[1]
- Herstellung von Ozon-Sauerstoff-Gemischen durch Elektrolyse bei hohen Stromdichten
- Die Herstellung von Wasserstoff z. B. durch Elektrolyse von Wasser oder als zweites Produkt der Chloralkalielektrolyse
- Reduktion von Metallsalzen zur Herstellung unedler Metalle, vor allem durch Schmelzelektrolyse, z. B. zur Herstellung von Lithium, Natrium, Kalium, Calcium, Magnesium und Aluminium
- Galvanotechnik zur Herstellung metallischer Überzüge

- Bereitstellung einer elektrischen Spannung, vor allem für mobile Anwendungen, in
- Galvanische Zellen (Monozellen)
- Batterien
- Akkumulatoren
- Brennstoffzellen
- Verwendung des elektrischen Stroms bzw. Messung des Potentials bei der Durchführung von chemischen Analysen und Untersuchungen: elektrochemische Analyse, vor allem
- Voltammetrie, z. B. die Cyclovoltammetrie sowie die Polarographie, die eine Voltammetrie an einer Quecksilbertropfelektrode ist
- Amperometrie, z. B. die Bestimmung einer Sauerstoffkonzentration mit einer Clark-Elektrode oder die elektrochemischen kontinuierlichen Glucosesensoren
- Potentiometrie; dazu zählen auch Untersuchungen mit ionenselektiven Elektroden, z. B. die pH-Elektrode, die fluoridselektive Elektrode und die kaliumselektive Elektrode
- Coulometrie, z. B. auch zur empfindlichen Bestimmung von Wasser mit dem coulometrischen Karl-Fischer-Verfahren
- Elektrogravimetrie, vor allem zur reduktiven Bestimmung von Metallionen wie Cu2+
- Auch an elektrochemischen DNA-Biosensoren und elektrochemischen DNA-Sequenzierungen wird geforscht.
- Elektrochemische Impedanzspektroskopie
- Untersuchungen zur Thermodynamik und zum Mechanismus von Reaktionen, wichtig auch für die Korrosionsforschung
Siehe auch
Literatur
- Peter W. Atkins, Physikalische Chemie, Wiley-VCH, ISBN 3-527-30236-0.
- Carl H. Hamann, Wolf Vielstich, Elektrochemie, 4. Auflage, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31068-5.
- Wolfgang Schmickler, Grundlagen der Elektrochemie, Springer 1996.
- Wolfgang-Dieter Luz, Eberhard Zirngiebl: Die Zukunft der Elektrochemie, Chemie in unserer Zeit, 23. Jahrg. 1989, Nr. 5, S. 151–160, ISSN 0009-2851.
- Kurt Schwabe, Elektrochemie, Akademie-Verlag, Berlin 1974, 1975, 1986
- Gustav Kortüm, Lehrbuch der Elektrochemie, 4. Auflage, Verlag Chemie, Weinheim 1966.
Weblinks
Einzelnachweise
- Wolfgang-Dieter Luz, Eberhard Zirngiebl: Die Zukunft der Elektrochemie. Einige Betrachtungen aus der Sicht der Industrie. In: Chemie in unserer Zeit. Band 23, Nr. 5. VCH Verlagsgesellschaft, John Wiley & Sons, Oktober 1989, ISSN 0009-2851, S. 151–160, doi:10.1002/ciuz.19890230503 (wiley.com).