Kryptondifluorid
Kryptondifluorid ist eine instabile chemische Verbindung aus Krypton und Fluor. Es ist eine der wenigen bekannten Kryptonverbindungen und die erste synthetisierte Verbindung dieses Edelgases.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||
| Name | Kryptondifluorid | |||||||||
| Andere Namen |
Krypton(II)-fluorid | |||||||||
| Summenformel | KrF2 | |||||||||
| Kurzbeschreibung |
instabiler farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 121,79 g·mol−1 | |||||||||
| Aggregatzustand |
fest (nur bei tiefen Temperaturen stabil)[1] | |||||||||
| Dichte |
3,24 g·cm−3[2] | |||||||||
| Sublimationspunkt | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 |
15 kJ/mol (Gas)[4] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Hergestellt wird Kryptondifluorid bei −196 °C mithilfe elektrischer Entladungen aus elementarem Krypton und Fluor in einer mit 60 kJ/mol endothermen Reaktion. Weitere Gewinnungsmöglichkeiten sind die UV-Photolyse und das Beschießen von Krypton/Fluor-Mischungen mit Protonen. Dabei entstehen jeweils Fluor-Radikale, die in der Lage sind, mit Krypton zu reagieren.[1]
Eigenschaften
Chemische Eigenschaften
Kryptondifluorid ist instabil und zersetzt sich bei Raumtemperatur innerhalb weniger Tage. Bei 77 °C sublimiert die Verbindung unter schneller Zersetzung. Bei −78 °C kann die Verbindung unbegrenzt gelagert werden. Mit Wasser und organischen Verbindungen reagiert Kryptondifluorid explosiv.[1]
Kryptondifluorid ist ein starkes Oxidationsmittel, es kann Xenon in Xenonhexafluorid oder Iod in Iodpentafluorid überführen. Darüber hinaus ist es auch ein Fluoridionen-Donator.[5] Das Kation KrF+ ist das bisher stärkste bekannte Oxidationsmittel, stärker noch als Sauerstoffdifluorid und elementares Fluor. Es vermag als einzig bekannte Substanz Gold in die Oxidationsstufe +5 zu bringen:[6][5]
Molekülgeometrie
Gemäß dem VSEPR-Modell besitzt das Kryptondifluorid-Molekül eine lineare Struktur mit einem Bindungswinkel (F–Kr–F) von etwa 180°. Im gasförmigen Zustand beträgt die Bindungslänge 188,9 pm.[5]
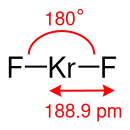
Kryptondifluorid besitzt als Molekülsymmetrie die Punktgruppe D∞h.[7]
Siehe auch
Weblinks
Einzelnachweise
- John F. Lehmann, Hélène P. A. Mercier, Gary J. Schrobilgen: The chemistry of krypton. In: Coordination Chemistry Reviews. 2002, 233/234, S. 1–39, doi:10.1016/S0010-8545(02)00202-3.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-69.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 9. Auflage. Walter de Gruyter GmbH, Berlin 2015, ISBN 978-3-11-035526-0, S. 416.
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 469 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche). (abgerufen über De Gruyter Online)
- James Huheey, Ellen Keiter, Richard Keiter: Anorganische Chemie: Prinzipien von Struktur und Reaktivität, 2003, Walter de Gruyter, ISBN 3-11-017903-2.
- Hans-Jürgen Meyer, Christoph Janiak, Dietrich Gudat, Ralf Alsfasser, Erwin Riedel: Moderne Anorganische Chemie. 4. Auflage. Walter de Gruyter GmbH & Co. KG, Berlin 2012, ISBN 978-3-11-024900-2, S. 119 (eingeschränkte Vorschau in der Google-Buchsuche).