Citratzyklus
Der Citratzyklus (auch Zitratzyklus, Citronensäurezyklus, Tricarbonsäurezyklus, Krebs-Zyklus oder Szent-Györgyi-Krebs-Zyklus) ist ein Kreislauf biochemischer Reaktionen, der eine wichtige Rolle im Stoffwechsel (Metabolismus) aerober Zellen von Lebewesen spielt und hauptsächlich dem oxidativen Abbau organischer Stoffe zum Zweck der Energiegewinnung und der Bereitstellung von Zwischenprodukten für Biosynthesen dient. Das beim Abbau von Fetten, Zuckern, Alkohol und Aminosäuren als Zwischenprodukt entstehende Acetyl-CoA wird darin zu Kohlenstoffdioxid (CO2) und Wasser (H2O) abgebaut. Dabei werden sowohl für den Aufbau organischer Körperbestandteile des Lebewesens (Anabolismus) nutzbare Zwischenprodukte gebildet wie auch direkt und indirekt Energie in biochemisch verfügbarer Form (als Adenosintriphosphat ATP) zur Verfügung gestellt.
| Übergeordnet |
| Acetyl-CoA-Katabolismus |
| Gene Ontology |
|---|
| QuickGO |
Der Citratzyklus läuft bei Eukaryoten in der Matrix der Mitochondrien, bei Prokaryoten im Zytoplasma ab. Eine umgekehrte Reaktionsfolge findet im sogenannten reduktiven Citratzyklus statt, der manchen Bakterien zur Kohlenstoffdioxid-Assimilation dient.
Etymologie
Namensgeber ist das dabei entstehende Zwischenprodukt Citrat, das Anion der Citronensäure. Die Reaktionsfolge wird nach ihrem Entdecker Hans A. Krebs (1900–1981) auch als Krebs-Zyklus bezeichnet. Krebs erhielt – neben Fritz Albert Lipmann – 1953 den Nobelpreis für Medizin für die Klärung metabolischer Abbauwege.[1]
Entdeckung
1937 postulierte der Biochemiker Hans Adolf Krebs (in Zusammenarbeit mit William Arthur Johnson) als erster den Citratzyklus als Weg der Pyruvatoxidation.[2] Krebs untersuchte den Einfluss verschiedener organischer Säuren auf den Sauerstoffverbrauch bei der Pyruvatoxidation mit Suspensionen von zerkleinertem Taubenbrustmuskel. Dieser Flugmuskel ist für die Untersuchung besonders gut geeignet, da er eine hohe oxidative Aktivität aufgrund einer sehr hohen Atmungsgeschwindigkeit aufweist. Krebs bestätigte die Beobachtung von unter anderem Albert Szent-Györgyi, dass C4-Dicarbonsäuren aus tierischen Geweben (Succinat, L-Malat, Fumarat und Oxalacetat) den Sauerstoffverbrauch von Muskeln stimulieren. Krebs bestätigte diese Beobachtung und fand, dass auch die Pyruvatoxidation einen solchen Effekt hervorruft. Diese wird durch C6-Tricarbonsäuren Citrat, cis-Aconitat und Isocitrat, sowie durch die C5-Verbindung α-Ketoglutarat stimuliert. Andere organische Säuren zeigten nicht den genannten Effekt. Dieser war jedoch äußerst beachtlich, denn sehr geringe Mengen führten bereits zu einer Oxidation einer vielfachen Menge an Pyruvat.
Die zweite wichtige Beobachtung von Krebs war, dass Malonat – eng verwandt mit Succinat und kompetitiver Inhibitor der Succinat-Dehydrogenase – die aerobe Verwertung von Pyruvat in Muskelsuspensionen hemmt und zwar unabhängig davon, welche der aktiven organischen Säuren zugesetzt wird. Dies zeigt, dass Succinat und Succinat-Dehydrogenase wesentliche Bestandteile der an der Pyruvatoxidation beteiligten Reaktion sein müssen.
Aus diesen grundlegenden Beobachtungen und weiteren Hinweisen schloss Krebs, dass die unten aufgeführten aktiven Tri- und Dicarbonsäuren in einer chemisch logischen Reihenfolge angeordnet sein könnten. Da die Inkubation von Pyruvat und Oxalacetat mit zerkleinertem Muskelgewebe eine Anreicherung von Citrat im Medium hervorrief, folgerte Krebs, dass diese Sequenz nicht linear, sondern zyklisch arbeitet – ihr Ende ist mit ihrem Anfang verknüpft. Er irrte sich nur bei der letzten fehlenden Reaktion. Es gilt nämlich nicht: Pyruvat + Oxalacetat → Citrat + CO2. Somit schlug Krebs vor, dass der von ihm als „Zitronensäurezyklus“ bezeichnete Weg den Hauptweg der Kohlenhydratoxidation im Muskel darstelle.
Rolle im Stoffwechsel
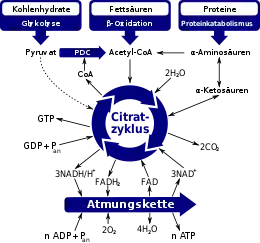
In den Citratzyklus münden Abbauprodukte verschiedener Nährstoffe, die im Stoffwechsel abgebaut werden. Acetyl-CoA, an das Coenzym A gebundene Essigsäure, kann dabei als das zentrale Abbauprodukt verschiedener Nährstoffklassen bezeichnet werden. Aus Fettsäuren beispielsweise werden durch β-Oxidation direkt Acetyl-CoA-Moleküle gebildet. In der Glykolyse werden Kohlenhydrate zu Pyruvat (Brenztraubensäure) abgebaut, dieses wird dann durch den Pyruvat-Dehydrogenase-Komplex zu Acetat decarboxyliert und der Acetylrest wird an Coenzym A gebunden. Schließlich werden auch Proteine zu Aminosäuren hydrolysiert, die sich nach Desaminierung in ihre korrespondierenden α-Ketosäuren überführen lassen, beispielsweise α-Ketoglutarat aus L-Glutaminsäure oder Oxalacetat aus L-Aspartat. Diese Ketosäuren sind häufig Intermediate des Citratzyklus und fließen direkt darin ein.
Beim Abbau von Acetyl-CoA über den Citratzyklus wird Energie in Form von GTP gewonnen, darüber hinaus auch die Reduktionsmittel (NADH, FADH2). Bei diesen Vorgängen wird der Acetylrest des Acetyl-CoA schrittweise zu Kohlenstoffdioxid und Wasser abgebaut. Die im Citratzyklus gewonnenen, an Coenzyme (NAD+ und FAD) gebundenen Elektronen werden der Atmungskette zugeführt und auf den terminalen Elektronenakzeptor Sauerstoff (O2) übertragen. Die dabei frei werdende Energie wird genutzt, um ATP zu bilden.
Der Citratzyklus dient außerdem als Lieferant verschiedener Vorläufermoleküle für den Anabolismus. Beispielsweise können α-Ketosäuren dem Zyklus entnommen werden, um daraus Aminosäuren oder andere Stoffe zu bilden. Auch Oxalacetat kann wieder in die Gluconeogenese eingespeist werden.
Ablauf
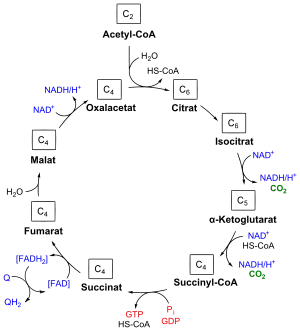
Der Citratzyklus läuft bei Eukaryoten in den Mitochondrien, bei Prokaryoten im Cytoplasma oder gegebenenfalls in Mitochondrienäquivalenten ab. Er ist ein amphiboler Stoffwechselprozess, d. h., er kann sowohl anabolen als auch katabolen Stoffwechselwegen dienen. Der Citratzyklus ist Teil oxidativer Abbauprozesse und geht bei aeroben Organismen der Atmungskette voraus.
Der Citratzyklus kann als der dritte von vier Schritten im Kohlenhydratkatabolismus betrachtet werden. Er findet nach der Glykolyse und der oxidativen Decarboxylierung von Pyruvat zu Acetyl-CoA, jedoch vor der Endoxidation in der Atmungskette statt.
Für den Citratzyklus lässt sich folgende Nettobilanz aufstellen:
Acetyl-CoA, an Coenzym A gebundene Essigsäure, auch als „aktivierte“ Essigsäure bezeichnet, wird durch den Citratzyklus zu Kohlenstoffdioxid (CO2), Wasserstoff (dieser gebunden an die Wasserstoff-/Elektronenüberträger NADH und FADH2) und Coenzym A abgebaut. Dabei wird Guanosindiphosphat (GDP) zu Guanosintriphosphat (GTP) phosphoryliert.
In der Atmungskette werden die an NADH und FADH2 gebundenen Elektronen (je Acetyl-CoA 8 Reduktionsäquivalente) auf Sauerstoff als terminalen Elektronenakzeptor übertragen. Die bei der Wanderung der Elektronen durch die Atmungskette von Proteinkomplex zu Proteinkomplex und schließlich auf Sauerstoff frei werdende Energie wird nutzbar gemacht, indem Protonen vom Inneren des Mitochondriums (Matrix) in den Intermembranraum transportiert werden und so durch den Protonengradienten eine Potentialdifferenz, ein chemiosmotisches Potenzial ΔP gebildet wird. Angetrieben durch dieses Potential phosphoryliert schließlich die ATP-Synthase ADP zu ATP. Anaerobe Organismen können den Citratzyklus nicht vollständig ablaufen lassen, er ist bei ihnen unterbrochen. Das liegt daran, dass ihnen der α-Ketoglutarat-Dehydrogenase-Komplex für die Umsetzung von α-Ketoglutarat zu Succinyl-CoA fehlt oder dieser reprimiert wird.[3][4]
Beim Abbau von 2 Pyruvat über Acetyl-CoA und den Citratzyklus sowie der Oxidation des dabei abgespaltenen Wasserstoffs (20 Reduktionsäquivalente) in der Atmungskette wird mit 25 ATP wesentlich mehr Energie zur Verfügung gestellt als in der Glykolyse von Glucose bis 2 Pyruvat, in der nur 2 ATP gebildet werden.
Teilreaktionen
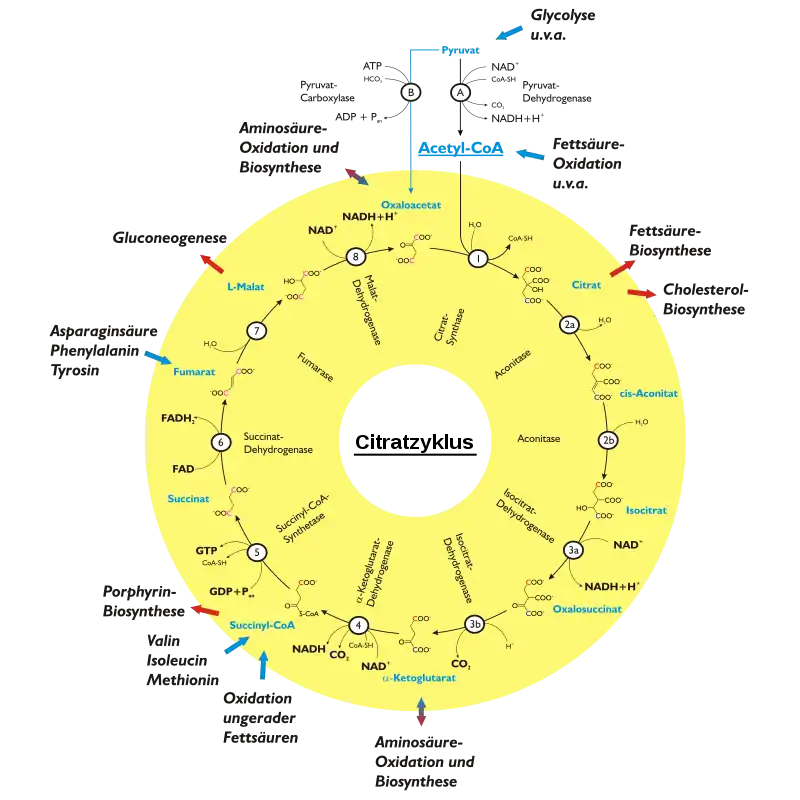
Der Reaktionsablauf ist in der Abbildung oben skizziert. Ausgangspunkt des Citratzyklus ist eine durch die Citrat-Synthase katalysierte Addition von Acetyl-CoA an Oxalacetat und anschließende Hydrolyse zum Citrat (1). Citrat wird bei Bedarf aus dem Zyklus abgezogen und der Cholesterolbiosynthese bzw. der Fettsäuresynthese zugeführt. Diese im Cytosol stattfindenden Prozesse benötigen Acetyl-CoA, welches – im Gegensatz zum Citrat – nicht vermag, die Mitochondrienmembran zu passieren, jedoch aus Citrat synthetisiert werden kann (Citrat-Shuttle). Acetyl-CoA für den Citratzyklus kann aus verschiedenen Quellen stammen, beispielsweise aus der β-Oxidation von Fettsäuren.
Die anschließende Isomerisierung 2a-b des Citrats durch die Aconitase liefert Isocitrat. Die Bedeutung dieses Schrittes liegt in der Umwandlung eines schwer zu oxidierenden tertiären Alkohols (Citrat) in einen leicht zu oxidierenden sekundären Alkohol (Isocitrat).
Isocitrat wird durch die Isocitrat-Dehydrogenase in den Schritten 3a-b oxidiert und decarboxyliert. Neben dem ersten Reduktionsäquivalent NADH entsteht hierbei α-Ketoglutarat (anderer Name: 2-Oxoglutarat), ein auch für den Aminosäurenmetabolismus wichtiges Zwischenprodukt (cataplerotischer Stoffwechselpfad: reduktive Transaminierung zum L-Glutamat ⇒ Aminosäurebiosynthese; anaplerotischer Stoffwechselpfad: Desaminierung des Glutamats ⇒ Aminosäureoxidation).
Die folgende Reaktion 4, die über eine oxidative Decarboxylierung neben NADH ein zweites Molekül CO2 liefert, wird vom α-Ketoglutarat-Dehydrogenase-Komplex katalysiert, der funktionell und strukturell dem Pyruvatdehydrogenase-Komplex ähnelt. Experimente mit isotopenmarkierten Substraten zeigen, dass das dabei freigesetzte CO2 nicht dem Kohlenstoff der Carbonylgruppe des Acetyl-CoAs zuordenbar ist, sondern wie dasjenige aus Schritt 3b dem Oxalacetat entstammt.
Das nun entstehende Succinyl-CoA ist ein weiteres Schlüsselprodukt des Citratzyklus (cataplerotischer Stoffwechselpfad: Porphyrin-Biosynthese; anaplerotische Stoffwechselpfade: Abbau der Aminosäuren L-Valin, L-Isoleucin und L-Methionin, Oxidation ungeradzahliger Fettsäuren, siehe auch Fettsäureoxidation).
Die vermittels der Succinyl-CoA-Synthetasen katalysierte Hydrolyse 5 des energiereichen Thioesters Succinyl-CoA zum Succinat liefert das einzige Energieäquivalent des Citratzyklus in Form von GTP. Durch eine Nukleosiddiphosphat-Kinase kann dabei GTP in ATP überführt werden.
Succinat ist im Schritt 6 das Substrat der Succinat-Dehydrogenase, welche durch Oxidation ein drittes Reduktionsäquivalent in Form des FADH2 liefert sowie Fumarat, welches auch durch einen anaplerotischen Stoffwechselpfad über den Abbau der Aminosäuren L-Asparaginsäure, L-Phenylalanin und L-Tyrosin in den Citratzyklus eingespeist wird.
Die Fumarase katalysiert die stereospezifische Addition von Wasser an die Doppelbindung des Fumarats im Schritt 7, so dass L-Malat entsteht. Im Schritt 8 wird durch die Malatdehydrogenase unter Gewinnung von NADH das L-Malat zum Substrat des ersten Schrittes, Oxalacetat, umgesetzt. Damit wird der Kreislauf geschlossen. An das Oxalacetat sind wiederum weitere Stoffwechselpfade angebunden (cataplerotisch: reduktive Transaminierung zum Aspartat ⇒ Aminosäurebiosynthese; anaplerotisch: Desaminierung des Aspartats ⇒ Aminosäureoxidation).
| Substrat | Reaktionspartner/ Coenzyme |
Enzym | Reaktionstyp | Inhibitoren | Aktivatoren | Produkte/ Coenzyme | |
|---|---|---|---|---|---|---|---|
| 1 | Oxalacetat | Acetyl-CoA, Wasser | Citrat-Synthase | Kondensation | Citrat, NADH, Succinyl-CoA, ATP | Citrat | |
| 2a | Citrat | – | Aconitase | Dehydratisierung | cis-Aconitat, Wasser | ||
| 2b | cis-Aconitat | Wasser | Hydratisierung | Isocitrat | |||
| 3a | Isocitrat | NAD+ | Isocitrat-Dehydrogenase | Oxidation | NADH, ATP | Ca2+, ADP | Oxalsuccinat, NADH |
| 3b | Oxalsuccinat | H+ | Decarboxylierung | α-Ketoglutarat, CO2 | |||
| 4 | α-Ketoglutarat | NAD+, CoA-SH | α-Ketoglutarat-Dehydrogenase-Komplex | Oxidative Decarboxylierung | NADH, Succinyl-CoA | Ca2+ | Succinyl-CoA, NADH, CO2 |
| 5 | Succinyl-CoA | GDP, Phosphat | Succinyl-CoA-Synthetase | Phosphat-Transfer | Succinat, GTP, CoA-SH | ||
| 6 | Succinat | FAD | Succinat-Dehydrogenase | Oxidation | Malonat | Mg2+ | Fumarat, FADH2 |
| 7 | Fumarat | Wasser | Fumarase | Hydratisierung | L-Malat | ||
| 8 | L-Malat | NAD+ | Malatdehydrogenase | Oxidation | Oxalacetat, NADH | ||
| Nicht zum Citratzyklus gehörig: | |||||||
| A | Pyruvat | NAD+, CoA-SH | Pyruvatdehydrogenase-Komplex | Oxidative Decarboxylierung | NADH, Acetyl-CoA | Ca2+ | Acetyl-CoA |
| B | Pyruvat | ATP, H+, CO2 | Pyruvatcarboxylase | Carboxylierung | Acetyl-CoA | Oxalacetat, ADP, Phosphat | |
Regulation
Der Citratzyklus als zentraler Drehpunkt des aeroben Metabolismus unterliegt starken regulatorischen Einflüssen. Neben der Produktinhibition („negative Rückkopplung“, kompetitive Hemmung) und Inhibition durch andere Zwischenverbindungen spielen als Effektoren insbesondere NAD+/NADH, ADP/ATP und Ca2+ eine große Rolle. Regulatorischer Kontrolle unterliegen dabei insbesondere die Teilschritte großer Exergonie: die Citrat-Synthese 1 (ΔGo = −38 kJ/mol), die Ketoglutarat-Bildung 3 (ΔGo = −7 kJ/mol) und die Bildung des Succinyl-CoA 4 (ΔGo = −37 kJ/mol).
Die oben genannten exergonen Teilschritte werden durch hohe NADH-Pegel inhibiert: gerät z. B. infolge Sauerstoffmangels die Atmungskette ins Stocken, wird also weniger NADH verbraucht und steigt damit dessen Konzentration, so kann auch der Citratzyklus zum Erliegen kommen.
Wird andererseits wenig Energie benötigt (z. B. Muskel im Ruhezustand), so steigt die ATP-Konzentration bei sinkender ADP-Konzentration. Während ADP ein allosterischer Aktivator der Isocitrat-Dehydrogenase ist, inhibiert ATP deren Wirkung: Der Zyklus wird gebremst.
Weitere Effektoren des Citratzyklus sind der Tabelle zu entnehmen.
Hemmstoffe
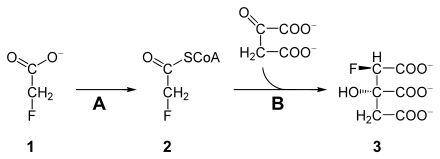
Fluoracetat ist toxisch, da es den Citratzyklus blockieren kann.[5] Fluoracetat (1) wird zunächst durch eine Acetyl-CoA-Synthetase (A, EC 6.2.1.1) zu Fluoroacetyl-CoA (2) metabolisiert. Fluoroacetyl-CoA wird, wie dessen Analogon Acetyl-CoA, durch die Citratsynthase (B) katalysiert, mit Oxalacetat kondensiert. Das Produkt, (2R, 3S)-Fluorocitrat (3), kann aber von der Aconitase nicht verarbeitet werden und blockiert diese, wodurch der Citratzyklus an dieser Stelle abbricht. Damit ist die Zelle von der Energiezufuhr abgeschnitten und stirbt (Letale Synthese).[6]
Citratzyklus beim Menschen
Auch beim Menschen werden Zucker über die Glykolyse, die oxidative Decarboxylierung von Pyruvat und den Citratzyklus unter Bildung der Energieträger NADH+H+, FADH2, GTP und ATP zu CO2 und H2O abgebaut. Die Energie der gebildeten Energieträger (außer ATP) wird über die Atmungskette an ADP übertragen, das dann mithilfe eines Phosphatrestes zu weiterem ATP aufgebaut werden kann. Hierbei setzt NADH+H+ in etwa die Energie frei, die zur Bildung von 3 ATP genutzt werden kann, FADH2 setzt in etwa die Energie frei, die zur Bildung von 2 ATP benötigt wird, GTP liefert Energie zum Aufbau eines ATP-Moleküles aus ADP und Phosphat.
Bei erhöhter Leistungsabforderung wird aufgrund fehlenden Sauerstoffes, ohne den die Atmungskette nicht ablaufen kann, ein wachsender Prozentsatz des in der Glykolyse gewonnenen Pyruvats nicht mehr aerob zu Acetyl-CoA umgesetzt, sondern anaerob unter Verbrauch eines NADH+H+ je Pyruvat-Molekül zu L-Lactat, dem Anion der Milchsäure. Dass NADH+H+ verbraucht wird, scheint unverständlich, da der Körper in dieser Situation eigentlich Energie benötigt. Bei genauerer Betrachtung ist dieser Schritt aber notwendig und energiebringend, denn NADH+H+ kann von der Atmungskette ohnehin nicht zu ATP verwertet werden (Sauerstoffmangel). Wohl können aber in der Glykolyse 2 ATP, die direkt von den Muskeln ohne die Atmungskette verwertet werden können, gebildet werden, indem 1 Molekül Glucose zu 2 Molekülen Pyruvat abgebaut wird. Hierbei entstehen auch 2 Moleküle NADH+H+, sodass im Endeffekt ein Energiegewinn von 2 ATP entsteht. Damit die Pyruvat-Bildung jedoch stetig ablaufen kann, muss gesichert sein, dass Pyruvat dem System immer wieder entnommen wird (damit keine zu hohe Konzentration entsteht), was über die Decarboxylierung und den Citratzyklus normalerweise geschehen würde. Da dies durch fehlenden Sauerstoff wie erwähnt nicht möglich ist, wird Pyruvat zu Lactat abgebaut. So kann die Glykolyse weiterlaufen und immerhin 2 ATP gebildet werden:
| Stoffwechselvorgang | Energiebilanz |
|---|---|
| Umbau von 2 Pyruvat zu 2 Lactat | −6 ATP (2 NADH+H+) |
| Abbau von 1 Glucose zu 2 Pyruvat | +8 ATP (2 NADH+H+ und 2 ATP) |
| Bilanz je Glucose-Molekül | +2 ATP |
Milchsäure muss ab einer bestimmten Konzentration abgebaut werden, weil sie durch pH-Wert-Absenkung leistungshemmend wirkt. Dabei gibt die Muskulatur Lactat an das Blut ab, welches zur Leber transportiert wird. Anschließend wird Lactat in der Leber zu Glucose durch den Prozess der Gluconeogenese umgesetzt. Hierbei wird mehr Energie benötigt, als im Muskel aufgenommen wurde. Der Prozess des Umbaus von Pyruvat zu Lactat ist also nur regional auf den Muskel betrachtet energetisch kurzfristig günstig. Für den Organismus insgesamt bedeutet er allerdings langfristig Energieverluste (siehe auch Cori-Zyklus). Dies zeigt, dass der Körper in Extremsituationen – hier hohe Leistungsanforderung – dazu bereit sein kann, langfristig Energie einzubüßen, um kurzfristig die benötigte Leistung aufzubringen.
Die in der Leber gebildete Glucose kann dann wieder durch das Blut von den Muskelzellen aufgenommen werden. Dieser Kreislauf wird auch als Cori-Zyklus bezeichnet. Die Fähigkeit, eine hohe Leistung trotz hohen Lactatspiegels aufrechtzuerhalten, wird in der physiologisch begründeten Trainingslehre als Lactattoleranz bezeichnet.
→siehe auch: Glykolyse, Milchsäuregärung
Varianten
Veränderte Citratzyklus-Stoffwechselwege, in denen ein Teilschritt fehlt, sind bei Bakterien der Normalfall (13 von 17 untersuchten). Der fehlende Schritt kann durch andere Reaktionsschritte ersetzt sein oder auch nicht. Tatsächlich sind nur von zwei Bakterienarten Enzyme mit Ketoglutarat-Dehydrogenase-Aktivität (KDH) bekannt: Bacillus japonicum und Escherichia coli. Das Bakterium Escherichia coli fährt unter aeroben Bedingungen den kompletten Citratzyklus wie beschrieben. Unter anaeroben Bedingungen ist es in der Lage, die KDH zu desaktivieren. Die Stoffwechselwege, die vorher einen Kreis bildeten, sind nun baumstrukturartig verbunden. M. tuberculosis hingegen kann zwischen zwei verschiedenen Citratzyklen umschalten, die beide vom eukaryotischen Weg verschieden sind.[7]
Archaeen, aber auch manche Bakterien, wie Helicobacter pylori, das unter microaerophilen Bedingungen wächst, katalysieren die Umwandlung von α-Ketoglutarat zu Succinyl-CoA mittels einer oxidationsempfindlichen 2-Ketoglutarat:Ferredoxin-Oxidoreduktase (OGOR, EC 1.2.7.3). Im Gegensatz zur OGDC enthält diese Eisen-Schwefel-Cluster; es fehlen das Flavin und das Liponsäureamid. Anstatt NADH wird Ferredoxin als Reduktionsäquivalent genutzt. Auch Mycobacterium tuberculosis enthält ein CoA-abhängiges Enzym, das dagegen auch unter aeroben Bedingungen stabil ist.[8][9][10]
Bei verschiedenen Mycobakterien (darunter auch Mycobacterium tuberculosis) ist die E1-Untereinheit der Ketoglutarat-Dehydrogenase durch eine Ketoglutarat-Decarboxylase ersetzt, die unabhängig von Coenzym A zunächst Succinat-Semialdehyd produziert, welches von einer NADP+-abhängigen Succinat-Semialdehyd-Dehydrogenase zu Succinat dehydriert wird.[11]
Umkehrung
In manchen Bakterien wird zur Kohlenstoffdioxid-Assimilation der Citratzyklus in umgekehrter Reihenfolge betrieben (reduktiver Citratzyklus). Hierbei werden unter ATP-Verbrauch und Einsatz von Reduktionsmitteln drei energetisch ungünstig verlaufende Schritte des oxidativen Citratzyklus umgangen: Die Citrat-Synthase wird durch eine ATP-Citrat-Lyase ersetzt, die α-Ketoglutarat-Dehydrogenase durch eine α-Ketoglutarat-Synthase und die Succinat-Dehydrogenase durch eine Fumarat-Reduktase.
2018 haben Forschergruppen in zwei thermophilen, schwefelreduzierenden, anaeroben Bakterien (Desulfurella acetivorans[12] und Thermosulfidibacter takaii[13]) entdeckt, dass diese eine umgekehrte Reihenfolge des Citratzyklus nutzen, jedoch kein Gen für die im reduktiven Citratzyklus notwendige ATP-abhängige Citrat-Lyase kodieren.[14] Dieser Stoffwechselweg wurde zur Unterscheidung des reduktiven Citratzyklus („rTCA“) als revertierter bzw. umgekehrter oxidativer Citratzyklus („roTCA“) bezeichnet. Den Bakterien gelingt die Umkehrung der Bildung von Citrat, indem die Nachfolgemetabolite Malat und Acetyl-CoA effizient weiterverstoffwechselt werden; dadurch ist auch die Konzentration an Oxalacetat äußerst gering, so dass das Gleichgewicht der Citratspaltung auf Seiten von Oxalacetat verschoben wird. Durch Einsparung eines Moleküls ATP wird im roTCA insgesamt nur ein Molekül ATP benötigt, um zwei Moleküle CO2 zu fixieren. Dies entspricht dem Energiebedarf des reduktiven Acetyl-CoA-Wegs.
Siehe auch
Literatur
- Reginald Garrett, Charles M. Grisham: Biochemistry. International Student Edition. 4. Aufl. Cengage Learning Service, Australia 2009, ISBN 0-495-11464-2, S. 563ff.
- Geoffrey Zubay: Biochemie. 4. Auflage. Mcgraw-Hill International, London 1999, ISBN 3-89028-701-8.
- Donald Voet, Judith G. Voet: Biochemie. Wiley-VCH, Weinheim 1994, ISBN 3-527-29249-7.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6. Auflage. Spektrum, Heidelberg 2007, ISBN 3-8274-1800-3.
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn, Carsten Biele (Übers.): Biochemie. 4. Auflage. Pearson Studium, München 2008, ISBN 3-8273-7312-3.
- David L. Nelson, Michael M. Cox, Albert L. Lehninger (Begr.): Lehninger Biochemie. 4. Auflage. Springer, Berlin 2009, ISBN 3-540-68637-1.
Weblinks
- Was ist das Ziel des Zitratzyklus ? (Memento vom 2. Mai 2016 im Internet Archive)
Einzelnachweise
- Nobelpreis für Medizin 1953.
- H. A. Krebs und W. A. Johnson: The role of citric acid in intermediate metabolism in animal tissues. In: Enzymologia. Band 4, 1937, S. 148–156 (Nachdruck: H. A. Krebs, W. A. Johnson: The role of citric acid in intermediate metabolism in animal tissues. In: FEBS letters. 117 Suppl, 25. August 1980, S. K1–10, PMID 6998725.)
- Albert L. Lehninger, David L. Nelson, Michael M. Cox: Lehninger Biochemie. 3. Auflage. Springer, Berlin 2009, ISBN 3-540-41813-X, S. 626.
- Hans Günther Schlegel, Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie. 8. Auflage. Thieme, Stuttgart 2006, ISBN 3-13-444608-1, S. 326.
- Reginald Garrett, Charles M. Grisham: Biochemistry. International Student Edition. 4. Aufl. Cengage Learning Services, Australia 2009, ISBN 0-495-11464-2, S. 573.
- Marc W. van der Kamp, John D. McGeagh, Adrian J. Mulholland: “Lethal Synthesis” of Fluorocitrate by Citrate Synthase Explained through QM/MM Modeling. In: Angewandte Chemie International Edition. Band 50, Nr. 44, 24. Oktober 2011, ISSN 1521-3773, S. 10349–10351, doi:10.1002/anie.201103260.
- S. J. Cordwell: Microbial genomes and “missing” enzymes: redefining biochemical pathways. In: Archives of Microbiology. Band 172, Nr. 5, 1. Oktober 1999, S. 269–279, doi:10.1007/s002030050780, PMID 10550468.
- X. Mai, M. W. Adams: Characterization of a fourth type of 2-keto acid-oxidizing enzyme from a hyperthermophilic archaeon: 2-ketoglutarate ferredoxin oxidoreductase from Thermococcus litoralis. In: Journal of Bacteriology. Band 178, Nr. 20, Oktober 1996, S. 5890–5896, PMID 8830683, PMC 178443 (freier Volltext).
- S. M. Pitson, G. L. Mendz, S. Srinivasan, S. L. Hazell: The tricarboxylic acid cycle of Helicobacter pylori. In: European Journal of Biochemistry / FEBS. Band 260, Nr. 1, Februar 1999, S. 258–267, PMID 10091606.
- Anthony D. Baughn, Scott J. Garforth, Catherine Vilchèze, William R. Jacobs: An anaerobic-type alpha-ketoglutarate ferredoxin oxidoreductase completes the oxidative tricarboxylic acid cycle of Mycobacterium tuberculosis. In: PLoS pathogens. Band 5, Nr. 11, November 2009, S. e1000662, doi:10.1371/journal.ppat.1000662, PMID 19936047.
- Jing Tian, Ruslana Bryk, Manabu Itoh, Makoto Suematsu, Carl Nathan: Variant tricarboxylic acid cycle in Mycobacterium tuberculosis: identification of alpha-ketoglutarate decarboxylase. In: Proceedings of the National Academy of Sciences. Band 102, Nr. 30, 26. Juli 2005, S. 10670–10675, doi:10.1073/pnas.0501605102, PMID 16027371.
- Achim Mall et al.: Reversibility of citrate synthase allows autotrophic growth of a thermophilic bacterium. In: Science (New York, N.Y.). Band 359, Nr. 6375, 2. Februar 2018, S. 563–567, doi:10.1126/science.aao2410, PMID 29420287.
- Takuro Nunoura et al.: A primordial and reversible TCA cycle in a facultatively chemolithoautotrophic thermophile. In: Science (New York, N.Y.). Band 359, Nr. 6375, 2. Februar 2018, S. 559–563, doi:10.1126/science.aao3407, PMID 29420286.
- Stephen W. Ragsdale: Stealth reactions driving carbon fixation. In: Science (New York, N.Y.). Band 359, Nr. 6375, 2. Februar 2018, S. 517–518, doi:10.1126/science.aar6329, PMID 29420277.