Chlortrifluorid
Chlortrifluorid ist eine Interhalogenverbindung. Es handelt sich um ein farbloses, giftiges, stechend riechendes, ätzendes Gas, das in feuchter Luft weiße Nebel entwickelt. Es ist wie alle Interhalogenverbindungen sehr reaktionsfreudig.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Chlortrifluorid | |||||||||||||||
| Andere Namen |
Chlor(III)-fluorid | |||||||||||||||
| Summenformel | ClF3 | |||||||||||||||
| Kurzbeschreibung |
farbloses bis hellgelbes Gas mit süßlichem Geruch; als Flüssigkeit gelbgrün; als Feststoff farblos[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 92,45 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
3,57 kg·m−3 (Gasdichte bei 0 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
11,8 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
hydrolysiert in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 0,4 mg·m−3[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Chlortrifluorid kann aus den Elementen Chlor und Fluor bei 400 °C hergestellt werden.[3]
Eigenschaften
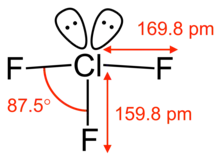
Chlortrifluorid ist ein farbloses bis hellgelbes Gas, das bei ca. 12 °C in den flüssigen Zustand übergeht und bei −76,3 °C erstarrt. Das Gas hat in verdünnter Form einen süßlichen, in höherer Konzentration stark reizenden Geruch. Mit Wasser reagiert Chlortrifluorid explosionsartig unter Sauerstofffreisetzung. Chemisch verhält sich Chlortrifluorid wie ein starkes Oxidationsmittel, es greift Metalle unter Fluoridbildung an. Die weitere Reaktion mit Metallen hängt davon ab, ob die gebildete Fluoridschicht stabil ist; bei Kupfer ist dies der Fall, so dass die Herstellung in Kupfergefäßen erfolgt. Nichtmetalle bilden keine Schutzschicht, sondern werden in Brand gesetzt. Glas zerstört es sofort, in Gegenwart von Feuchtigkeitsspuren Quarz ebenfalls. Organische Stoffe reagieren meist unter Feuererscheinung.[3]
Chlortrifluorid greift auch die Füllstoffe der Atemschutzfilter (Aktivkohle) an.
Verwendung
Chlortrifluorid kann zur Fluorierung verwendet werden.[4] Aufgrund der leichteren Handhabung im Vergleich mit Fluor wird es als Fluorierungsmittel in der Uranhexafluorid-Herstellung eingesetzt.[4] Darüber hinaus wird es bei der Herstellung von Mikroelektronik und Sensoren verwendet.[5] Zur Erhöhung der Verbrennungstemperatur wird es Schweißgasen zugesetzt.
Im Zweiten Weltkrieg wurde es unter der Deckbezeichnung „N-Stoff“ in Deutschland produziert, wobei die Verwendung als Kampfstoff oder als brandstiftendes Mittel in Erwägung gezogen wurde. Der hohe Energiegehalt der Verbindung und ihr Siedepunkt legen den Einsatz als lagerfähiger, hochenergetischer Oxidator in der Raketentechnik nahe, jedoch kam diese Anwendung aufgrund von Handhabungsproblemen nie über das Versuchsstadium heraus.[6]
Chlortrifluorid wird zur Trennung von U-Pu-Spaltprodukten in der Kerntechnik verwendet. Es entstehen nichtflüchtiges PuF4 und flüchtiges UF6, welches abdestilliert werden kann.[7]
Toxikologie
Als Inhalationsgift wirkt es auf den gesamten Atemtrakt. Die Folgen sind Aufblähungen und Schwellungen der Lunge, Verätzungen der oberen Atemwege bis hin zur eitrigen Bronchitis. Hohe Konzentrationen führen zu starkem Reizhusten und schwersten Lungenschädigungen. Gasförmiges Chlor(III)-fluorid greift die Augen sehr stark an; die Schädigungen führen zur Hornhauttrübung.
Siehe auch
Einzelnachweise
- Eintrag zu Chlortrifluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7790-91-2 bzw. Chlortrifluorid), abgerufen am 2. November 2015.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 168.
- Eintrag zu Chlorfluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- Patent EP1902456A1: Reaktor zur Durchführung eines Ätzverfahrens für einen Stapel von maskierten Wafern und Ätzverfahren. Angemeldet am 29. Mai 2006, veröffentlicht am 26. März 2008, Anmelder: Robert Bosch GmbH, Erfinder: Joachim Rudhard, Christina Leinenbach.
- John D. Clark: Ignition! An Informal History of Liquid Rocket Propellants. Rutgers University Press, Piscataway, NJ 1972, ISBN 0-8135-0725-1, S. 73–75.
- E. Riedel, J. Janiak: Anorganische Chemie. 9. Auflage. DE GRUYTER, Berlin/Boston 2015, ISBN 978-3-11-035526-0, S. 432–433.



