Aconitase
Aconitase (ACO) (genauer: Aconitat-Hydratase) heißen Enzyme, die die Umwandlung von Citrat oder Isocitrat in Aconitat und umgekehrt katalysieren. Es ist ein unentbehrliches Enzym des Citratzyklus und des Glyoxylatzyklus. Aconitase kommt in allen Eukaryoten und Bakterien im Zytosol vor. Mehrzellige Tiere haben eine zusätzliche Kopie der ACO im Mitochondrium. Bei Säugetieren und Bakterien schließlich hat sich die zytosolische ACO weiterentwickelt und die zusätzliche Rolle eines Translations-Repressors angenommen, der eine zentrale Rolle im Eisenstoffwechsel spielt. Mutationen am Eisen-Schwefel-Cluster-Gerüstprotein (ISCU) können zur seltenen Krankheit Aconitasemangel führen, da die ACO-Funktion von der Anwesenheit des Cluster abhängig ist.[1]
| Aconitase | ||
|---|---|---|
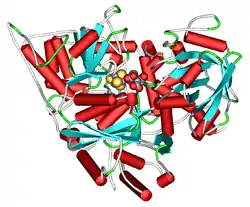 | ||
| Abb. 1: Tertiärstruktur der mAc des Rinds, Bos taurus, mit gebundenem α-Methylisocitrat (Kalotte rechts) neben Fe-S-Cluster nach PDB 1AMI | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 889 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer | |
| Kofaktor | [4Fe-4S] | |
| Bezeichner | ||
| Gen-Namen | ACO1 ; IREB1; IRP1; IREBP; ACO2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 4.2.1.3, Lyase | |
| Reaktionsart | Umlagerung | |
| Substrat | Citrat | |
| Produkte | Isocitrat | |
| Vorkommen | ||
| Homologie-Familie | zyt. Aconitase | |
| Übergeordnetes Taxon | Lebewesen | |
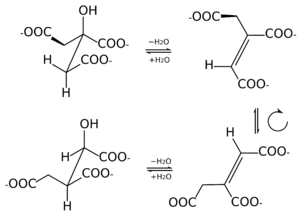
Das katalysierte Gleichgewicht lautet:
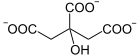
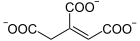 + H2O
+ H2O + H2O
+ H2O 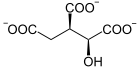
Citrat und Aconitat werden ineinander umgesetzt (1), wie Aconitat und Isocitrat (2). Die Steuerung der Gesamtreaktion vom Citrat zum Isocitrat ist dadurch festgelegt, wie das Aconitatmolekül an das Enzym bindet, wofür es zwei Möglichkeiten gibt (siehe Bild unten).
Aconitase-1 und -2 sind die veralteten Bezeichnungen für die zwei Aconitasen in Tieren (zytosolisch, cAc, und mitochondriell, mAc). Bakterien-Aconitasen werden mit AcnA und AcnB bezeichnet. cAc und AcnA sind zueinander ortholog. Im Ganzen gibt es also drei phylogenetische Kategorien.
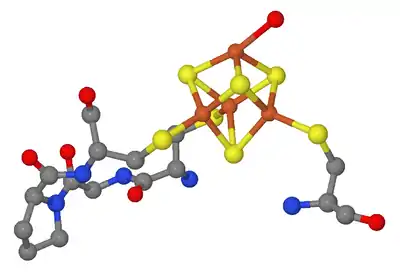
Die Anwesenheit des Eisen-Schwefel-Cluster-Kofaktors entscheidet über die Funktion der Aconitase-1. Im Citratzyklus katalysiert sie so die reversible Umlagerung des Citrats über das intermediär enzymgebundene cis-Aconitat zum Isocitrat. Aconitase-1 ohne den Eisencluster bindet an Iron Response Elements (IRE) in mehreren RNAs und reguliert so die Translation von Ferritin, der δ-Aminolävulinatsynthase und des Transferrin-Rezeptors (Abb. unten).[2]
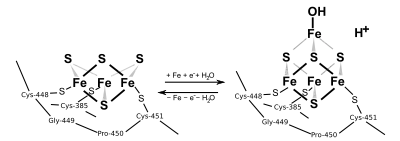
Biosynthese
Das menschliche ACO1-Gen liegt auf Chromosom 9 und erstreckt sich über 66.220 Basenpaare und 21 Exons. Die mRNA ist 3.533 Basen lang und durch Translation und posttranslationale Modifikation entsteht das Protein mit 889 Aminosäuren.[3]
Das ACO2-Gen liegt auf Chromosom 22 und das endgültige Protein enthält 753 Aminosäuren.[4]
Struktur
Das Protein faltet sich zu vier Domänen, von denen drei eng miteinander verknüpft sind. Die vierte bildet mit den anderen drei eine Tasche, in der die Katalyse stattfindet. Für die katalytische Aktivität zeichnet die spezifische Konformation des Enzyms mit dem [4Fe-4S]-Cluster und mehreren Aminosäureresten verantwortlich, welche die Reaktion stereospezifisch vom achiralen Citrat ausschließlich zum (1S,2R)-Isocitrat ablaufen lässt.
Mitochondrielle Aconitase enthält, an die Cysteinreste-385, -458 und -461 gebunden, einen Eisen-Schwefel-Cluster [4Fe-4S], der ausschlaggebend für die katalytische Aktivität ist. Im inaktiven Zustand fehlt dem Cluster das vierte Eisenatom, dieses ist nur locker gebunden und hat zunächst die Koordinationszahl 4: drei Schwefelatome und ein Hydroxidion (von Wasser) als Bindungspartner (siehe Abb. 2). In der katalytischen Phase erhöht sie sich auf 6, es werden dann zusätzlich Isocitrat und ein weiteres Wassermolekül gebunden.[5]
Abb. 1 zeigt die röntgenkristallographisch ermittelte Tertiärstruktur der mAc mit gebundenem α-Methylisocitrat (einem ACO-Hemmer). Im aktiven Zentrum befindet sich der [4Fe-4S]-Cluster, der zusammen mit Seitenketten polarer Aminosäuren, hauptsächlich Arginin-Reste, das Substrat bindet.
Katalysiertes Gleichgewicht
 ↔
↔ ![]() + H2O ↔
+ H2O ↔ 
Citrat wird zu cis-Aconitat und dieses zu L-threo-Isocitrat (1S,2R-Isocitrat) umgewandelt, und umgekehrt. Der letzte Schritt ist stereoselektiv. Unter Standardbedingungen liegen 91 % Citrat, 3 % cis-Aconitat und 6 % Isocitrat im Gleichgewicht vor. Die nachfolgenden Erläuterungen zum Reaktionsablauf wurden zwar ausschließlich aus Untersuchungen an mitochondrieller Aconitase gewonnen, sind jedoch aufgrund der Ähnlichkeit der Struktur auf zytosolische ACO übertragbar.
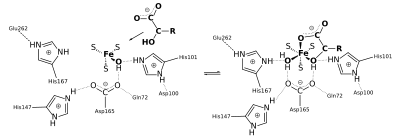
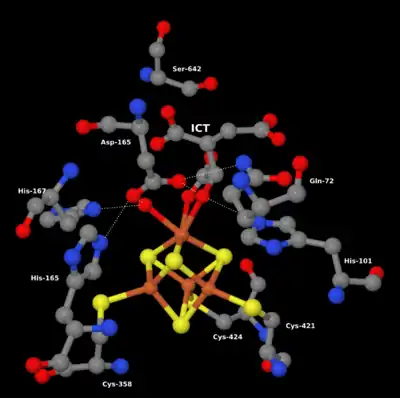
Gehen wir von der Isocitrat-Seite aus, wird zunächst Isocitrat mittels zweier seiner Hydroxygruppen an das vierte Eisenatom des Clusters gebunden (s. Abb.). Das am Eisen bereits vorher gebundene Hydroxid wechselt seine Wasserstoffbrückenbindung von Asp-100 zu His-167. Asp-100 bildet nun eine Brücke zum Hydroxy des Isocitrat. Die Wasserstoffatome des Hydroxids und der Hydroxygruppe bilden ihrerseits Brücken zu den Sauerstoffatomen von Asp-165.
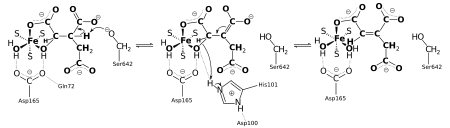
Durch das deprotonierte Ser-642 findet eine weitläufige Elektronenübertragung hin zum His-101 statt. Dabei erhält Ser-642 ein Proton und das Eisenatom eine zweite Hydroxygruppe (s. Abb.), die im zweiten Teil der Reaktion, der Hydratisierung von Aconitat, wiederverwendet werden. Asp-165 ist ausschlaggebend für die Bindung der Hydroxygruppen am Eisenatom.
Literatur
- M. Claire Kennedy und Helmut Beinert: IX.4. Aconitase. In: Ivano Bertini, Harry B. Gray, Edward I. Stiefel, Joan Selverstone Valentine (Hrsg.): Biological Inorganic Chemistry: Structure and Reactivity. University Science Books, Herndon 2006, ISBN 1-891389-43-2, S. 209 ff.
Einzelnachweise
- Orphanet Aconitasemangel
- Aconitase. In: Online Mendelian Inheritance in Man. (englisch).
- ENSEMBL-Eintrag
- UniProt Q99798
- Robbins AH, Stout CD: Structure of activated aconitase: formation of the [4Fe-4S] cluster in the crystal. In: Proc. Natl. Acad. Sci. U.S.A.. 86, Nr. 10, Mai 1989, S. 3639–3643. PMID 2726740. PMC 287193 (freier Volltext).