Fluorchlorkohlenwasserstoffe
Fluorchlorkohlenwasserstoffe (FCKW, chemische Nomenklatur nach IUPAC: Chlorfluorkohlenwasserstoffe, CFKW, oder auch Freone[1]) sind eine umfangreiche chemische Gruppe niedermolekularer organischer Verbindungen, die als Treibgase, Kältemittel oder Lösemittel verwendet werden. FCKW sind Kohlenwasserstoffe, bei denen Wasserstoffatome durch die Halogene Chlor und Fluor ersetzt wurden, sie sind eine Untergruppe der Halogenkohlenwasserstoffe. FCKW, die nur Einfachbindungen enthalten, nennt man gesättigte FCKW. Ist in der Verbindung kein Wasserstoff mehr enthalten, so nennt man sie Chlorfluorkohlenstoffe. Im Laufe der 1970er und 1980er Jahre stellte sich heraus, dass die Freisetzung von FCKW in die Atmosphäre in erheblichem Maße für den Abbau der Ozonschicht in der Stratosphäre („Ozonloch“) verantwortlich ist, weshalb der Einsatz von FCKW heute in vielen Anwendungsbereichen verboten ist.
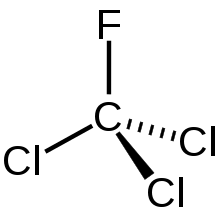
Mit H-FCKW werden „teilhalogenierte“ Fluorchlorkohlenwasserstoffe bezeichnet, ihre Wasserstoffatome sind nur teilweise durch Chlor- und Fluoratome ersetzt: Sie besitzen ein weitaus geringeres Ozonabbaupotenzial als die FCKW, ihr Treibhauspotenzial liegt ebenfalls weit unter dem der FCKW. Zudem werden die H-FCKW schon in der Troposphäre abgebaut und gelangen nur teilweise in die Stratosphäre.
Eigenschaften
FCKW sind sehr beständig, unbrennbar, geruchlos, durchsichtig (farblos) und sind oft ungiftig oder haben nur eine geringe Toxizität.[1] Die FCKW der Methan- und Ethanreihe besitzen einen niedrigen Siedepunkt und lassen sich durch Komprimieren leicht verflüssigen. Da sie während des Verdampfens große Wärmemengen absorbieren können, sind sie vor allem als Kühlmittel von Bedeutung (s. u.).[1] FCKW haben wegen ihrer Reaktionsträgheit eine hohe Verweildauer in der Atmosphäre. Sie steigen deshalb bis in die Stratosphäre auf und werden dort von den UV-Strahlen zerlegt. Dabei werden Chlor- bzw. Fluor-Radikale freigesetzt, welche mit dem Ozon der Ozonschicht reagieren und dieses schädigen. Im Jahr 1981 beschrieb Veerabhadran Ramanathan, dass allein der sehr starke Treibhauseffekt der Fluorchlorkohlenwasserstoffe die Erdatmosphäre bis zum Jahr 2000 um ein ganzes Grad erwärmen würde, wenn die Emissionen dieses Gases nicht dramatisch reduziert werden.[2]
2007 wurden drei FCKWs mit untypischen Eigenschaften – sehr reaktiv und giftig – in der Atmosphäre nachgewiesen.[3]
Da es keine bekannten natürlichen Reaktionen gibt, bei denen FCKW freigesetzt wird, wird man in Zukunft in den Atmosphären der Exoplaneten mithilfe von Spektralanalysen nach FCKW suchen, denn das würde bedeuten, dass es dort wahrscheinlich eine Zivilisation gibt, die FCKW herstellt.[4]
Herstellung
Eine direkte Fluorierung von Alkanen ist nur schwer durchführbar, da die hochexotherme Reaktion meist explosionsartig verläuft und fast stets zu einem Gemisch von perfluorierten Verbindungen führt. Technisch gewinnt man Chlorfluoralkane durch Fluorierung der entsprechenden Chloralkane mit wasserfreiem Fluorwasserstoff an Festbettkatalysatoren aus Aluminium- oder Chromfluoriden. Möglich ist auch die Anwendung eines Antimon(V)-chlorid-Katalysators.[5]
- Beispiel 1
- Umsetzung von Tetrachlorkohlenstoff mit wasserfreiem Fluorwasserstoff in ein Gemisch von Dichlordifluormethan, Trichlorfluormethan und Chlorwasserstoff:
- Beispiel 2
- Umsetzung von Chloroform mit wasserfreiem Fluorwasserstoff in Chlordifluormethan (Freon 22). Hier kommt als Katalysator Antimon(V)-chlorid zur Anwendung.
Möglich ist auch eine Elektrofluorierung nach Simons. Dabei wird die anodische Fluorierung in wasserfreiem Fluorwasserstoff bei einer Spannung durchgeführt, die noch nicht zur Freisetzung von elementarem Fluor ausreicht.
Geschichte und Verwendung
Ende des 19. Jahrhunderts wurden die ersten halogenierten Kohlenwasserstoffe durch Direktfluorierung (Moissan) und elektrophil katalysierten Halogenaustausch (Swarts) hergestellt. Die ersten FCKW (CFCl3 und CF2Cl2) wurden 1929 durch Thomas Midgley bei General Motors synthetisiert. Ab 1930 wurden die FCKW technisch hergestellt und zunehmend als Kältemittel in Kältemaschinen, als Treibgas für Sprühdosen, als Treibmittel für Schaumstoffe, als Reinigungs- und Lösungsmittel eingesetzt. Der Einsatz als Kältemittel in Kühlschränken ist seit 1995 verboten, da FCKW zur Zerstörung der Ozonschicht beitragen.
Bromhaltige FCKW wurden als Feuerlöschmittel eingesetzt und werden auch als Halone bezeichnet.
Die Chemiker Harold D. Johnston, Emanuel Sassim, Paul J. Crutzen (eigentlich ein Meteorologe), Frank Sherwood Rowland und Mario J. Molina entdeckten in den frühen 1970er Jahren den Radikalmechanismus, der u. a. FCKWs in reaktive Radikale überführt, die das Ozon in der Stratosphäre zerstören können.[1] Vor dem Einsatz von FCKW wurde erstmals 1974 gewarnt, doch dies wurde nur in den USA ernst genommen. Die Entdeckung des Ozonlochs 1985 sorgte für einen Meinungswandel. Im Montrealer Protokoll vom 16. September 1987 verpflichteten sich viele Staaten zur drastischen Reduktion der Herstellung von FCKW. Am 29. Juni 1990 beschloss die internationale Konferenz zum Schutz der Ozonschicht in London (siehe auch Londoner Konferenz), die Herstellung und Anwendung von CFK und FCKW ab dem Jahr 2000 zu verbieten oder zumindest stark einzuschränken. Die Einigung sah vor, den FCKW-Einsatz bis 1995 um 50 %, bis 1997 um 85 % zu reduzieren. Ab 2018 wurde öffentlich wahrgenommen, dass eine unbekannte Quelle in Ostasien seit ca. 2012 signifikante FCKW-Mengen von etwa 13.000 t jährlich emittiert.[6][7] Laut Recherchen der Environmental Investigation Agency war dies darauf zurückzuführen, dass zahlreiche chinesische Baustoffhersteller CFC-11 bei der Herstellung von Isolierschaum einsetzen.[8] Die chemische Stabilität macht diese Gase in der Atmosphäre nur schwer abbaubar (mittlere Verweildauer je nach Produkt zwischen 44 und 180 Jahren). Anfang 2021 wurde aufgezeigt, dass die Emissionen aus China stark zurückgegangen sind.[9]
Die wichtigsten FCKW-Kältemittel:
| Bezeichnung | Trivialname | Summenformel | Siedepunkt |
|---|---|---|---|
| Trichlorfluormethan | Frigen 11 | CCl3F | 24,9 °C |
| Dichlordifluormethan | Frigen 12 | CCl2F2 | −30 °C |
| Dichlorfluormethan | Frigen 21 | CHCl2F | 8,9 °C |
| Chlordifluormethan | Frigen 22 | CHClF2 | −40,7 °C |
| 1,1,2-Trichlor-1,2,2-trifluorethan | Frigen 113 | CClF2–CCl2F | 48 °C |
| 1,2-Dichlor-1,1,2,2-tetrafluorethan | Frigen 114 oder Cryofluoran | CClF2–CClF2 | 3,5 °C |
Umwelteinfluss
Die niedermolekularen, wasserstofffreien CFK gelangen aufgrund ihrer chemischen Stabilität und ihrer großen Flüchtigkeit in die Stratosphäre und reagieren mit der Ozonschicht. Beispiel:
Dabei bedeutet ein Photon geeigneter Frequenz[Anm. 1] und ein Chlorradikal.[1]
Das Chlorradikal baut Ozon zu biatomarem (molekularem) Sauerstoff O2 ab. Das an dem Sauerstoff gebundene Chlor wird wieder frei, wobei molekulares Chlor Cl2 entsteht. Durch ein Photon geeigneter Energie werden daraus wieder Chlorradikale freigesetzt, wodurch der Zyklus von vorn beginnen kann:[5]
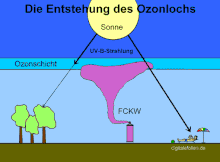
Dadurch wird die Ozonschicht zerstört. Ohne deren Schutzwirkung kann harte UV-Strahlung bis zur Erdoberfläche dringen und Pflanzen, Tiere und Menschen schädigen.
FCKWs absorbieren außerdem Sonnenstrahlung im Infrarotbereich (stärker als CO2) und tragen gemäß ihrem jeweiligen Treibhauspotenzial (in CO2-Äquivalent) unterschiedlich zur globalen Erwärmung bei. Einige FCKW übersteigen das Treibhauspotenzial von Kohlendioxid um das Zehntausendfache.[Anm. 2]
Beschränkungen und Verbote
„FCKWs wurden 1974 in den Vereinigten Staaten verboten.“ Trotz der weltweiten Bemühungen, die Herstellung drastisch zu reduzieren, hatte noch 1997 „der Markt für diese Verbindungen […] ein Volumen von rund 27 Millionen Kilo im Wert von 1,5 Milliarden Dollar. […] In Drittweltländern werden die FCKWs erst 2010 verboten.“[10]
Durch unsachgemäßes Recycling von Altkühlschränken in Deutschland gelangen (Stand: Daten 2006) noch immer große Mengen an FCKW in die Atmosphäre, während in Österreich beim Recycling weit mehr FCKW abgetrennt wird.[11]
Alternativen
Alternativen zu den FCKW-basierten Treibgasen für Aerosol-Zerstäubung sind u. a. HFA-134a, das die Ozonschicht nicht beeinträchtigt, dafür aber den Treibhauseffekt fördert. Meistens wird jedoch ein durch Druck leicht zu verflüssigendes Alkangemisch aus Propan und Butan verwendet, weshalb diese Spraydosen das Gefahrensymbol hochentzündlich tragen. Bei den Kältemitteln bieten sich Propan, Butan, Pentan, Ammoniak, 2,3,3,3-Tetrafluorpropen oder Kohlenstoffdioxid sowie die chlorfreien Kältemittel wie R134a, R404a usw. als Alternativen an, wobei zu beachten ist, dass die ersten drei Substanzen feuergefährlich, Ammoniak und 2,3,3,3-Tetrafluorpropen ätzend und giftig sind.
Als Alternative für FCKW in der Elektronikindustrie bei der Herstellung von Flachbildschirmen, Solarzellen und Mikroschaltkreisen wurde Stickstofftrifluorid empfohlen, das seither eingesetzt wird. Neue Messverfahren wiesen 2008 dessen Konzentration in der Atmosphäre und die bedeutsame Klimaschädigung nach.[12]
Siehe auch
- Fluorkohlenwasserstoffe (FKW)
Literatur
- Ulrich Schurath: Fluorkohlenwasserstoffe – ein Umweltrisiko? In: Chemie in unserer Zeit, 11. Jahrgang, 1977, Nr. 6, S. 181–189, doi:10.1002/ciuz.19770110604.
- Peter Frieß, Andreas Fickers (Hrsg.): Dieter Bärmann und Wolfgang Lohbeck sprechen über „Werbung gegen Umweltzerstörung?“ Die Einführung des ersten FCKW- und FKW-freien Kühlschranks (= TechnikDialog, Heft 8). Deutsches Museum / Lemmens, Bonn 1997, ISBN 3-932306-05-8.[13]
Anmerkungen
- Genauer bedeutet das Plancksche Wirkungsquantum und die Frequenz (siehe Photon).
- Die Angabe stammt aus Bill Bryson: Eine kurze Geschichte von fast allem, 2005, S. 197 und ist belegt mit Wayne Biddle: A Field Guide to the invisible, New York, Henry Holt & Co, 1998, S. 62: „Ein Kilo FCKWs kann mehrere tausend Kilo Ozon aus der Atmosphäre einfangen und vernichten.“
Weblinks
Einzelnachweise
- Vollhardt, K. Peter C.; Schore, Neil E.; Butenschön, Holger: Organische Chemie. 5. Aufl. New York: John Wiley & Sons, 2011, S. 133.
- Spencer Weart: The Discovery of Global Warming: Other Greenhouse Gases. Center of History am American Institute of Physics, aip.org
- J. C. Laube and A. Engel: First atmospheric observations of three chlorofluorocarbons (PDF; 504 kB). in: Atmos. Chem. Phys. Discuss., 2008, 8, S. 6683–6695.
- Kai Stoppel: "FCKW wäre Hinweis auf eine Zivilisation". Abgerufen am 27. November 2019.
- H. Beyer, W. Walter, Fluorierte Kohlenwasserstoffe. Lehrbuch der organischen Chemie, 22. Auflage, S. Hirzel Verlag, Stuttgart 1991, S. 138ff.
- Ozonkiller: Ein verbotener Stoff in der Atmosphäre - WELT. In: welt.de. Abgerufen am 18. Mai 2018.
- Ozone hole-forming chemical emissions increasing and mysterious source in East Asia may be responsible – The Independent. In: independent.co.uk. Abgerufen am 18. Mai 2018 (englisch).
- FCKW: Warum China weiter die gefährliche Chemikalie in die Luft bläst - WELT. In: welt.de. Abgerufen am 10. Oktober 2018.
- Jeff Tollefson: Illegal CFC emissions have stopped since scientists raised alarm. In: Nature. 10. Februar 2021, doi:10.1038/d41586-021-00360-0.
- Produktionsangabe bei Wayne Biddle: Field Guide, 1998, S. 63, in Bill Bryson: Eine kurze Geschichte von fast allem, Goldmann, Ausgabe 2005, S. 207.
- Güven Purtul: „Problemfall im Schredder“, Süddeutsche Zeitung, 17. Mai 2010, abgerufen am 29. November 2020.
- Super-Treibhausgas in der Atmosphäre entdeckt, Scinexx, Springer.
- Dieter Bärmann, Leiter des Produktbereichs Kälte, BSH Bosch und Siemens Hausgeräte GmbH, Hersbruck und Wolfgang Lohbeck, leitender Greenpeace Mitarbeiter.