Blutzucker
Unter Blutzucker versteht man im Allgemeinen den Glucoseanteil im Blut. Glucose ist ein wichtiger Energielieferant des Körpers. Das Gehirn, die roten Blutkörperchen und das Nierenmark sind zur Energiegewinnung auf Glucose angewiesen, alle anderen Körperzellen gewinnen die Energie vorrangig im Fettstoffwechsel. Glucose ist in der Lage, die Blut-Hirn-Schranke zu überwinden und versorgt so das Gehirn.
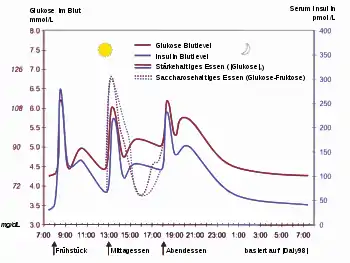
In der Medizin ist der Blutzuckerwert (Blutzuckerspiegel, Glukosespiegel) ein wichtiger Messwert. Ist er dauerhaft erhöht, kann ein Diabetes mellitus vorliegen.
Eine Unterzuckerung kann die Hirnleistung vermindern, Krampfanfälle, eine vermehrte Adrenalinausschüttung und zittrige Hände sowie Schweißausbrüche verursachen. In ausgeprägter Form führt die Unterzuckerung zum Schock. Sie findet sich typischerweise beim sehr seltenen Insulinom, in einigen Fällen aber auch als Frühsymptom eines Typ-2-Diabetes, selten auch ohne weitere Erkrankungen nach einer Mahlzeit mit schnell resorbierbaren Kohlenhydraten. In der Behandlung des Diabetes mellitus ist sie eine häufige Komplikation einiger Medikamente.
Blutzuckermessung
Der Blutzucker kann in einer Blutprobe, zum Beispiel aus Kapillarblut, gemessen werden. Das kann vom Patienten selbst durchgeführt werden oder durch einen Mitarbeiter einer medizinischen Einrichtung oder einer Altenpflege-Einrichtung.
Weiterhin können Messonden appliziert werden, die für etwa 2 Wochem am Patienten verbleiben können und mittels einer Sonde im Unterhautfettgewebe zum Beispiel im Oberarm in enger Folge Werte nehmen. Die Werte werden zum Beispiel maximal aller 4 Stunden über einen RFID-Transponder zu einem Ablese- und Anzeigegerät oder einem smartphone übertragen, indem diese dem Sensor genähert werden. Das jeweilige Gerät hält die Werte dauerhaft gespeichert und ist seinerseits zum Auslesen durch einen Personal Computer (PC) geeignet. Für PC und smartphone stehen für Arzt und Patient Analyse- und Anzeigeprogramme zur Verfügung. Siehe auch Kontinuierlich messender Glucosesensor.
Als Maßeinheit wird in den meisten Ländern die SI-konforme (Internationales Einheitensystem) Einheit mmol/l (Millimol pro Liter) verwendet. Im westlichen Teil Deutschlands (und Berlins) wird wie in den USA, Polen, Frankreich, Italien, Japan oder Österreich in der Regel noch die ältere (allerdings ebenfalls SI-konforme) Einheit mg/dl (Milligramm pro Deziliter, synonym dazu auch die nicht SI-konforme Einheit mg%) verwendet.
Abweichungen (Messfehler) von ±15 % gelten als tolerabel.[2]
Der Blutzuckerspiegel kann mit Blutzuckermessgeräten, die wahlweise mit herstellerseitig programmierten Maßeinheiten entweder in mmol/l oder mg/dl lieferbar sind, bestimmt werden. Dabei sind verschiedene Wirkprinzipien im Einsatz, siehe Abschnitt Messmethoden. Blutzuckermessgeräte zur Selbstuntersuchung für insulinpflichtige Diabetes-Patienten werden von den Krankenkassen bezahlt.
Eine Zeit lang waren Messgeräte im Angebot, die das Ergebnis wahlweise in mg/dl oder in mmol/l anzeigen konnten. Laut Bundesinstitut für Arzneimittel und Medizinprodukte führte dies in mehreren Fällen zu Verwechslungen der zugrunde liegenden Maßeinheit, die eine falsche Dosierung des Insulins zur Folge hatten. Daher sind seit dem vierten Quartal 2006 umstellbare Geräte aus dem Handel genommen worden. Eine ähnliche Problematik gab es in der Schweiz.
Umrechnung mmol/l ↔ mg/dl:
Normalwerte
Beim Menschen betragen die Normalwerte:
- nüchtern: 70–99 mg/dl, entsprechend 3,9–5,5 mmol/l
- nach einer kohlenhydratreichen Mahlzeit:
- maximal bis zu 160 mg/dl, entsprechend 8,9 mmol/l
- unter 140 mg/dl nach 2 Stunden, entsprechend 7,8 mmol/l[3]
Allerdings sind die Werte je nach Literaturquelle und Untersuchungsmaterial (venöses Plasma, venöses Vollblut oder kapilläres Vollblut – siehe Tabellen) unterschiedlich. Werte für Nüchternblutzucker (NBZ) > 5,5 mmol/l bzw. > 99 mg/dl (nach anderen Quellen > 6,1 mmol/l bzw. 110 mg/dl) lassen auf eine gestörte Glucosetoleranz schließen, Nüchternwerte > 125 mg/dl bzw. > 6,9 mmol/l auf einen Diabetes mellitus. Als Komplikation führen deutlich erhöhte Werte im Rahmen einer Wundbehandlung zu einer verlängerten oder gestörten Wundheilung. Gegebenenfalls muss dann bei Diagnose eines Diabetes mellitus zur Unterstützung der Wundheilung mit Insulin behandelt werden.
| Einstufung | Nüchternblutzucker (NBZ, venös) | Blutzucker 2 Stunden nach dem Essen (oder oGTT) (venös) |
|---|---|---|
| Normal | < 110 mg/dl < 6,1 mmol/l | < 140 mg/dl < 7,8 mmol/l |
| Abnorme Nüchternglukose (IFG) | 110–125 mg/dl 6,1–6,9 mmol/l | < 140 mg/dl < 7,8 mmol/l |
| Gestörte Glukosetoleranz (IGT) | < 126 mg/dl < 7,0 mmol/l | 140–200 mg/dl 7,8–11,1 mmol/l |
| Diabetes mellitus | ≥ 126 mg/dl ≥ 7,0 mmol/l | ≥ 200 mg/dl ≥ 11,1 mmol/l |
Abkürzungen in obiger Tabelle
- IFG = impaired fasting glucose (wörtlich: gestörte Nüchternglukose)[5]
- IGT = impaired glucose tolerance (wörtlich: gestörte Glukosetoleranz)[5]
| Blutzuckerkontrolle | Stoffwechsel gesund |
|---|---|
| Blutzucker nüchtern | 65–100 mg/dl 3,6–5,6 mmol/l |
| Blutzucker nach dem Essen | 80–126 mg/dl 4,5–7,0 mmol/l |
| Blutzucker nachts | 65–100 mg/dl 3,6–5,6 mmol/l |
| HbA1c (standardisierter Wert nach DCC-Trials) | < 6,05 % |
| Messung | Normale Werte | Verdacht/ Prädiabetes |
Diabetes mellitus | |
|---|---|---|---|---|
| nüchtern | < 100 mg/dl < 5,6 mmol/l |
100–126 mg/dl 5,6–7,0 mmol/l |
> 126 mg/dl > 7,0 mmol/l | |
| 2 Std. nach dem Essen oder im oGTT |
kapillär | < 140 mg/dl < 7,8 mmol/l |
140–200 mg/dl 7,8–11,1 mmol/l |
> 200 mg/dl > 11,1 mmol/l |
| venös | < 120 mg/dl < 7,0 mmol/l |
120–180 mg/dl 7,0–10,0 mmol/l |
> 180 mg/dl > 10,0 mmol/l | |
| HbA1c | < 6,5 % | 6,5–7,5 % | > 7,5 % | |
Einen zu hohen Blutzuckerwert nennt man Hyperglykämie, einen zu niedrigen Hypoglykämie. Eine Sonderform des Hämoglobin, das HbA1c, ist in der Lage, den Blutzuckerverlauf über maximal drei Monate wiederzugeben und wird deswegen auch das „Blutzuckergedächtnis“ genannt. Hämoglobin ist der rote Blutfarbstoff in den Erythrozyten, der Sauerstoff transportiert. HbA1c ist Hämoglobin, das aufgrund einer zu hohen Blutzuckerkonzentration nicht-enzymatisch glykiert wurde. Das HbA1c gibt Auskunft über die letzten drei Monate, da die Lebensdauer der Erythrocyten 120 Tage beträgt.
Michael Patrick Buonocore (USA), überlebte bei seiner Aufnahme in die Pocono-Notaufnahme in East Stroudsburg am 23. März 2008 einen Blutzuckerspiegel von 147,6 mmol/L (2.656 mg/dl) – 30-mal mehr als der Durchschnittswert. Damit hält er laut Guinness World Records den Rekord für den höchsten überlebten Blutzuckerwert.[8]
Messmethoden
Bei den Blutzuckermessgeräten zur Selbstkontrolle haben sich im Wesentlichen drei Messmethoden etabliert.
Optische Messung
Bei der optischen Messung wird das Blut im Teststreifen über eine Kapillare zu einem von außen sichtbaren Testfeld eingezogen. Dort sind verschiedene chemische Stoffe eingelagert, die mit dem Blut reagieren und eine Farbänderung des Testfeldes zur Folge haben. Diese Farbänderung wird vom Messgerät erfasst und aus der Dauer und Stärke der Änderung der Blutzuckerwert bestimmt.
Mit einem in ein Blutgefäß implantierten Mikrospektrometer könnte die Messung des Blutzuckers im nahen Infrarot-Bereich (NIR) gelingen. Der Sensor übertrüge seine Messwerte mit einem Transponder an ein Anzeigegerät. Entsprechende Forschungen begannen 1998.[9]
An der amerikanischen Northeastern University in Boston war 2011 ein glukose-empfindlicher Sensor in Entwicklung, dessen Nanopartikel nach Art eines Tattoos injiziert werden und bei erhöhten Blutzuckerwerten fluoreszieren.[10]
Amperometrische Messung
Bei der amperometrischen Messung wird das Blut im Teststreifen über eine Kapillare in ein Testfeld gesaugt. Im Testfeld hat das Blut Kontakt zu Glucose-Oxidase und zu verschiedenen Elektroden. Das Messgerät legt an diese Elektroden eine definierte elektrische Spannung (ca. 300–600 mV) an und misst im Zeitverlauf den Strom, der über die Elektroden fließt. Aus dem gemessenen Strom bestimmt das Gerät den Blutzuckerwert. Der Strom ist proportional zur Glukosekonzentration der Flüssigkeit im Containment (Sensorbereich der Kapillare). Auch bei der Nutzung eines kontinuierlich messenden Glucosesensors ist dies die dominierende Methode kommerzieller Anwendungen.[11]
Nichtinvasive Messung
Bei verletzungsfreien, so genannten nichtinvasiven Methoden, kann der Blutzuckerwert angezeigt, verfolgt oder im Zeitverlauf aufgezeichnet werden, ohne Blut entnehmen zu müssen. Grundsätzlich ist mit diesen und ähnlichen Messverfahren eine permanente Aufzeichnung beziehungsweise Darstellung des Zeitverlaufes (Monitoring) des Blutzuckerspiegels möglich.
- Mit einem breitbandigen Laser im mittleren Infrarot-Bereich (MIR) konnten 2003 durch die Haut hindurch verletzungsfrei der Blutzuckerwert mittels „Multiwellenlängen-Densitometrie“ ermittelt werden.[12]
- Eine optische Spektralanalyse des sehr gut durchbluteten Augenhintergrundes konnte 2004 sehr genaue Werte liefern.[13]
An der Brown University war 2014 eine Methode in Entwicklung, mit der mittels Plasmonen-Interferometrie der Glukosegehalt des Speichels gemessen wird.[14][15]
Eine Markteinführung der noninvasiven Blutglucose-Messung durch spektroskopische Messverfahren im Bereich des Nahinfrarotlichts (NIR) mit extracorporal messenden Geräten scheiterte bisher daran, dass die Geräte den Gewebezucker, d. h. Glucose pro Volumen des durchstrahlten Körpergewebes und nicht den Blutzucker pro Blutvolumen bestimmen, weil der Messstrahl das Körpergewebe durchdringen muss.
Glucosebestimmung im Urin
Eine Messung des Glucosegehaltes im Urin ist möglich. Glucose tritt im Urin auf, wenn die Glucosekonzentration im Blut stark erhöht ist und die Nierenschwelle überschritten ist. Die Nierenschwelle ist individuell sehr unterschiedlich und leicht störbar. So kann sie bei Schwangerschaft auf unter 6,7 mmol/l absinken, bei Gesunden kann sie auch über 11,1 mmol/l liegen. Selbst leichte Nierenerkrankungen können die Nierenschwelle verändern.
Regulation
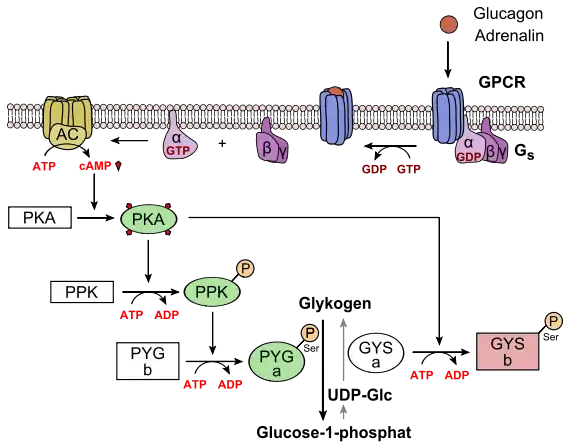
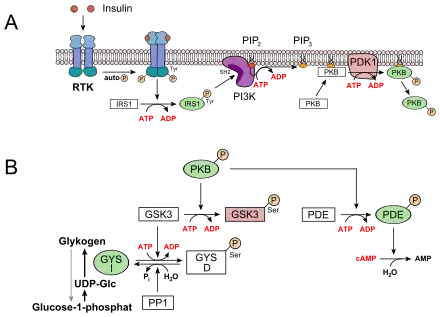
Der Blutzuckerspiegel wird durch das Wechselspiel zweier Peptidhormone der Bauchspeicheldrüse (Pankreas) reguliert. Diese Drüse enthält in ihren α- und β-Zellen Blutzucker-Sensorsysteme, die wie folgt ansprechen:[16]
- bei Abfall des Zuckerspiegels im Blut („Hungersignal“) wird Glucagon sezerniert. Dieses Hormon aktiviert in der Leber die Glycogenphosphorylase (PYG), welche den Abbau von Glykogen zu Glucose einleitet (kataboler Ast) (oberes Bild)
- bei Anstieg des Blutzuckerspiegels wird Insulin sezerniert, das besonders in der Leber eine Serie Glucose-verbrauchender Reaktionen initiiert (anaboler Ast). Von zentraler Bedeutung ist hier die indirekte Aktivierung der Glykogensynthase (GYS), die den Glucose-Überschuss zum Aufbau des Energiespeichers Glykogen („tierische Stärke“) nutzt (unteres Bild)
Außerdem aktiviert Adrenalin in den Skelettmuskelzellen die Glycogenphosphorylase. Auch erhöhte Adenosinmonophosphat-Spiegel in Leber und Muskulatur aktivieren das Enzym, ebenso die Calciumfreisetzung aus dem sarkoplasmatischen Retikulum mit anschließender Bindung an Calmodulin.[16]
Glykogenab- und -aufbau sind über die Phosphorylierung der Schlüsselenzyme Glykogenphosphorylase (PYG) und Glykogensynthase (GYS) strikt gegenläufig reguliert, verlaufen also nie gleichzeitig. In Energiemangelsituationen werden beide Enzyme durch Kinasen phosphoryliert; dieser Vorgang stimuliert die Phosphorylase, hemmt aber die Synthase. Bei Glucoseüberschuss wird die Situation durch Wirkung von Phosphatasen in das Gegenteil verkehrt: Verlust der Phosphatreste inaktiviert PYG, aktiviert aber GYS.[16]
Sowohl das Glucagon- als auch das Insulinsignal werden über Signalkaskaden verstärkt. Im Zentrum beider Signalwege stehen Proteinkinasen: Jede Kinase phosphoryliert mehrere Moleküle einer nachgeschalteten Kinase.
- Im Fall des Glucagons bzw. Adrenalins wird ein G-Protein-abhängiger Rezeptor (GPCR, Sieben-Transmembran-Helix-Typ) angesteuert. Über das Gs-Protein wird Adenylatcyclase aktiviert, ein Enzym, das den second messenger cAMP produziert. Hierdurch wird die Proteinkinase A (PKA)-Kaskade initiiert, an deren Ende die Glykogenphosphorylase (PYG) steht. Nach Phosphorylierung wird sie aktiviert (PYG a). Diese setzt Glucose-1-phosphat aus Glykogen frei, was zu Glucose-6-phosphat isomerisiert wird und in die Glykolyse eintreten kann. Gleichzeitig phosphoryliert PKA auch die Glykogensynthase (GYS a), die in ihrer phosphorylierten Form (GYS b) inaktiv ist.[17]
- Im Fall des Insulins wird eine Rezeptor-Tyrosinkinase (RTK) aktiviert. Auf dem Wege einer komplexen Signaltransduktion wird hier u. a. die Proteinkinase B (PKB) aktiviert (siehe unteres Bild, A). PKB phosphoryliert die Glykogensynthase-Kinase 3, GSK3, die dadurch inaktiviert wird. GSK3 ist eine Kinase, die die Glykogensynthase phosphoryliert und damit inaktiviert (GYS b). GSK3 steht in Konkurrenz zu einer Phosphatase, der Protein-Phosphatase 1 (PP1). Dadurch, dass GSK3 nicht mehr wirken kann, liegt daher immer mehr Glykogensynthase in seiner dephosphorylierten Form vor (GYS I, siehe unteres Bild, B). Außerdem aktiviert die PKB eine Phosphodiesterase, PDE, die cAMP zu AMP hydrolysiert. Infolgedessen erlischt zusätzlich der Signalweg für die PKA.
Siehe auch
Weblinks
Einzelnachweise
- Mark E Daly: Acute effects on insulin sensitivity and diurnal metabolic profiles of a high-sucrose compared with a high starch diet. (PDF) In: American Society for Clinical Nutrition (Hrsg.): Am J Clin Nutr 1998. Nr. 67, 1998, S. 1186–1196. Abgerufen am 19. Februar 2011.
- Mitteilung der Firma Kliniken Bad Bocklet AG zu Ungenauigkeiten der Blutzuckermessungen, abgerufen am 26. Jan. 2022
- Leitlinie für die postprandiale Diabeteseinstellung (PDF; 920 kB) International Diabetes Federation. S. 22. 2008. Archiviert vom Original am 28. Juni 2011. Abgerufen am 30. Juli 2011.
- Definition and Diagnosis of Diabetes Mellitus and Intermediate Hyperglycemia (englisch, PDF; 1,6 MB) In: World Health Organization. who.int. S. 36. 2006. Abgerufen am 20. Februar 2011.
- M. A. Rahim, A. K. Azad Khan, Q. Nahar, S. M. Ali, A. Hussain: Impaired fasting glucose and impaired glucose tolerance in rural population of Bangladesh. In: Bangladesh Medical Research Council bulletin, Band 36, Nummer 2, August 2010, S. 47–51, PMID 21473200, ISSN 0377-9238.
- Paul-Martin Holterhus u. a.: Diagnostik, Therapie, Verlaufskontrolle des Diabetes Mellitus im Kindes und Jugendalter (PDF), deutsche-diabetes-gesellschaft.de, 2010, S. 18 (Abgerufen am 20. Februar 2011).
- W. Kerner, J. Brückel: Definition, Klassifikation und Diagnostik des Diabetes mellitus (PDF; 846 kB) DDG. 1. Oktober 2012. Abgerufen am 1. April 2013.
- Highest blood sugar level. Abgerufen am 28. November 2021 (deutsch).
- Steffen Leonhardt: In vivo Messung und Regelung des Blutzuckerspiegels,
- Clark Lab | Nanosensors. In: nuweb9.neu.edu. Archiviert vom Original am 27. Juli 2011; abgerufen am 27. Juli 2011.
- E. F. Pfeiffer: The glucose sensor: the missing link in diabetes therapy. In: Horm Metab. Res. Band 24, 1990, S. 154–164.
- Towards Broad Gain Mid-IR Lasers. (PDF; 1,7 MB) Fraunhofer-Institut IAF, 2003.
- Nichtinvasive Blutzuckermessung. (Memento vom 6. Juli 2007 im Internet Archive) Universität Karlsruhe, Institut für Technik und Informationsverarbeitung, 2004.
- Vince S. Siu, Jing Feng, Patrick W. Flanigan, G. Tayhas R. Palmore, Domenico Pacifici: A “plasmonic cuvette”: dye chemistry coupled to plasmonic interferometry for glucose sensing. In: Nanophotonics. Band 3, Nr. 3, 6. Mai 2014, S. 125–140, doi:10.1515/nanoph-2013-0057.
- J Feng, VS Siu, A Roelke, V Mehta, SY Rhieu, GT Palmore, D Pacifici: Nanoscale plasmonic interferometers for multispectral, high-throughput biochemical sensing. In: Nano Lett. Band 12, Nr. 2, 8. Februar 2012, S. 602–609, doi:10.1021/nl203325s, PMID 22200183.
- Gisela Boeck, Ulrike Bommas-Ebert, Timo Brandenburger: Prüfungswissen Physikum. Georg Thieme, Stuttgart 2009, ISBN 978-3-13-152131-6, S. 521.
- Horace Robert Horton: Biochemie. Pearson Deutschland, 2008, ISBN 978-3-8273-7312-0, S. 504.