Hypofluorige Säure
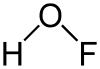
Als Hypofluorige Säure, selten auch Hydroxylfluorid oder veraltet Unterfluorige Säure genannt, bezeichnet man die einzige bekannte Sauerstoffsäure des Fluors. Sie besitzt die Summenformel HOF. Ihre Salze würden als Hypofluorite bezeichnet, sind jedoch unbekannt. Formal besitzt Sauerstoff in dieser Verbindung die Oxidationsstufe 0.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Allgemeines | ||||||||||
| Name | Hypofluorige Säure | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | HOF | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 36,01 g·mol−1 | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
10–20 °C[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Hypofluorige Säure entsteht in geringen Mengen neben Flusssäure und Sauerstoff bei der Reaktion molekularen Fluors mit Eis bei −40 °C. Durch Ausfrieren in einer mit flüssigem Stickstoff gekühlten Kühlfalle kann sie als weißer Feststoff erhalten werden.
Bei dieser Reaktion entsteht Hypofluorige Säure effektiv jedoch nicht in dieser Stöchiometrie, da ein großer Teil der gebildeten Säure sofort weiter reagiert und nur der kleinere Teil erhalten werden kann.
Eigenschaften
Physikalische Eigenschaften
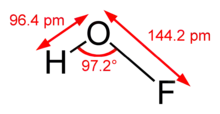
Hypofluorige Säure ist gewinkelt aufgebaut (Bindungswinkel von 97,2°). Die Bindungslänge O–H beträgt 96,4 pm, die von O–F 144,2 pm.[3]
Chemische Eigenschaften
Hypofluorige Säure ist instabil und zersetzt sich unter Bildung von Flusssäure und Sauerstoff.
Sie ist ein sehr starkes Oxidationsmittel.
Die Salze der Hypofluorigen Säure sind unbekannt. Lediglich von der protonierten Form der freien Säure (H2OF+) können wenige Salze auf aufwendigem Wege erhalten werden.
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 466.