Graphitfluorid
Graphitfluorid, CFx ist eine nicht stöchiometrische, feste Fluorkohlenstoffverbindung, in der x Werte zwischen 0 und 1,24 annehmen kann.[3] In Abhängigkeit vom Fluorgehalt erscheint Graphitfluorid schwarz (x ≤ 0,9), braungrau (0,9 < x ≤ 1,0) oder creme-weiß (x > 1,0). Graphitfluorid wurde erstmals in den 1930er Jahren von Otto Ruff und Bretschneider durch Reaktion von Aktivkohle oder Graphit mit Fluor bei erhöhter Temperatur synthetisiert.[4]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Graphitfluorid | |||||||||||||||
| Summenformel | CFx | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 31,01 g·mol−1 für x=1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
(−178,029·x + 4,519) kJ·mol−1[3] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Graphitfluorid kann durch Reaktion von geordnetem Kohlenstoff, wie z. B. Graphit, aber auch von ungeordneten Substraten nach Wärmebehandlung wie z. B. Pyrolysekoks und selbst Flammruß mit Fluor im Temperaturbereich von 400 bis 700 °C erzeugt werden. Grundsätzlich liefert ein hochgeordnetes Material wie Graphit stets einen höheren Anteil an Graphitfluorid als z. B. ein "graphitierter" Flammruß, bei welchem der Anteil flüchtiger Fluorkohlenstoffe, wie z. B. Tetrafluormethan, CF4 dominiert.[5] Bei höheren Temperaturen (ab 700 °C) werden ausschließlich flüchtige Fluorkohlenstoffverbindungen gebildet.[3][6]
Struktur
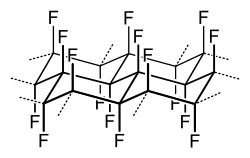
Bei der Fluorierung des Graphits bleibt dessen Schichtstruktur grundsätzlich erhalten. Allerdings wird der Abstand der Kohlenstoffschichten je nach Präparationsart und Zusammensetzung des Graphitfluorids durch Ausbildung der tertiären C–F-Einheiten und deren starker elektrostatischer Abstoßung signifikant von 335 pm bei Graphit auf bis zu 580 – 615 pm aufgeweitet. Der Aufbau der Schichten ist allerdings turbostratisch, d. h. aufeinanderliegende Schichten sind zwar parallel, nehmen aber zueinander keine Vorzugsorientierung ein. Die einzelnen C6F6-Elemente der Schichten liegen in einer Sesselkonformation mit jeweils axial stehenden Fluoratomen vor, wie in der obigen Strukturformel abgebildet.[3][6] Im Gegensatz zu Graphitfluorid, das eine Fluorkohlenstoffverbindung mit kovalenten C-F-Bindungen darstellt, können durch Reaktion von Fluor mit z. B. Kohlenstoff bei niedrigen Temperaturen auch verschiedenste Graphit-Fluor-Interkalationsverbindungen der allgemeinen Zusammensetzung, CyF mit y = 2–10, erzeugt werden.[7]
Eigenschaften
Im Gegensatz zum anisotropen elektrischen Leiter Graphit ist dessen Reaktionsprodukt Graphitfluorid, mit der idealen Stöchiometrie CF, ein Isolator. Bei einem Fluorierungsgrad unterhalb x = 0,9 leitet Graphitfluorid den elektrischen Strom ebenso wie Graphit. Graphitfluorid ist ein superhydrophobes Material und zeigt mit Wasser einen Kontaktwinkel von 143°, während Polytetrafluorethylen zum Vergleich einen Kontaktwinkel von 109° liefert[5]. Graphitfluorid mit Stöchiometrien zwischen x = 0,61 – 1,12 zeigt hervorragende Schmiereigenschaften speziell im hohen Temperaturbereich, die weder von Molybdaensulfid noch von Graphit erreicht werden.[3] Graphitfluorid zersetzt sich bei Temperaturen ab 600 °C im Wesentlichen unter Dismutation zu Difluorcarben, Tetrafluorethen und Blähgraphit.[8][9]
Verwendung
Graphitfluorid wird heute hauptsächlich als kathodischer Depolarisator in der Lithium-Kohlenstoffmonofluorid-Batterie verwendet.[5] Es beschleunigt den Ausbrand von Bor in Festtreibstoffzusammensetzungen durch wirksame Entfernung der Oxidschicht unter Bildung von Kohlenmonoxid und Bortrifluorid.[10] Darüber hinaus ist es ein sehr energiereiches Oxidationsmittel in Infrarot-Täuschkörpern[11][12] und luftatmenden Antrieben[13] Bei der exothermen Reaktion von Graphitfluorid mit Reduktionsmitteln werden unter anderem auch nanostrukturierte Reaktionsprodukte wie z. B. SiC-Fasern[14] und Kohlenstoffnanotubes[15] gebildet. In heißem Sulfolan (50 °C) dispergiertes Graphitfluorid liefert durch Ultraschall-induzierte Exfoliation Graphenfluorid[16].
Einzelnachweise
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Carbon fluoride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 26. Mai 2020.
- Datenblatt Graphitfluorid bei Sigma-Aldrich, abgerufen am 13. Juni 2011 (PDF).
- P. Kamarchik Jr., J. L. Margrave, Poly(carbon monofluoride): A Solid, Layered Fluorocarbon, Acc. Chem. Res., 11, 1978, 296. doi:10.1021/ar50128a002
- O. Ruff, O. Bretschneider, Die Reaktionsprodukte der verschiedenen Kohlenstoffformen mit Fluor II (Kohlenstoff-monofluorid), Z. anorg. u. allg. Chem., 217, 1934, 1. doi:10.1002/zaac.19342170102
- T. Nakajima., N. Watanabe, Graphite Fluorides and Carbon-Fluorine Compounds, CRC Press, Boca Raton, 1990
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- M. S. Dresselhaus, M. Endo, J.-P. Issi, Physical Properties of Fluorine- and Fluoride-Graphite Intercalation Compounds, in T. Nakajima (Ed.), Fluorine-Carbon and Fluoride Carbon Materials, Marcel Dekker, New York, 1995, 95
- N. Watanabe, S. Koyama, H. Imoto, Thermal Decomposition of Graphite Fluoride. I. Decomposition Products of Graphite Fluoride, (CF)n in a Vacuum, Bull. Chem. Soc. Jpn., 53 1980, 2731. doi:10.1246/bcsj.53.2731
- Gong Chen, Zhongning Shi, Jiangyu Yu, Zhaowen Wang, Junli Xu, Bingliang Gao, Xianwei Hua: Kinetic analysis of the non-isothermal decomposition of carbon monofluoride, Thermochim. Acta, 589, 2014, 63–69, doi:10.1016/j.tca.2014.05.002
- T.-K. Liu, I.-M. Shyu, Y.-S. Hsia, Effect of Fluorinated Graphite on Combustion of Boron and Boron-Based Fuel-Rich Propellants, J. Propul. Power, 12, 1996, 26. doi:10.2514/3.23986
- E.-C. Koch, Pyrotechnic composition for producing IR-radiation US-Patent 6635130, 2003. US-Patent 6635130
- E.-C. Koch, Metal/Fluorocarbon Pyrolants: VI. Combustion behaviour and Radiation Properties of Magnesium/Poly(carbon Monofluoride) Pyrolant, Propellants Explos. Pyrotech., 30, 2005, 209. doi:10.1002/prep.200500007
- J. L. Fields, Combustible Compositions for Air Augmented Rocket Engines US-Patent 6736912, 2004, 2731. US-Patent 6736912
- S: Cudzilo, M. Szala, A. Huczko, M. Bystrzejewski, Combustion Reactions of Poly(Carbon Monofluoride), (CF)n, with Different Reductants and Characterization of the Products, Propellants Explos. Pyrotech., 32, 2007, 149. doi:10.1002/prep.200700015
- E.-C. Koch, Verfahren zur Herstellung von Kohlenstoffallotropen und deren Intercalaten bzw. Endohedralverbindungen, DE Patent 10122750B4 2008
- Radek Zborˇil, Frantisˇek Karlicky´, Athanasios B. Bourlinos, Theodore A. Steriotis, Athanasios K. Stubos, Vasilios Georgakilas, Klára Sˇafárˇová, Dalibor Jancˇík, Christos Trapalis, and Michal Otyepka, Graphene Fluoride: A Stable Stoichiometric Graphene Derivative and its Chemical Conversion to Graphene, Small, 6: 2885–2891. doi:10.1002/smll.201001401
Quellen
- Erwin Riedel: Anorganische Chemie, 6. Auflage, de Gruyter, Berlin 2004, S. 516, ISBN 3-11-018168-1.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 846.
