Propan
Propan ist ein farbloses brennbares Gas und gehört zu den Kohlenwasserstoffen. Es steht in der homologen Reihe der Alkane an dritter Stelle.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
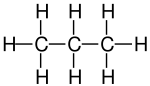 | |||||||||||||||||||
| Strukturformel mit allen gezeichneten Atomen (oben) – vereinfachte Skelettformel (unten) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Propan | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C3H8 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloses Gas[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 44,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−42,1 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
51[4] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (75 mg·l−1 bei 20 °C)[3] | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−103,8 kJ/mol[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Eigenschaften
Propan ist ein farbloses Gas, hat einen Schmelzpunkt von −187,7 °C und einen Siedepunkt von −42,1 °C. Die kritische Temperatur liegt bei 96,8 °C,[9] der kritische Druck bei 4,2 MPa[9] und die kritische Dichte bei 0,22 g·cm−3.[9]
Propan kristallisiert in der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2).[10][11] Dabei ist die Packung der Moleküle ziemlich schlecht, die Raumfüllung beträgt bei 90 K nur 58,55 %.[12] Dies ist der Grund dafür, dass der Schmelzpunkt tiefer liegt als bei allen anderen Alkanen.
Durch Kompression kann Propan verflüssigt werden. Es löst sich nur wenig in Wasser: bei 20 °C zu 75 mg·l−1.[3]
Propan ist schwerer als Luft und wirkt in hohen Konzentrationen narkotisierend bis erstickend.[9]
Propan ist hochentzündlich und bildet zwischen einem Volumenanteil von 2,12 % bis 9,35 % in Luft explosionsfähige Gemische.[9] Seine Zündtemperatur liegt bei 470 °C (nach DIN 51794).[3] Der Heizwert beträgt 93 MJ·m−3[9] oder 46,35 MJ/kg (12,88 kWh/kg).
Herstellung
Propan ist ein natürlich vorkommendes Gas. Es entsteht zusammen mit anderen Kohlenwasserstoffen wie Erdöl und Butan durch die Zersetzung und Reaktion organischer Stoffe innerhalb langer Zeiträume. Propan wird aus Erdölfeldern freigesetzt, indem es von anderen Kohlenwasserstoffen getrennt und für den kommerziellen Gebrauch raffiniert wird.
Die Propanherstellung geschieht durch Trennung und Sammlung des Gases aus seinen Erdölquellen. Propan wird durch Abtrennung von der Erdgasphase von Erdöl und durch Raffination von Rohöl aus petrochemischen Gemischen isoliert.
Beide Prozesse beginnen, wenn unterirdische Ölfelder durch Bohren von Ölquellen erschlossen werden. Das Kohlenwasserstoffgemisch wird aus dem Bohrloch in eine Gasfalle geleitet, die den Strom in Rohöl und Gas trennt, das Erdbenzin, Flüssiggase und Erdgas enthält. Das Gemisch von Flüssiggasen kann als Gemisch verwendet oder weiter in seine drei Teile Butan, Isobutan und Propan getrennt werden.[13]
Industriell wird Propan bei der Förderung von Erdgas als Nebenprodukt gewonnen und in einer Erdölraffinerie beim Cracken von Erdöl hergestellt.[9]
Im Labor kann Propan durch eine Addition von Wasserstoff an Propen synthetisiert werden:

Damit die Additionsreaktion ablaufen kann, werden z. B. Platin- oder Palladiumkatalysatoren verwendet.
Verwendung
Energiequelle


Der Verbrauch nimmt in Gebieten ohne Erdgasnetz rasant zu. Propan hat viele ältere traditionelle Energiequellen ersetzt.
Propan wird als Flüssiggas gespeichert und sehr vielseitig eingesetzt,[9] z. B. als Autogas (LPG) zum Betrieb von Verbrennungsmotoren, in der Feuerung von Heißluftballonen, in Gasherden, Gasgrills, Gas-Rechauds, Gasboilern und für Feuerzeuge, Löt- und Schweißgeräte etc. Meist wird es je nach Jahreszeit mit Butan gemischt.
Zu den Industrien, die Propan verwenden, gehören Glashersteller, Ziegeleien, Geflügelfarmen etc. In ländlichen Gebieten wird es zur Beheizung von Viehbeständen, in Getreidetrocknern und anderen wärmeerzeugenden Geräten verwendet. Wenn es zum Erhitzen oder Trocknen von Getreide verwendet wird, wird es normalerweise in einem großen, fest installierten Gastank aufbewahrt, der von einem Propan-Lieferwagen nachgefüllt wird.[14]
Kältemittel
Als Kältemittel[9] hat es die Bezeichnung R-290 und wird in Kühlgeräten und Wärmepumpen[15] eingesetzt. In Australien wird Propan schon in über 1.000.000 Auto-Klimaanlagen eingesetzt.[16] Propan hat ein niedriges Treibhauspotenzial (das 3,3fache der gleichen Menge Kohlenstoffdioxid), kein Ozonabbaupotential und kann als Ersatz für R-12, R-22, R-134a und andere Fluorchlorkohlenwasserstoffe dienen. Alte Anlagen dürfen aber nicht einfach mit Propan gefüllt werden, da es brennbar ist. Für Propananlagen sind eigene Sicherheitsvorschriften zu erfüllen.
Sonstiges
Propan ist möglicher Bestandteil des Treibgases in Sprühdosen (Lebensmittelzusatzstoff E 944[17]) und Airsofts. Großtechnisch wird es zur Herstellung von Ethen und Propen verwendet.[9]
Lagerung

Propan wird unter Druck verflüssigt in Gasflaschen oder Tanks aus Metall oder Verbundwerkstoffen gelagert. Der Flascheninnendruck wird ausschließlich durch den Dampfdruck der Verbindung bestimmt und ist nur abhängig von der Umgebungstemperatur. Er ist folglich nicht vom Füllgrad der Druckgasflasche bestimmt und beträgt zum Beispiel 4,7 bar bei 0 °C, 8,4 bar bei 20 °C und 17,1 bar bei 50 °C.[18] Der Innendruck sinkt (wie bei allen unter Druck gelagerten Flüssiggasen) erst dann, wenn alles flüssige Propan verdampft ist.
Weiterhin wird es auch in unterirdischen Kavernen gelagert. Das Einlagern geschieht vorzugsweise in den verbrauchsarmen Monaten, um Verbrauchsspitzen im Winter abdecken zu können.
Reaktionen
Propan verbrennt mit ausreichend viel Sauerstoff zu Kohlenstoffdioxid und Wasser:
Wenn nicht genügend Sauerstoff für eine vollständige Verbrennung vorhanden ist, tritt eine unvollständige Verbrennung auf. Neben Kohlenstoffdioxid, Wasser und Wärme entsteht dann aber auch Kohlenstoffmonoxid.[19]
Weblinks
- Technische Daten Flüssiggas. (Nicht mehr online verfügbar.) RVV Bachert KG, archiviert vom Original am 4. Juni 2009.
Einzelnachweise
- Eintrag zu PROPANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 21. Februar 2020.
- Eintrag zu E 944: Propane in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 11. August 2020.
- Eintrag zu Propan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- March, Jerry, 1929-1997.: March's advanced organic chemistry : reactions, mechanisms, and structure. 6th ed. Wiley-Interscience, Hoboken, N.J. 2007, ISBN 0-471-72091-7.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- Eintrag zu Propane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 74-98-6 bzw. Propan), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- Eintrag zu Propan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- Roland Boese, Hans-Christoph Weiss, Dieter Bläser: The Melting Point Alternation in the Short-Chainn-Alkanes: Single-Crystal X-Ray Analyses of Propane at 30 K and ofn-Butane ton-Nonane at 90 K. In: Angewandte Chemie International Edition. 38, 1999, S. 988, doi:10.1002/(SICI)1521-3773(19990401)38:7<988::AID-ANIE988>3.0.CO;2-0.
- Visualisierung Räumliche Darstellung von Molekülen und Kristallstrukturen bei log-web.de, abgerufen am 28. Juni 2016.
- Marcin Podsiadło, Anna Olejniczak, and Andrzej Katrusiak: Why Propane? The Journal of Physical Chemistry C, 2013, 117, 4759–4763.
- Advameg, Inc.: Propane
- Sloan, Michael: 2016 Propane Market Outlook. Propane Education and Research Council.
- Manfred Petz (Hrsg.): Kohlenwasserstoffe als Kältemittel. Expert-Verlag, 1995, ISBN 3-8169-1186-2, S. 59–76.
- Umweltbundesamt: Natural Refrigerants for mobile Air-Conditioning in Passenger Cars.
- ZZulV: Text der Zusatzstoff-Zulassungsverordnung
- DGUV Publikationen: Umgang mit ortsbeweglichen Flüssiggasflaschen im Brandeinsatz, abgerufen am 6. Juni 2020.
- Elgas Ltd.: LPG Gas Blog

