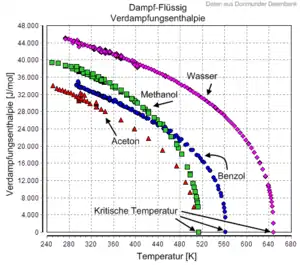
Kritischer Punkt (Thermodynamik)
In der Thermodynamik ist der kritische Punkt ein thermodynamischer Zustand eines Stoffes, der sich durch Angleichen der Dichte von flüssiger und gasförmiger Phase kennzeichnet. Die Unterschiede zwischen beiden Aggregatzuständen hören an diesem Punkt auf zu existieren. Im Phasendiagramm stellt der Punkt das obere Ende der Dampfdruckkurve dar.
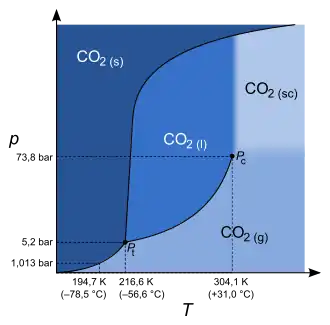
Charakterisierung
Der kritische Punkt Pc ist durch drei Zustandsgrößen ausgezeichnet:
- die kritische Temperatur Tc
- den kritischen Druck pc
- die kritische Dichte c bzw. das kritische Molvolumen Vm, c.
Insbesondere in Mehrkomponentensystemen werden Gase in Systemen oberhalb von deren kritischer Temperatur, aber in Anwesenheit nicht-kritischer Stoffe, als nicht-kondensierbare Komponenten bezeichnet. Diese können z. B. bei der thermodynamischen Beschreibung der Absorption von Bedeutung sein.
Da oberhalb des kritischen Punktes Flüssigkeit und Gas nicht mehr voneinander unterschieden werden können, spricht man stattdessen von einem überkritischen Fluid, das sich in einem überkritischen Zustand befindet. Eine weitere, aus dem englischen Sprachraum stammende Bezeichnung ist superkritisch.
Bei Annäherung an den kritischen Punkt nähern sich die Dichte des gasförmigen und des flüssigen Zustands einander an, die Verdampfungsenthalpie sinkt bei der Annäherung an den kritischen Punkt und verschwindet bei seinem Erreichen ganz. Knapp unterhalb des kritischen Punktes kann man das Phänomen der kritischen Opaleszenz beobachten: Aufgrund der extrem niedrigen Verdampfungsenthalpie wechseln Teile der Substanz ständig zwischen flüssigem und gasförmigem Zustand hin und her, was zu einer sichtbaren Schlierenbildung führt.
Auf molekularer Ebene lässt sich das Verhalten oberhalb des kritischen Punkts anschaulich beschreiben: Wird ein Gas einem immer höheren Druck ausgesetzt, so verringern sich die Abstände zwischen den Gasmolekülen kontinuierlich. Bei Erreichen des kritischen Drucks werden die Abstände dann genau so groß wie zwischen den Molekülen in der flüssigen Phase; es ist kein Unterschied mehr feststellbar.
Kritische Temperatur und Druckverflüssigung
| Stoff | Temperatur | Druck | Dichte | ||
|---|---|---|---|---|---|
| Name | Summenformel | K | °C | bar | kg/m3 |
| Wasser | H2O | 647,10 | 373,95 | 220,64 | 322 |
| Wasserstoff | H2 | 33,19 | −239,96 | 13,15 | 30 |
| Sauerstoff | O2 | 154,60 | −118,55 | 50,46 | 427 |
| Stickstoff | N2 | 126,19 | −146,96 | 33,96 | 313 |
| Kohlendioxid | CO2 | 304,13 | 30,98 | 73,77 | 468 |
| Ammoniak | NH3 | 405,40 | 132,25 | 113,59 | 225 |
| Methan | CH4 | 190,56 | −82,59 | 45,99 | 163 |
| Propan | C3H8 | 369,82 | 96,67 | 42,48 | 221 |
| Butan | C4H10 | 425,13 | 151,98 | 37,96 | 228 |
| Helium | He | 5,20 | −267,95 | 2,27 | 70 |
| Xenon | Xe | 289,73 | 16,58 | 58,42 | 1103 |
| Ethanol | C2H6O | 513,90 | 240,75 | 61,48 | 276 |
| Methanol | CH4O | 513,38 | 240,23 | 82,16 | 282 |
Eine besondere technische Bedeutung hat die kritische Temperatur. Dies ist die Temperatur, unterhalb derer ein Gas durch Druck verflüssigt werden kann, während dies oberhalb der kritischen Temperatur nicht mehr möglich ist. Die Isotherme der kritischen Temperatur teilt damit das T-s-Diagramm eines Stoffes in einen Bereich, bei dem Druckverflüssigung möglich ist, und in einen Bereich, in dem Druckverflüssigung nicht mehr möglich ist.
Diese Eigenschaft lässt sich im T-s-Diagramm eines Stoffes für eine bestimmte Temperatur überprüfen, wenn man zu einer bestimmten Temperatur die Isotherme verfolgt, bei der das Gas gespeichert werden soll:
- Wenn die Isotherme bei steigendem Druck ins Nassdampfgebiet reicht (die Taulinie überschreitet), ist eine Verflüssigung bei dieser Temperatur und erhöhtem Druck möglich.
- Wenn die Isotherme dagegen oberhalb des Nassdampfgebietes über den kritischen Punkt in den überkritischen Bereich verläuft, ist bei dieser Temperatur nur eine Verdichtung, aber keine Verflüssigung möglich.
Um das Gas dennoch verflüssigt zu speichern, muss es zusätzlich soweit abgekühlt werden, dass die Isotherme der niedrigeren Temperatur wieder ins Nassdampfgebiet (also unterhalb des kritischen Punktes) eintritt. Wird die kritische Temperatur gerade so unterschritten, so muss auch noch der Druck den kritischen Druck überschreiten, um die Verflüssigung einzuleiten. Ist der kritische Druck jedoch für die Anwendung bzw. Lagerung zu hoch, dann muss eine tiefere Temperatur gewählt werden, um mit entsprechend niedrigerem Druck die Verflüssigung zu erreichen.
Die flüssige Phase bleibt nur so lange stabil, wie die Temperatur unterhalb der kritischen Temperatur bleibt. In einem kälteisolierenden Tank (Kryotank) ohne aktive Kühlung wird daher zugelassen, dass ein Teil der Flüssigkeit verdampft und die dabei entzogene Wärme mit dem Gas den Tank verlässt.
Bei technischen Gasen, die in normalen Gasflaschen bei Umgebungstemperatur transportiert und gelagert werden, können nur Gase mit hoher kritischer Temperatur verflüssigt werden, wie beispielsweise Propan oder Butan. Die kritische Temperatur des Gases muss nämlich so hoch sein, dass sie bei Lagerung, Transport und Einsatz sicher nie überschritten wird.
Flüssiger Stickstoff (LN2) wird beispielsweise gekühlt zum Verbraucher transportiert (kälter als −146,96 °C), wobei die Kühlung meist – wie oben beschrieben – durch Abdampfen des Stickstoffs (und damit Verlust) erhalten wird. Ähnliches gilt für flüssigen Wasserstoff (LH2): In Versuchsfahrzeugen wie dem BMW Hydrogen 7 wird der als Kraftstoff verwendete Wasserstoff permanent aus dem Kryotank abgelassen und bei stehendem Motor in die Umgebung abgeführt.
In Gasflaschen für den industriellen Gebrauch befindet sich dagegen gasförmiger Wasserstoff oder Stickstoff, der unter hohem Druck steht. Die Gasflaschen sind für die hohen Drücke (bis 200 bar) ausgelegt. Ähnliches gilt für CNG-Tanks in Fahrzeugen.
Kritischer Druck
Ein besonderes Verhalten von Flüssigkeiten zeigt sich, wenn sie in flüssigem Zustand unterhalb der kritischen Temperatur mit einem Druck oberhalb des kritischen Druckes beaufschlagt werden. Werden diese Flüssigkeiten erhitzt, so zeigt sich eine kontinuierliche Volumenvergrößerung unter Wärmezufuhr, ohne dass sich in der Flüssigkeit irgendwann Dampfblasen bilden[2]. Die Moleküle des Fluids rücken einfach immer nur weiter auseinander, die sprunghafte Änderung der physikalischen Eigenschaften, wie beim Sieden von Wasser unter Normaldruck, bleiben aus. Dieses Verhalten bestimmt beispielsweise den Prozess in Kraftwerken, wo mit einer Speisewasserpumpe flüssiges Wasser mit überkritische Druck einem Wärmetauscher zugeführt wird, um es auf eine überkritische Temperatur zu erhitzen. Am Ende des Wärmetauschers wird das überkritische Fluid der Dampfturbine zugeführt.
Experimentelle Beobachtung

2: Kritischer Punkt, Opaleszenz
3: Überkritisches Ethan, Fluid[3]
Der Übergang vom unterkritischen in den überkritischen Zustand lässt sich gut beobachten, da am kritischen Punkt eine deutlich sichtbare Änderung der Phasen stattfindet.
Die Stoffe werden dabei in dickwandigen Rohren aus Quarzglas unter Druck eingeschlossen. Unterhalb der kritischen Temperatur (beispielsweise etwa 304,2 K bei Kohlenstoffdioxid bzw. 305,41 K bei Ethan) ist das Rohr zum Teil mit der flüssigen Substanz, zum anderen Teil mit dem Dampf der Substanz gefüllt. Beide Phasen sind farblos, klar durchsichtig und durch die deutlich sichtbare Flüssigkeitsoberfläche (Phasengrenzfläche) getrennt. Beim Erwärmen unterhalb der kritischen Temperatur nimmt zunächst das Volumen der Flüssigkeit durch thermische Ausdehnung zu, während das Volumen des Dampfes infolge Kompression abnimmt. Hat die Substanz die kritische Temperatur erreicht, so bildet sich kurzzeitig ein dichter Nebel (kritische Opaleszenz), der sich nach wenigen Sekunden weiterer Erwärmung wieder auflöst. Dieser Nebel kann auch deutliche Färbungen aufweisen; CO2 und Ethan weisen keine Färbung auf, der Nebel ist weiß. Das Rohr ist danach mit einer einzigen homogenen, klar durchsichtigen Phase, dem überkritischen Fluid, gefüllt. Beim Abkühlen tritt wieder kurzzeitig Nebel auf, bevor sich die Substanz in eine flüssige und eine gasförmige Phase teilt.
Abschätzung und Berechnung
Die kritischen Zustandsgrößen können neben einer vergleichsweise aufwändigen empirischen Messung auch aus der Van-der-Waals-Gleichung abgeschätzt werden, wobei man sie hier auch zur Definition der Reduzierten Größen nutzt.
Neben diesen Zustandsgleichungen werden häufig auch Gruppenbeitragsmethoden wie etwa die Lydersen-Methode und die Joback-Methode verwendet, mit denen die kritischen Größen aus der Molekülstruktur bestimmt werden.
Entdeckung
Mit der zunehmenden Verbreitung von Dampfmaschinen im 18. Jahrhundert rückte auch die Untersuchung des Siedeverhaltens verschiedener Stoffe in das Interesse der Wissenschaft. Es stellte sich heraus, dass mit steigendem Druck auch die Siedepunktstemperatur ansteigt. Man nahm an, dass die Koexistenz von Flüssigkeit und Gas bis zu beliebig hohen Drücken möglich sei.
Erste Versuche, diese Annahme zu widerlegen, wurden 1822 vom französischen Physiker Charles Cagniard de la Tour unternommen. Der kritische Punkt wurde daher zeitweise auch als Cagniard de la Tour’scher Punkt bezeichnet.[4] 1869 konnte der irische Physiker und Chemiker Thomas Andrews anhand von Untersuchungen mit CO2 zeigen, dass es einen Punkt gibt, ab dem der Unterschied zwischen Gas und Flüssigkeit nicht mehr existiert, und der sich durch eine bestimmte Temperatur, einen bestimmten Druck und eine bestimmte Dichte auszeichnet. Diesen Punkt nannte er den „kritischen Punkt“. Vier Jahre später gab der niederländische Physiker Johannes Diderik van der Waals eine plausible Erklärung (siehe oben) für das Verhalten von Stoffen im überkritischen Bereich und lieferte auch eine mathematische Beschreibung.[4]
Im Anschluss kam in der Wissenschaft die Frage auf, ob es einen kritischen Punkt nicht nur beim Übergang von Flüssigkeit zu Gas, sondern auch beim Übergang vom Feststoff zu Flüssigkeit gebe, oberhalb dessen eine Flüssigkeit nicht mehr von einem Feststoff zu unterscheiden sei. In den 1940er-Jahren stellte jedoch Percy Williams Bridgman bei Versuchen mit über 10.000 bar Druck, für die ihm 1946 der Nobelpreis für Physik verliehen wurde, fest, dass ein solcher Punkt nicht existiert.[4]
Anwendungen
Überkritische Fluide kombinieren das hohe Lösevermögen von Flüssigkeiten mit der niedrigen Viskosität ähnlich den Gasen. Weiterhin verschwinden sie bei Druckminderung vollständig (verdampfen). Somit eignen sie sich als ideale Lösungsmittel, welche als Nachteile lediglich den hohen Druck während des Prozesses aufweisen. Überkritische Fluide werden auch zum Erzeugen feinster Partikel eingesetzt. Extraktionen mit überkritischen Fluiden werden als Destraktionen bezeichnet.
In überkritischem Wasser kann SiO2 gelöst werden. Beim Auskristallisieren am Impfkristall werden Einkristalle aus Quarz gebildet. Diese werden dann in kleine Stücke gesägt und als Schwingquarze in Quarzuhren eingesetzt.
Überkritisches Wasser löst Fette aus Fleisch. Da sich vorher viele verschiedene Substanzen im Fett abgelagert haben, werden mit dieser Methode Medikamente und andere Substanzen aus dem Fleisch extrahiert und nachgewiesen.
Bei Textilfärbeanwendungen kann die gute Löslichkeit des Farbstoffes im überkritischen Zustand ausgenutzt werden, um den Farbstoff aufzunehmen und in die Faser zu übertragen. Nach Abschluss des Vorgangs wird die überkritische Flüssigkeit entspannt und der restliche Farbstoff fällt fest aus.
Eine Anwendung von überkritischem CO2 ist die Entkoffeinierung von Tee und Kaffee.
Mit überkritischem CO2 lassen sich biologische Präparate, z. B. für die Rasterelektronenmikroskopie, sehr schonend trocknen (Kritische-Punkt-Trocknung oder überkritische Trocknung). Dabei werden die Proben erst benetzt, das Wasser stufenweise gegen ein Lösemittel ausgetauscht (meist Aceton) und das Aceton mit überkritischem CO2 ausgetragen. Durch diese Vorgehensweise bleiben die Strukturen weitestgehend erhalten und es treten nur wenige Artefakte auf.
Überkritische Fluide, insbesondere Alkohole, werden zur Herstellung von Aerogel eingesetzt.
Tabellenwerte
Tabellenwerte zum kritischen Druck und kritischer Temperatur gasförmiger Stoffe sind im folgenden Artikel zu finden:
Einzelnachweise
- VDI-Gesellschaft Verfahrenstechnik und Chemieingenieurwesen (Hrsg.): VDI-Wärmeatlas. 11. Auflage. Springer-Verlag, Berlin Heidelberg 2013, ISBN 978-3-642-19980-6, Teil D.3 Thermophysikalische Stoffeigenschaften, D 3.1. Tabelle 1. Kritische und andere skalare Daten.
- Klaus Langeheinecke, André Kaufmann, Kay Langeheinecke, Gerd Thieleke: Thermodynamik für Ingenieure. 11. Auflage. Springer Fachmedien, Wiesbaden 2020, ISBN 978-3-658-30643-4, 3.3 Kritischer Punkt.
- Sven Horstmann: Theoretische und experimentelle Untersuchungen zum Hochdruckphasengleichgewichtsverhalten fluider Stoffgemische für die Erweiterung der PSRK-Gruppenbeitragszustandsgleichung, Doktorarbeit, Carl von Ossietzky Universität Oldenburg, 2000.
- Andreas Pfennig: Thermodynamik der Gemische. Springer Verlag, Berlin Heidelberg 2004, ISBN 3-540-02776-9, S. 7–8.