Alkane
Als Alkane (Grenzkohlenwasserstoffe, früher Paraffine) bezeichnet man in der organischen Chemie die Stoffgruppe der gesättigten, acyclischen Kohlenwasserstoffe. Das heißt, ihre Vertreter bestehen nur aus den beiden Elementen Kohlenstoff (C) und Wasserstoff (H), weisen nur Einfachbindungen und keine Kohlenstoffringe auf. Damit sind sie eine Untergruppe der aliphatischen Kohlenwasserstoffe. Für sie gilt die allgemeine Summenformel CnH2n+2 mit n = 1, 2, 3, …[1][2] Das Grundgerüst der Alkane kann ab n = 4 aus unverzweigten (linearen) oder aus verzweigten Kohlenstoffketten bestehen. Die unverzweigten Verbindungen werden als n-Alkane bezeichnet und bilden eine homologe Reihe der Alkane. Die verzweigten Alkane werden Isoalkane (i-Alkane) genannt.
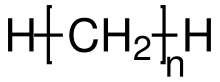
Gesättigte cyclische Kohlenwasserstoffe haben eine abweichende allgemeine Summenformel und bilden die Gruppe der Cycloalkane und werden dort beschrieben.
n-Alkane
Das einfachste Alkan ist das Methan. Die ersten zwölf n-Alkane sind in der folgenden Tabelle angegeben. Sie bilden die Homologe Reihe der Alkane.
| C | Name | Summenformel | Molare Masse | Schmelzpunkt | Siedepunkt | Dichte | Kugel-Stab-Modell |
|---|---|---|---|---|---|---|---|
| 1 | Methan | CH4 | 16,04 g·mol−1 | 90,65 K | 111,4 K | 0,72 kg/m3 gasförmig 0,42 g/cm3 flüssig |
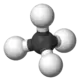 Kugel-Stab-Modell von Methan |
| 2 | Ethan | C2H6 | 30,07 g·mol−1 | 90 K | 185 K | 1,36 kg/m3 0,54 g/cm3 |
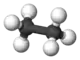 Kugel-Stab-Modell von Ethan |
| 3 | Propan | C3H8 | 44,10 g·mol−1 | 85 K | 231 K | 2,01 kg/m3 0,58 g/cm3 |
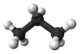 Kugel-Stab-Modell von Propan |
| 4 | n-Butan | C4H10 | 58,12 g·mol−1 | 135 K | 272,5 K | 2,71 kg/m3 0,60 g/cm3 |
Kugel-Stab-Modell von Butan |
| 5 | n-Pentan | C5H12 | 72,15 g·mol−1 | 144 K | 309 K | 0,626 g/cm3 | Kugel-Stab-Modell von Pentan |
| 6 | n-Hexan | C6H14 | 86,18 g·mol−1 | 178 K | 342 K | 0,659 g/cm3 | Kugel-Stab-Modell von Hexan |
| 7 | n-Heptan | C7H16 | 100,2 g·mol−1 | 182 K | 371 K | 0,684 g/cm3 | Kugel-Stab-Modell von Heptan |
| 8 | n-Octan | C8H18 | 114,2 g·mol−1 | 216 K | 399 K | 0,703 g/cm3 |  Kugel-Stab-Modell von Octan |
| 9 | n-Nonan | C9H20 | 128,3 g·mol−1 | 222 K | 424 K | 0,718 g/cm3 |  Kugel-Stab-Modell von Nonan |
| 10 | n-Decan | C10H22 | 142,3 g·mol−1 | 243 K | 447 K | 0,73 g/cm3 | Kugel-Stab-Modell von Decan |
| 11 | n-Undecan | C11H24 | 156,3 g·mol−1 | 248 K | 469 K | 0,74 g/cm3 | Kugel-Stab-Modell von Undecan |
| 12 | n-Dodecan | C12H26 | 170,3 g·mol−1 | 263 K | 489 K | 0,75 g/cm3 |  Kugel-Stab-Modell von Dodecan |
i-Alkane
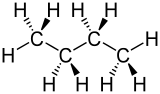 |
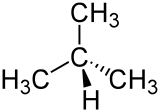 |
| n-Butan | iso-Butan (Methylpropan) |
Mit steigender Anzahl an Kohlenstoffatomen steigt auch die Anzahl der Möglichkeiten für deren kovalente Verknüpfung. Deswegen kommen alle Alkane mit einer höheren Zahl an Kohlenstoffatomen als Propan in einer Vielzahl von Konstitutionsisomeren – Molekülen mit der gleichen Summenformel, aber unterschiedlichem Aufbau (Konstitution) – vor. Diese werden als Isomere bezeichnet.
Beim Butan tritt der Fall ein, dass bei gleicher Summenformel C4H10 zwei unterschiedliche Anordnungsmöglichkeiten für die Kohlenstoffatome im Alkanmolekül möglich sind. Butan existiert also in zwei verschiedenen Konstitutionen: n-Butan und iso-Butan (isomeres Butan). Davon leitet sich der Begriff iso-Alkane – abgekürzt i-Alkane – ab.
Pentan tritt bereits in drei verschiedenen Konstitutionen auf, dem n-Pentan mit einer unverzweigten Kette, dem iso-Pentan mit einer Verzweigung am zweiten Kohlenstoffatom und dem neo-Pentan mit zwei Verzweigungen am zweiten Kohlenstoffatom.
Mit wachsender Anzahl der Kohlenstoffatome steigt rasch auch die Zahl der möglichen Isomere, von denen die meisten allerdings nur theoretisch bestehen – in Natur und Technik sind nur wenige von Bedeutung (siehe Anzahl der Isomere von Alkanen weiter unten). Icosan (ehemals Eicosan) mit einer Kette aus zwanzig Kohlenstoffatomen besitzt bereits 366.319 verschiedene Konstitutionsisomere. Bei Alkanen mit 167 Kohlenstoffatomen übersteigt die Anzahl der theoretisch möglichen Isomere die geschätzte Zahl der Teilchen im sichtbaren Universum.
Langkettige, verzweigte Alkane werden auch als Isoparaffine bezeichnet.
Stereochemie der Alkane
Verzweigte Alkane können chiral sein, d. h. bei gleicher Konstitution sind spiegelbildlich verschiedene Anordnungen möglich. Bei 3-Methylhexan tritt dies beispielsweise am Kohlenstoff in Position 3 auf. Dies ist in vielen Biomolekülen biologisch relevant. So ist die Seitenkette des Chlorophylls wie auch die des Tocopherols (Vitamin E) ein verzweigtes chirales Alkan. Chirale Alkane können durch enantioselektive Gaschromatographie in ihre Enantiomere getrennt werden.[3]
Nomenklatur
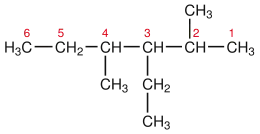
Die Nomenklatur der Alkane ist durch die International Union of Pure and Applied Chemistry (IUPAC) genau festgelegt.
Alle Stammnamen weisen die Endung -an auf. Dieser Endung wird ein griechisches Zahlenwort vorangestellt, das auf die Anzahl der Kohlenstoffatome hinweist. Für die ersten vier Alkane, hierbei handelt es sich um Trivialnamen, werden stattdessen historisch bedingt die Namen Methan, Ethan (vormals Äthan), Propan und Butan vergeben. Wie die Namen von Alkanen mit mehr als zehn Kohlenstoffatomen gebildet werden, findet sich im Artikel Nomenklatur.
Für verzweigte Alkane gelten die folgenden Benennungsregeln:
- Die Kohlenstoffatome der längsten durchgehenden Kohlenstoffkette werden so durchnummeriert, dass die tertiären bzw. quartären Kohlenstoffatome jeweils eine möglichst niedrige Zahl erhalten. Dies ist der Fall, wenn die Summe aller dieser Zahlen am niedrigsten ist (Beispielmolekül oben: 2 + 3 + 4 = 9). Entsprechend dieser längsten Kette erhält das Molekül seinen Stammnamen (Beispielmolekül oben: 6 Kohlenstoffatome → Hexan).
- Die Namen der abzweigenden Alkylgruppen (Seitenketten) werden ebenfalls durch ihre Länge bestimmt und alphabetisch aufsteigend sortiert dem Stammnamen des Alkans vorangestellt (s. u. 4. Zusatzregel a).
- Diesen Alkylgruppennamen werden die Nummern, durch Bindestriche von diesen getrennt, der Kohlenstoffatome, an denen sie abzweigen, vorangestellt (s. u. 5. Zusatzregel b).
- Zusatzregel a) Zweigt mehr als eine Alkylgruppe mit gleichem Namen von der Hauptkette ab, werden diesen Alkylgruppennamen deren Anzahl in der griechischen Schreibweise (di = zwei, tri = drei usw.) als Zahlwort vorangestellt. Zu beachten ist dabei, dass diese Zahlenwörter bei der alphabetischen Sortierung nicht berücksichtigt werden.
- Zusatzregel b) Gibt es mehrere abzweigende Alkylgruppen mit gleichem Namen, werden die Zahlen mit aufsteigendem Wert durch Kommata getrennt notiert. Zweigen zwei gleiche Alkylgruppen an einem quartären Kohlenstoffatom ab, dann wird die Nummer des Kohlenstoffatoms doppelt notiert.
Ein Beispiel für die Zusatzregeln a) und b) ist das 3-Ethyl-2,2,4-trimethylhexan: Am oben abgebildeten 3-Ethyl-2,4-dimethylhexan wäre am zweiten Kohlenstoffatom das Wasserstoffatom durch eine Methylgruppe ersetzt. Anmerkung: Die beiden genannten Verbindungen haben mehrere je zwei Chiralitätszentren, so dass diese Nomenklatur unvollständig ist.
Früher wurden Alkane als „Grenzkohlenwasserstoffe“ oder Paraffine bezeichnet. Letzteres leitet sich von lateinisch parum affinis ab, was sich mit „wenig verwandt“ übersetzen lässt – man glaubte früher, dass Stoffe, die miteinander reagieren, irgendeine Art von „Verwandtschaft“ aufweisen müssten – und brachte damit die relative Reaktionsträgheit dieser Verbindungen zum Ausdruck. Heute bezeichnet der Name meist nur noch ein Stoffgemisch aus bestimmten festen Alkanen.
Alkylrest
Wird einem Alkanmolekül ein Wasserstoffatom entzogen, entsteht ein Radikal, ein Molekül mit einem ungebundenen Elektron, das man als Alkylradikal bezeichnet. Den Namen dieses Alkylrestes erhält man, wenn man bei der Endung des Alkans, dem das Wasserstoffatom entzogen wurde, das -an durch ein -yl ersetzt. Symbolisch werden Alkyle häufig mit R notiert; sind die Alkylreste unterschiedlich, wird dieses durch R1, R2, R3 usw. kenntlich gemacht.
Molekülgeometrie
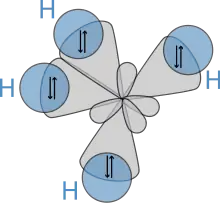 sp³-Hybridisierung bei Methan.
sp³-Hybridisierung bei Methan.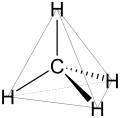 Tetraederstruktur des Methans.
Tetraederstruktur des Methans.
Die räumliche Struktur der Alkane wirkt sich direkt auf ihre physikalischen und chemischen Eigenschaften aus. Entscheidend für ihr Verständnis ist die Elektronenkonfiguration des Kohlenstoffs. Dessen Atome weisen im Grundzustand vier freie Elektronen, die so genannten Valenzelektronen auf, die für Bindungen und Reaktionen zur Verfügung stehen. Im ungebundenen Kohlenstoffatom befinden sich diese vier Elektronen in Orbitalen unterschiedlicher Energie, in Alkanen dagegen ist das Kohlenstoffatom immer sp³-hybridisiert, das bedeutet, dass durch Überlagerung der vier Ausgangsorbitale (ein s-Orbital und drei p-Orbitale) vier neue Orbitale gleicher Energie vorhanden sind. Diese sind räumlich in der Form eines Tetraeders angeordnet, der Winkel zwischen ihnen beträgt daher 109,47 Grad.
Bindungslängen und Bindungswinkel
 Bindungslängen und -winkel des Methanmoleküls
Bindungslängen und -winkel des Methanmoleküls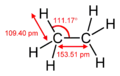 Bindungslängen und -winkel des Ethanmoleküls
Bindungslängen und -winkel des Ethanmoleküls
Ein Alkanmolekül weist nur C-H- und C-C-Bindungen (Kohlenstoffeinfachbindungen) auf. Erstere entstehen durch Überlappung eines sp³-Hybridorbitals des Kohlenstoffs mit dem 1s-Orbital des Wasserstoffs, Letztere durch Überlappung zweier sp³-Hybridorbitale unterschiedlicher Kohlenstoffatome.
Die Bindungslänge beträgt 109 Pikometer für die C-H-Bindung und 154 Pikometer für die C-C-Bindung, der Abstand zweier Kohlenstoffatome ist also etwa 50 Prozent größer als der Abstand zwischen einem Kohlenstoff- und einem Wasserstoffatom, was in erster Linie mit den unterschiedlichen Atomradien zusammenhängt.
Die räumliche Anordnung der Bindungen folgt aus der Ausrichtung der vier sp³-Orbitale – da diese tetraedrisch angeordnet sind, sind dies auch die C-C- und C-H-Bindungen, auch zwischen ihnen liegt also jeweils ein fester Winkel von 109,47 Grad. Die Strukturformel, die die Bindungen der Moleküle vollkommen geradlinig dargestellt, entspricht also in dieser Hinsicht nicht der Realität.
Konformation der Alkane
Die Kenntnis der Strukturformel und der Bindungswinkel legt in der Regel noch nicht vollständig den räumlichen Aufbau eines Moleküls fest. So besteht für jede Kohlenstoff-Kohlenstoff-Bindung ein weiterer Freiheitsgrad: der Winkel, den die an die beiden Bindungsatome gebundenen jeweils drei Atome beziehungsweise Atomgruppen zueinander einnehmen. Die durch diese Winkel beschriebene räumliche Anordnung bezeichnet man als Konformation des jeweiligen Moleküls.
Ethan
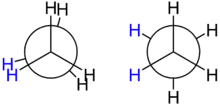
Den einfachsten Fall bildet innerhalb der Stoffklasse der Alkane das Ethan; hier existiert genau eine C-C-Bindung. Blickt man entlang der dadurch definierten Achse auf das Molekül, so ergibt sich die so genannte Newman-Projektion: Ein Kohlenstoffatom ist in der Projektion mit seinen drei Wasserstoffatomen im Vordergrund zu sehen, das andere wird symbolisch durch einen Kreis abgedeckt und befindet sich definitionsgemäß im Hintergrund; die Bindungen zu seinen drei Wasserstoffatomen sind im Diagramm entsprechend nur teilweise zu sehen. Sowohl die vorderen als auch die hinteren drei Wasserstoffatome nehmen in der Projektion 120-Grad-Winkel zueinander ein, wie dies für die Projektion eines Tetraeders in die Ebene auch gelten muss. Nicht festgelegt ist jedoch der Winkel θ zwischen den beiden Gruppen von Wasserstoffatomen – er beschreibt im Ethanmolekül die Konformation.
Der Konformationswinkel kann beliebige Werte zwischen 0 und 360 Grad annehmen, qualitativ sind jedoch nur zwei verschiedene Konformationen interessant:
- In der ekliptischen Konformation beträgt der Konformationswinkel 0, 120 oder 240 Grad, in der Projektion fallen je ein vorderes und ein hinteres Wasserstoffatom zusammen.
- In der gestaffelten Konformation beträgt der Konformationswinkel 60, 180 oder 300 Grad, so dass in der Projektion jeweils ein hinteres Wasserstoffatom zwischen zwei vorderen zu liegen kommt.
Die beiden Konformationen, auch Rotamere genannt, unterscheiden sich in ihrer Energie, die in diesem Fall als Torsionsenergie bezeichnet wird, um etwa 12,6 Kilojoule pro Mol. Während die ekliptische Konformation diese maximiert und daher instabil ist, wird sie von der gestaffelten Konformation minimiert, diese ist folglich energetisch bevorzugt. Alle anderen Konformationen liegen bezüglich ihrer Energie zwischen diesen beiden Extremen. Die Ursache für die Differenz ist noch nicht vollständig aufgeklärt: Bei der ekliptischen Konformation ist der Abstand zwischen den C-H-Bindungselektronen des vorderen und hinteren Kohlenstoffatoms geringer, die elektrostatische Abstoßung zwischen ihnen und damit die Energie des Zustandes folglich höher. Umgekehrt erlaubt die gestaffelte Konformation eine stärkere Delokalisation der Bindungselektronen, ein quantenmechanisches Phänomen, das die Struktur stabilisiert und die Energie herabsetzt. Heute gilt der Letztere Erklärungsansatz als wahrscheinlicher.
Die Torsionsenergie des Ethanmoleküls ist bei Raumtemperatur klein gegenüber der thermischen Energie, so dass es sich dann in konstanter Rotation um die C-C-Achse befindet. Allerdings „rastet“ es in regelmäßigen Abständen in der gestaffelten Konformation „ein“, so dass sich zu jedem Zeitpunkt etwa 99 Prozent aller Moleküle nahe dem Energieminimum befinden. Der Übergang zwischen zwei benachbarten gestaffelten Konformationen dauert aber nur durchschnittlich 10−11Sekunden.
Höhere Alkane
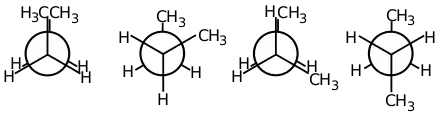
Während für die beiden C-C-Bindungen des Propanmoleküls qualitativ dasselbe gilt wie für Ethan, ist die Situation für Butan und alle höheren Alkane komplexer.
Betrachtet man die mittlere C-C-Bindung des Butanmoleküls, so ist jedes der beiden Kohlenstoffatome an jeweils zwei Wasserstoffatome und eine Methylgruppe gebunden. Wie an der Newman-Projektion erkennbar ist, lassen sich vier qualitativ unterschiedliche Rotamere unterscheiden, zwischen denen wiederum beliebige Übergangszustände möglich sind. Sie entsprechen wie schon beim Ethan Konformationen maximaler beziehungsweise minimaler Energie:
- Liegen in der Projektion die beiden Methylgruppen an derselben Stelle, also bei einem Torsionswinkel von 0 Grad, spricht man von der voll-ekliptischen oder synperiplanaren Konformation. Sie entspricht einem globalen Maximum der Torsionsenergie, da sich die Wasserstoffatome der Methylgruppen so nahe kommen, dass es zur Abstoßung zwischen ihren Elektronenwolken kommt.
- Bei einem Torsionswinkel von 60 oder 300 Grad nennt man die Konformation schiefgestaffelt oder synklinar; anders als bei den ekliptischen Strukturen kommen hier alle Atome beziehungsweise Atomgruppen des vorderen Kohlenstoffatoms in der Projektion zwischen denen des hinteren zu liegen. Dadurch ergibt sich ein Minimum der Energie; aufgrund der Nähe der beiden Methylgruppen zueinander ist es allerdings nur lokal, es existiert also noch eine energetisch günstigere Konformation.
- Beträgt der Torsionswinkel 120 oder 240 Grad, so ist die Konformation partiell-ekliptisch. Sie ist aus den gleichen Gründen wie beim Ethan energetisch ungünstig. Anders als in der voll-ekliptischen Konformation kommen sich die beiden Methylgruppen jedoch nicht zu nahe, so dass die Energie nur lokal ein Maximum darstellt.
- Bei einem Torsionswinkel von 180 Grad schließlich liegt eine antiperiplanare Konformation vor. Wie bei der gestaffelten Konformation des Ethan tritt hier eine nur quantenmechanisch erklärbare verstärkte Delokalisation der Elektronen auf, zugleich nehmen die beiden Methylgruppen den größtmöglichen räumlichen Abstand zueinander ein. Die Torsionsenergie wird daher für diesen Zustand global minimiert.
Der Energieabstand zwischen syn- und antiperiplanarer Konformation beträgt etwa 19 Kilojoule pro Mol und ist damit bei Raumtemperatur immer noch klein gegenüber der thermischen Energie. Daher sind Drehungen um die mittlere C-C-Achse immer noch leicht möglich. Wie beim Ethan ist jedoch die Wahrscheinlichkeit dafür, ein Molekül in einem bestimmten Zustand zu finden, nicht gleich groß; für die antiperiplanare Konformation ist sie etwa doppelt so hoch wie für die synklinale, während sie für die beiden ekliptischen Konformationen vernachlässigbar gering ist.
Bei den höheren Alkanen ergibt sich grundsätzlich dasselbe Bild – für alle C-C-Bindungen ist immer die antiperiplanare Konformation, bei der die angebundenen Alkylgruppen den größtmöglichen Abstand einnehmen, die energetisch günstigste und daher die am wahrscheinlichsten anzutreffende. Aus diesem Grund wird die Struktur der Alkane meist durch eine Zickzackanordnung wiedergegeben; dies ist auch in den weiter oben zu sehenden Molekülmodellen der Fall. Die tatsächliche Struktur wird sich bei Raumtemperatur immer etwas von dieser idealisierten Konformation unterscheiden – Alkanmoleküle haben also keine feste Stäbchenform, wie das Modell suggerieren könnte.
Andere Kohlenwasserstoffmoleküle wie zum Beispiel die Alkene bauen auf dieser Grundstruktur auf, enthalten durch Doppelbindungen aber auch versteifte Abschnitte, die zu permanenten „Verbiegungen“ führen können.
Die Ketten der höheren Alkane haben grundsätzlich eine gestreckte Konformation. Ab 18 bis 19 Kettengliedern lassen sich bei tiefen Temperaturen auch gefaltete Haarnadelstrukturen nachweisen. Zur Bildung von Haarnadelstrukturen müssen die Kohlenwasserstoffketten zunächst erhitzt und anschließend mithilfe eines Trägergases extrem schnell auf minus 150 °C abgekühlt werden.[4]
Anzahl der Isomere von Alkanen
Zur Bestimmung der Anzahl von Isomeren der Alkane gibt es keine einfache Formel; man muss mit einem Algorithmus und einer Baumstruktur arbeiten.[5][6][7]
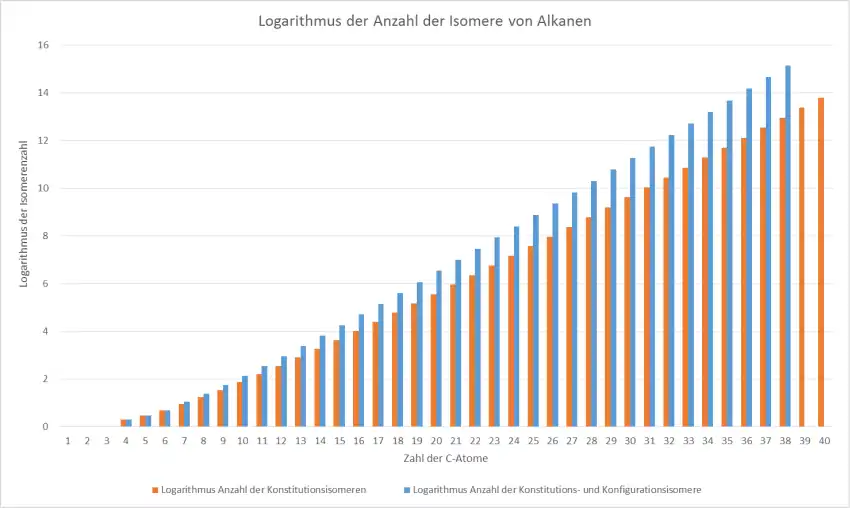
| Anzahl der C-Atome | Anzahl der Konstitutionsisomeren | Anzahl der Konstitutions- und
Konfigurationsisomere |
|---|---|---|
| 1 | 1 | 1 |
| 2 | 1 | 1 |
| 3 | 1 | 1 |
| 4 | 2 | 2 |
| 5 | 3 | 3 |
| 6 | 5 | 5 |
| 7 | 9 | 11 |
| 8 | 18 | 24 |
| 9 | 35 | 55 |
| 10 | 75 | 136 |
| 11 | 159 | 345 |
| 12 | 355 | 900 |
| 13 | 802 | 2.412 |
| 14 | 1.858 | 6.563 |
| 15 | 4.347 | 18.127 |
| 16 | 10.359 | 5.0699 |
| 17 | 24.894 | 143.255 |
| 18 | 60.523 | 408.429 |
| 19 | 148.284 | 1.173.770 |
| 20 | 366.319 | 3.396.844 |
| 21 | 910.726 | 9.892.302 |
| 22 | 2.278.658 | 28.972.080 |
| 23 | 5.731.580 | 85.289.390 |
| 24 | 14.490.245 | 252.260.276 |
| 25 | 36.797.588 | 749.329.719 |
| 26 | 93.839.412 | 2.234.695.030 |
| 27 | 240.215.803 | 6.688.893.605 |
| 28 | 617.105.614 | 20.089.296.554 |
| 29 | 1.590.507.121 | 60.526.543.480 |
| 30 | 4.111.846.763 | 182.896.187.256 |
| 31 | 10.660.307.791 | 554.188.210.352 |
| 32 | 27.711.253.769 | 1.683.557.607.211 |
| 33 | 72.214.088.660 | 5.126.819.371.356 |
| 34 | 188.626.236.139 | 15.647.855.317.080 |
| 35 | 493.782.952.902 | 47.862.049.187.447 |
| 36 | 1.295.297.588.128 | 146.691.564.302.648 |
| 37 | 3.404.490.780.161 | 450.451.875.783.866 |
| 38 | 8.964.747.474.595 | 1.385.724.615.285.949 |
| 39 | 23.647.478.933.969 | |
| 40 | 62.481.801.147.341 |
Bei diesen Zahlen handelt es sich um die theoretisch möglichen Isomere. Viele davon sind aber aus sterischen Gründen nicht existenzfähig. In dieser Liste[8] ist die Anzahl der Konstitutionsisomere bis 100 C-Atome aufgeführt.
Eigenschaften
Alkane bilden eine besonders einheitliche Stoffklasse, die Kenntnis der Eigenschaften weniger Vertreter genügt, um das Verhalten der übrigen vorherzusagen. Dies gilt sowohl für die intra- beziehungsweise intermolekularen Wechselwirkungen der Alkane, die sich auf die Schmelz- und Siedepunkte auswirken, als auch für die Betrachtung ihrer Synthesen und Reaktionen.
Physikalische Eigenschaften
Die Molekülstruktur, speziell die Größe der Oberfläche der Moleküle, bestimmt den Siedepunkt des zugehörigen Stoffes: je kleiner die Fläche, umso niedriger ist der Siedepunkt, da so die zwischen den Molekülen wirkenden Van-der-Waals-Kräfte kleiner sind; eine Verkleinerung der Oberfläche kann dabei durch Verzweigungen oder durch eine ringförmige Struktur erreicht werden. Das bedeutet in der Praxis, dass Alkane mit höherem Kohlenstoffanteil in der Regel einen höheren Siedepunkt als Alkane mit geringerem Kohlenstoffanteil haben; unverzweigte Alkane haben höhere Siedepunkte als verzweigte und ringförmige wiederum höhere Siedepunkte als die unverzweigten. Ab fünf Kohlenstoffatomen sind unverzweigte Alkane unter Normalbedingungen flüssig, ab siebzehn fest. Der Siedepunkt nimmt pro CH2-Gruppe um zwischen 20 und 30 °C zu.
Auch der Schmelzpunkt der Alkane steigt mit zwei Ausnahmen bei Ethan und Propan bei Zunahme der Anzahl der Kohlenstoffatome; allerdings steigen die Schmelzpunkte insbesondere bei den höheren Alkanen langsamer als die Siedepunkte.[9] Außerdem steigt der Schmelzpunkt von Alkanen mit ungerader Kohlenstoffzahl zu Alkanen mit gerader Kohlenstoffzahl stärker als umgekehrt. Die Ursache dieses Phänomens ist die größere Packungsdichte der Alkane mit geradzahliger Kohlenstoffzahl. Der Schmelzpunkt der verzweigten Alkane kann sowohl ober- als auch unterhalb des entsprechenden Wertes für die unverzweigten Alkane liegen. Je sperriger das Molekül ist, desto schwieriger lässt sich die entsprechende Substanz eng packen und desto niedriger liegt folglich auch der Schmelzpunkt. Umgekehrt existiert eine Reihe von Isoalkanen, die eine wesentlich kompaktere Struktur einnehmen als die korrespondierenden n-Alkane; in diesem Fall liegen ihre Schmelzpunkte daher über denjenigen ihrer geradlinigen Isomere.
Alkane leiten weder den elektrischen Strom noch sind sie dauerhaft elektrisch polarisiert. Aus diesem Grund bilden sie keine Wasserstoffbrückenbindungen aus und lassen sich in polaren Lösungsmitteln wie Wasser sehr schlecht lösen. Da die Wasserstoffbrückenbindungen zwischen den einzelnen Wassermolekülen in der unmittelbaren Nähe eines Alkans von diesem wegweisen und daher nicht isotrop ausgerichtet sind, also nicht gleichmäßig in alle Richtungen zeigen, wäre eine Mischung beider Substanzen mit einer Zunahme der molekularen Ordnung verbunden. Da dies nach dem Zweiten Hauptsatz der Thermodynamik verboten ist, bilden sich bei dem Versuch einer Mischung immer zwei separate Schichten. Man bezeichnet Alkane daher als wasserabweisend oder hydrophob. Ihre Löslichkeit in unpolaren Lösungsmitteln ist dagegen gut, ein Umstand, der als lipophil bezeichnet wird. Untereinander sind sie beispielsweise bei gleichem Aggregatzustand in jedem Verhältnis mischbar.
Bis auf einige Ausnahmen nimmt die Dichte der Alkane mit zunehmender Zahl der Kohlenstoffatome zu. Da sie bei allen flüssigen Alkanen geringer ist als diejenige des Wassers, schwimmen Alkane bei versuchter Mischung immer oben, weshalb brennende, flüssige Alkane nicht mit Wasser gelöscht werden können.
Chemische Eigenschaften
Generell zeigen Alkane eine relativ geringe Reaktivität, weil ihre C-H- und C-C-Bindungen relativ stabil sind und nicht einfach zerbrochen werden können. Anders als die meisten anderen organischen Verbindungen besitzen sie auch keine funktionellen Gruppen.
Mit ionischen oder allgemeiner polaren Substanzen reagieren sie nur sehr schlecht. Ihr pKs-Wert liegt oberhalb von 60 (Methan 48), mit normalen Säuren oder Basen reagieren sie daher praktisch gar nicht, worauf auch der Trivialname Paraffin hinweist (lat.: parum affinis = wenig geneigt). Im Erdöl sind die Alkanmoleküle sogar seit Millionen von Jahren chemisch unverändert geblieben.
Allerdings gehen Alkane Redoxreaktionen, insbesondere mit Sauerstoff und den Halogenen ein, da sich ihre Kohlenstoffatome in stark reduziertem Zustand befinden; im Falle des Methans wird sogar die niedrigstmögliche Oxidationsstufe −IV erreicht. Im ersten Fall handelt es sich um Verbrennungen, im zweiten um Substitutionsreaktionen.
Radikale, also Moleküle mit ungepaarten Elektronen, spielen bei den meisten Reaktionen eine große Rolle, so auch beim so genannten Cracken und bei der Reformierung, bei denen langkettige Alkane in kurzkettige und unverzweigte in verzweigte umgewandelt werden.
Bei stark verzweigten Molekülen tritt eine Abweichung vom optimalen Bindungswinkel auf, die dadurch hervorgerufen wird, dass sich Alkylgruppen, die an unterschiedlichen Kohlenstoffatomen sitzen, räumlich sonst zu nahe kommen würden. Durch die dadurch hervorgerufene „Spannung“, die man als sterische Spannung bezeichnet, sind diese Moleküle wesentlich reaktiver.
Reaktionen
Reaktionen mit Sauerstoff
Alle Alkane reagieren mit Sauerstoff, sind also brennbar, aber nicht brandfördernd; ihr Flammpunkt steigt allerdings mit zunehmender Zahl der Kohlenstoffatome. Im Vergleich zu anderen Kohlenwasserstoffen wie Alkenen und Alkinen reagieren sie unter Freisetzung der meisten Energie. Zwar setzt eine Doppel- oder Dreifachbindung mehr Energie frei als eine Einfachbindung, allerdings wird dies durch die höhere Zahl an oxidierbaren Wasserstoffatomen im Molekül (6 bei Ethan, 4 bei Ethen und 2 bei Ethin) überkompensiert. Die Standardverbrennungsenthalpien liegen in etwa bei folgenden Werten:[10]
Somit wird bei der Verbrennung des Ethans die meiste Energie freigesetzt (negative Enthalpie). Alkane verbrennen bei ausreichender Sauerstoffzufuhr mit schwach leuchtender, nicht rußender Flamme.
Chemisch ist die Reaktion mit Sauerstoff eine Redoxreaktion, bei der die Alkane oxidiert und der Sauerstoff reduziert werden. Bei vollständiger Verbrennung reagiert der Kohlenstoff zu Kohlenstoffdioxid (Oxidationszahl +IV) und der Wasserstoff zu Wasser, das in Form von Wasserdampf freigesetzt wird:
Die totale Verbrennungsenergie steigt vergleichsweise regelmäßig mit zunehmender Anzahl der Kohlenstoffatome; jede CH2-Gruppe steuert etwa 650 Kilojoule pro Mol bei. Aus der Tatsache, dass die Verbrennungsenergie verzweigter Alkane etwas niedriger ist als die unverzweigter, lässt sich auf eine höhere Stabilität ersterer Gruppe schließen.
Werden Alkane nicht vollständig verbrannt, weil zu wenig Sauerstoff vorhanden ist, entstehen unerwünschte Nebenprodukte wie Alkene, Kohlenstoff und Kohlenstoffmonoxid und die Energieausbeute ist geringer; eine vollständige Verbrennung der Alkane ist daher wichtig. Ein Beispiel für eine unvollständige Verbrennung ist die folgende Reaktion
Schwarzer Rauch deutet bei der Benzinverbrennung daher auf ungenügende Sauerstoffzufuhr hin.
Reaktionen mit den Halogenen
Eine weitere wichtige Reaktionsgruppe der Alkane sind Halogenierungsreaktionen – auch sie zählen zu der größeren Gruppe der Redoxreaktionen, da sich die Oxidationszahlen der betroffenen Kohlenstoffatome ändern.
Bei der Halogenierung werden die Wasserstoffatome eines Alkans teilweise oder vollständig durch Halogenatome wie Fluor, Chlor oder Brom ersetzt beziehungsweise substituiert, daher spricht man auch von einer Substitutionsreaktion. Bei der Reaktion entstehen sogenannte Halogenalkane, meist in Mischung, wie aus dem folgenden Beispiel für Methan hervorgeht:
Das Mischungsverhältnis der einzelnen Halogenalkane hängt von den Reaktionsbedingungen und dem Reaktionsverlauf ab und ist in der Reaktionsgleichung vollkommen willkürlich gewählt, also nicht repräsentativ.
Die Reaktion mit Chlor wird schon bei geringer Energiezufuhr in Form von ultraviolettem Licht ausgelöst – der hohe Ertrag der Reaktion pro Energieeinheit weist darauf hin, dass es sich um eine Kettenreaktion handelt. Bei dieser wird, wenn erst einmal ein Halogenradikal vorhanden ist, durch den Reaktionsverlauf beständig ein neues nachgebildet, jedenfalls so lange, bis der Überschuss an Halogenatomen abgebaut ist. Es handelt sich hier also um eine radikalische Substitution.
Wie bei jeder Kettenreaktion existieren bei den Halogenierungsreaktionen drei Schritte:
- Initiierung: Die zweiatomigen Halogenmoleküle werden zum Beispiel durch energiereiche Lichteinstrahlung homolytisch, also bei symmetrischer Aufteilung der Elektronen, in Radikale aufgespalten:
- Propagierung Schritt 1: Ein Halogenradikal löst ein Wasserstoffatom aus einem Alkanmolekül heraus und lässt ein Alkylradikal zurück:
- Propagierung Schritt 2: Ein Alkylradikal löst aus einem Halogenmolekül ein Halogenatom heraus und lässt ein Halogenradikal zurück:
- Schritt 1 und Schritt 2 wechseln sich bei der Reaktion kontinuierlich ab – es entsteht aus wenigen anfänglichen Chlorradikalen eine immer größere Zahl an Reaktionsprodukten.
- Terminierung: Die Reaktion stoppt, wenn die Wahrscheinlichkeit zweier Radikale, aufeinanderzutreffen, größer wird als diejenige, auf ein Ausgangsprodukt (oder ein noch nicht vollständig halogenisiertes Alkan) zu treffen. Es kommt in diesem Fall zur Rekombination:
- Obwohl auch die letzte dieser Terminierungsreaktionen zu Halogenalkanen führt, ist die Zahl der so erzeugten Produkte vernachlässigbar gegenüber der Zahl der bei der Kettenreaktion entstandenen.
In der vorstehenden Betrachtung wurde keine Aussage dazu gemacht, welche Wasserstoffatome im Falle eines gegebenen Alkans zuerst ersetzt werden. Für die wichtigsten Fälle des Methans oder Ethans stellt sich diese Frage nicht, da alle Wasserstoffatome äquivalent sind. Ab dem Propan sind jedoch manche von ihnen an sekundäre oder tertiäre Kohlenstoffatome gebunden, also solche mit zwei beziehungsweise drei Bindungen zu anderen Kohlenstoffatomen. Diese Bindungen sind schwächer, was sich bei Halogenierungen dadurch auswirkt, dass bevorzugt die an einem sekundären beziehungsweise gar tertiären Kohlenstoff sitzenden Wasserstoffatome durch Halogene ersetzt werden.
Beispiel: 2-Chlorpropan CH3–CHCl–CH3 tritt im Vergleich zum 1-Chlorpropan CH2Cl–CH2–CH3 als Reaktionsprodukt häufiger auf, als dies statistisch zu erwarten wäre.
Die Reaktionsraten sind für die vier Halogene extrem unterschiedlich. Bei 27 °C beträgt das Verhältnis
F : Cl : Br : I = 140.000 : 1300 : 9 · 10−8 : 2 · 10−19.
Daraus lässt sich der unterschiedliche Verlauf der Reaktionen schon ablesen: Mit Fluor reagieren die Alkane kaum kontrollierbar, mit Chlor moderat, mit Brom schwach und nur unter Lichteinwirkung, mit Iod dagegen praktisch gar nicht.
Die Iodierung ist sogar energetisch ungünstig, daher wird Iod bei Halogenisierungsreaktionen als Radikalfänger verwendet, um die Kettenreaktionen abzubrechen. Durch Anhalten der Substitutionsreaktion lässt sich diese teilweise steuern, um die Ausbeute eines bestimmten Reaktionsproduktes zu erhöhen.
Technisch von Bedeutung sind vor allem chlorierte und fluorierte Methangase, die Reaktion zu ihnen kann allerdings zur Explosion führen. Trichlormethan wurde früher unter dem Namen Chloroform als Narkosemittel eingesetzt, Fluor-Chlor-Kohlenwasserstoffe dienten lange Zeit als Treibmittel, bis sie durch ihre schädlichen Einwirkungen auf die Ozonschicht der Erde an Bedeutung verloren.
Chemisch nachweisbar sind Halogenalkane mit Hilfe der Beilsteinprobe.
Cracken und Reformierung
Wichtige Reaktionen bei der Aufbereitung von Rohöl sind das Cracken und die Reformierung.
Bei Ersterem werden aus höheren Alkanen unter hohem Druck und bei hoher Temperatur die wesentlich begehrteren niederen Alkane gewonnen. An Katalysatoren wie Aluminiumoxid kommt es zur Aufspaltung von C-C-Bindungen. Beispiel
Durch Rekombination setzen sich diese wieder zu neuen Alkanen zusammen. Beispiel:
Durch geeignete Reaktionsbedingungen lässt sich sicherstellen, dass als Folge dieser Reaktionen in erster Linie kurze Alkanmoleküle entstehen. Auf demselben Wege lassen sich auch störende Nebenreaktionen wie die Bildung von Alkenen weitgehend unterbinden. Meist wird beim Cracking noch Wasserstoff zugesetzt, um Verunreinigungen wie Schwefel oder Stickstoff zu entfernen – man spricht dann entsprechend vom Hydrocracking.
Die Reformierung ist dagegen bei Alkangemischen notwendig, die als Benzin Einsatz finden sollen. Dazu werden unverzweigte Alkane, die für diesen Zweck ungünstige Verbrennungseigenschaften haben, an Katalysatoren in verzweigte Alkane und Arene, also aromatische Kohlenwasserstoffe, umgewandelt.
Weitere Reaktionen
Mithilfe von Nickel-Katalysatoren kann aus den Alkanen bei einer Reaktion mit Wasserdampf Wasserstoff gewonnen werden. Weitere Reaktionen der Alkane sind die Sulfochlorierung und die Nitrierung, eine Reaktion mit Salpetersäure, die aber beide besondere Bedingungen erfordern. Technisch weitaus bedeutender ist die Fermentation zu Alkansäuren.
Gefahren
Methan kann ab einem Luftvolumenanteil von einem bis acht Prozent ohne Zündquelle explodieren[Quelle?] und ist ein starkes Treibhausgas, auch einige weitere Gemische der niederen Alkane und Luft sind ab einem bestimmten Alkananteil selbstentzündlich. Alkane können aufgrund ihrer Brennbarkeit eine Gefahr darstellen; mit zunehmenden Kohlenstoffanteilen steigt allerdings auch der Flammpunkt. Propan, Butan, Pentan, Hexan, Heptan und Oktan und einige weitere Alkane sind Gefahrstoffe, ihr MAK-Wert ist aber relativ hoch angesetzt, für Pentan beträgt er 3000 mg/m³,[11] für Hexan nur 180 mg/m³.[12] Pentan, Hexan, Heptan und Octan sind darüber hinaus umweltgefährlich und höhere Alkane sind meist nur noch reizend eingestuft oder gar keine Gefahrstoffe mehr.
Darstellung
Die Alkane mit wenigen Kohlenstoffatomen können aus den Elementen selbst hergestellt werden; höhere Alkane müssen nach dem Bergius-Verfahren unter hohem Druck produziert werden. Einige der Reaktionen haben einen eigenen Namen erhalten.
Die Darstellung von Alkanen kann auf mehrere Weisen erfolgen:
- über katalytische Hydrierung von Alkenen, etwa gemäß
- Darstellung aus Halogenalkanen mit Hilfe von Wasserstoff. Beispiel:
- über die Kolbe-Elektrolyse; hierbei werden Alkancarboxylate zum Radikal reduziert, das unter Kohlendioxidabgabe in Alkylreste zerfällt, diese dimerisieren zu Alkanen.
- über die Wurtzsche Synthese, hierbei entstehen Alkane unter Bildung von Metallhalogeniden aus Halogenalkanen und Metallorganylen. Allgemeine Reaktionsgleichung:
- über das Bergius-Verfahren, die Herstellung der Alkane erfolgt unter hohem Druck aus Kohle und Wasserstoff.
- über das Fischer-Tropsch-Verfahren, die Herstellung von flüssigen Alkanen erfolgt aus Kohlenmonoxid und Wasserstoff. Beispiel:
Im Jahre 1985 wurde eines der längsten jemals synthetisierten Alkane dargestellt; es besteht aus Molekülen mit einer Kettenlänge von genau 390 Kohlenstoffatomen (C390H782).
Vorkommen

Alkane kommen sowohl auf der Erde als auch im Sonnensystem vor, allerdings nur etwa die ersten 100, die meisten davon lediglich in Spuren. Von großer Bedeutung auf anderen Himmelskörpern sind in erster Linie die leichten Kohlenwasserstoffe: So konnten die beiden Gase Methan und Ethan sowohl im Schweif des Kometen Hyakutake als auch in einigen Meteoriten, den so genannten kohligen Chondriten nachgewiesen werden. Sie bilden zudem einen wichtigen Anteil der Atmosphären der äußeren Gasplaneten Jupiter, Saturn, Uranus und Neptun. Auf dem Saturnmond Titan wurden sogar lange Zeit ganze Ozeane aus diesen und langkettigeren Alkanen vermutet, heute geht man allerdings davon aus, dass allenfalls kleinere Seen aus Ethan existieren. Auf dem Mars wurden Methanspuren in der Atmosphäre entdeckt, was den bisher stärksten Hinweis auf Lebewesen (Bodenbakterien) auf jenem Planeten darstellt.
Auf der Erde kommt Methan in Spuren in der Atmosphäre vor, der Gehalt beträgt etwa 0,0001 Prozent oder 1 ppm („parts per million“) und wird in erster Linie von den bakterienartigen Archaeen erzeugt. Der Gehalt in den Ozeanen ist aufgrund der fehlenden Löslichkeit in Wasser vernachlässigbar, Methan findet sich allerdings unter hohem Druck und bei niedriger Temperatur in Wassereis eingefroren am Grunde der Meere als so genanntes Methanhydrat. Obwohl es bis heute nicht kommerziell abgebaut werden kann, übersteigt der Brennwert der bekannten Methanhydratfelder den Energiegehalt aller Erdgas- und Erdölvorkommen zusammengerechnet um ein Mehrfaches – aus Methanhydrat gewonnenes Methan gilt daher als Kandidat für zukünftige Brennstoffe.
Die heute wichtigsten kommerziellen Quellen für Alkane sind jedoch eindeutig Erdgas und Erdöl, die als einzige organische Verbindungen mineralisch in der Natur vorkommen. Erdgas enthält in erster Linie Methan und Ethan, daneben auch Propan und Butan, Erdöl besteht dagegen aus einem Gemisch flüssiger Alkane und anderer Kohlenwasserstoffe. Beide entstanden, als tote Meerestiere unter Sauerstoffabschluss von Sedimenten bedeckt und im Verlauf vieler Millionen Jahre bei hohen Temperaturen und hohem Druck zu den jeweiligen Naturstoffen umgewandelt wurden. Erdgas entstand dabei beispielsweise durch folgende Reaktion:
Sie sammelten sich dann in porösen Gesteinen, die nach oben durch undurchlässige Schichten abgedichtet waren. Anders als Methan, das ständig in großem Maße neu gebildet wird, entstehen höhere Alkane in der Natur nicht in nennenswertem Umfang neu. Ihr Vorkommen wird in einigen Jahrzehnten daher erschöpft sein.
Feste Alkane kommen als Verdunstungsrückstand zutage getretenen Erdöls, als so genanntes Erdwachs vor. Eines der größten Vorkommen natürlicher fester Alkane befindet sich im so genannten Asphaltsee von La Brea auf der Karibik-Insel Trinidad.
Verwendung und Weiterverarbeitung

Alkane sind zum einen bedeutende Grundstoffe der chemischen Industrie, wo sie zum Beispiel zu Kunststoffen weiterverarbeitet werden, zum anderen die wichtigsten Brennstoffe der Weltwirtschaft.
Ausgangspunkt der Verarbeitung sind immer Erdgas und Erdöl. Letzteres wird in der Erdölraffinerie durch fraktionierte Destillation aufgetrennt und dann zu vielen weiteren wichtigen Produkten wie zum Beispiel Benzin weiterverarbeitet. Dazu wird ausgenutzt, dass unterschiedliche „Fraktionen“ des Rohöls unterschiedliche Siedepunkte besitzen und so leicht voneinander getrennt werden können. Innerhalb der einzelnen Fraktionen liegen die Siedepunkte dagegen eng beieinander.
Das jeweilige Einsatzgebiet eines bestimmten Alkans lässt sich recht gut nach der Zahl der enthaltenen Kohlenstoffatome einteilen, obwohl die folgende Abgrenzung idealisiert ist und nicht streng gilt:
Die ersten vier Alkane werden hauptsächlich für Heiz- und Kochzwecke verwendet. Methan und Ethan sind die Hauptbestandteile von Erdgas; sie werden normalerweise unter Druck in gasförmigem Zustand gelagert. Ihr Transport ist allerdings im flüssigen Zustand günstiger, das Gas muss zu diesem Zweck dann durch hohen Druck komprimiert werden.
Propan und Butan lassen sich dagegen schon durch niedrigen Druck verflüssigen und kommen daher im Flüssiggas vor, das als Kraftstoff benutzt wird – als Autogas in Verbrennungsmotoren und in der Landwirtschaft beim Antrieb von Traktoren. Propan kommt zum Beispiel im Propangasbrenner, Butan in Feuerzeugen zum Einsatz – beim Austritt geht die unter leichtem Druck stehende Flüssigkeit, die zu 95 Prozent aus n-Butan und zu 5 Prozent aus iso-Butan besteht, in ein Gemisch aus Gas und feinen Tröpfchen über und lässt sich so leicht entzünden. Daneben werden die beiden Alkane als Treibmittel in Spraydosen genutzt.
Pentan bis Octan sind leicht flüchtige Flüssigkeiten und daher als Brennstoff in gewöhnlichen Verbrennungsmotoren brauchbar, da sie beim Eintritt in die Verbrennungskammer leicht in den gasförmigen Zustand übergehen und dort keine Tröpfchen bilden, was die Gleichmäßigkeit der Verbrennung beeinträchtigen würde. Im Treibstoff sind nur verzweigte Alkane erwünscht, weil sie nicht wie die unverzweigten leicht zur Frühzündung neigen. Ein Maß für die Frühzündung einer Benzinart ist ihre Oktanzahl. Sie gibt an, in welchem Maße ein Stoff zur frühzeitigen Selbstentzündung neigt. Als Bezugszahl für die Oktanwerte wurden willkürlich die zwei Alkane Heptan (n-Heptan) und iso-Octan (2,2,4-Trimethylpentan) gewählt, die jeweils die Oktanzahl 0 (Heptan, neigt zu Frühzündung) und die Oktanzahl 100 (iso-Octan, neigt kaum zur Selbstentzündung) erhielten. Die Oktanzahl eines Treibstoffes gibt an, wie viel Vol.-% iso-Octan in einer Mischung aus iso-Octan und Heptan seinen Klopfeigenschaften entspricht. Neben ihrer Funktion als Brennstoff sind die mittleren Alkane auch gute Lösungsmittel für unpolare Substanzen.
Alkane von Nonan bis etwa zum Hexadecan, einem Alkan mit sechzehn Kohlenstoffatomen, sind Flüssigkeiten von höherer Viskosität, sind also zähflüssiger und eignen sich daher mit zunehmender Kohlenstoffzahl immer schlechter für den Einsatz in gewöhnlichem Benzin. Sie bilden stattdessen den Hauptbestandteil von Dieselkraftstoff und Flugbenzin. Da sich die Wirkweise eines Dieselmotors oder einer Turbine grundlegend von derjenigen eines Otto-Motors unterscheidet, spielt ihre größere Zähflüssigkeit hier keine Rolle. Wegen seines hohen Gehalts an langkettigen Alkanen kann Dieselkraftstoff bei tiefen Temperaturen allerdings fest werden, ein Problem, das sich hauptsächlich in polnahen Gebieten stellt. Schließlich sind die angegebenen Alkane Teil des Petroleums und wurden früher in Petroleumlampen eingesetzt.
Alkane vom Hexadecan aufwärts bilden die wichtigsten Bestandteile von Heizöl und Schmieröl. In Letzterer Funktion wirken sie gleichzeitig als Antikorrosionsmittel, da durch ihre hydrophobe Art kein Wasser an die korrosionsgefährdeten Teile gelangen kann. Viele feste Alkane finden Verwendung als Paraffinwachs, aus dem zum Beispiel Kerzen hergestellt werden können. Es sollte allerdings nicht mit echtem Wachs verwechselt werden, das in erster Linie aus Estern besteht.
Alkane mit einer Kettenlänge von etwa 35 oder mehr Kohlenstoffatomen finden sich in Asphalt, werden also unter anderem als Straßenbelag eingesetzt. Insgesamt haben die höheren Alkane allerdings wenig Bedeutung und werden deshalb meist durch Cracken in niedere Alkane zerlegt.
Alkane in der belebten Natur
Alkane kommen in der Natur auf vielfältige Weise vor, zählen aber biologisch nicht zu den essentiellen Stoffen.
Alkane bei Bakterien und Archaeen

Bestimmte Bakterienarten setzen Alkane in ihrem Stoffwechsel um. Dabei werden geradzahlige Kohlenstoffketten von ihnen bevorzugt, weil diese leichter abbaubar sind als ungeradzahlige.
Umgekehrt produzieren manche Archaeen, die so genannten Methanbildner, in großen Mengen das leichteste Alkan, Methan, aus Kohlendioxid. Die dazu notwendige Energie gewinnen sie durch Oxidation molekularen Wasserstoffs:
Methanbildner sind auch die Erzeuger des in Mooren und Sümpfen freiwerdenden Sumpfgases, das auf ähnliche Weise in den Faultürmen der Klärwerke entsteht, und setzen jährlich etwa zwei Milliarden Tonnen Methan frei – der atmosphärische Gehalt an diesem Gas ist praktisch ausschließlich von ihnen erzeugt worden.
Auch der Methanausstoß der Cellulose verdauenden Pflanzenfresser, u. a. den Wiederkäuern – speziell den Rindern, die täglich bis zu 150 Liter freisetzen können – bis zu den Termiten geht letztlich auf Methanbildner zurück. In – allerdings kleinerem – Maßstab produzieren sie dieses einfachste aller Alkane auch im Darm des Menschen. Methanbildende Archaeen sind daher entscheidend am Kohlenstoffkreislauf beteiligt, in dem sie photosynthetisch gebundenen Kohlenstoff wieder in die Atmosphäre zurückführen. Die heutigen Erdgasvorkommen gehen wahrscheinlich zu einem großen Teil auf diese Lebewesengruppe zurück.
Alkane bei Pilzen und Pflanzen
Auch bei den drei eukaryotischen Hauptgruppen der Lebewesen, den Pilzen, Pflanzen und Tieren spielen Alkane eine gewisse, wenn auch insgesamt untergeordnete Rolle. Bei Ersteren treten hauptsächlich die flüchtigeren Vertreter auf und zwar in den Sporen; einige spezialisierte Hefen, die Alkanhefen, nutzen Alkane zudem als Energie- und Kohlenstoffquelle. Der Kerosinpilz (Amorphotheca resinae) verstoffwechselt bevorzugt Flugbenzin aus langkettigen n-Alkanen.
Bei Pflanzen finden sich neben verzweigten, cyclischen, ungesättigten und Heterokomponenten enthaltenden organischen Substanzen in erster Linie die langkettigen festen Vertreter; sie bilden zusammen mit den anderen Verbindungen bei fast allen eine feste Wachsschicht, welche die an der Luft freiliegende Außenhaut, die Cuticula, bedeckt. Ihre Funktion liegt zum einen im Schutz gegen Austrocknung, zum anderen in der Vorsorge gegen Auswaschung wichtiger Minerale durch Regen und schließlich in der Abwehr von Bakterien, Pilzen und Schadinsekten – Letztere sinken mit ihren Beinen oft in die weiche wachsartige Substanz ein und werden dadurch beim Laufen behindert. Auch die glänzende Schicht auf Früchten wie Äpfeln besteht aus langkettigen Alkanen. Die Kohlenstoffketten sind meist zwischen zwanzig und vierzig Atome lang und haben Alkansäuren als Vorläuferverbindungen in der Wachssynthese der Pflanzen. Da die Alkansäuren aus C2-Einheiten aufgebaut werden (Citratcyclus) und Alkane durch Verlust der Carboxygruppe – der Decarboxylierung – gebildet werden, weisen Blattwachsalkane höherer Landpflanzen eine ungeradzahlige Kohlenstoffzahlbevorzugung im oben genannten Kohlenstoffzahlbereich auf. Die genaue Zusammensetzung der Wachsschicht ist nicht nur artabhängig, sondern wechselt auch mit der Jahreszeit und hängt zudem von Umweltfaktoren wie Lichtverhältnissen, Temperatur oder Luftfeuchte ab. Jedoch wurde herausgefunden, dass insbesondere Gräser, am deutlichsten Gräser der tropischen und subtropischen Vegetationszonen (in Steppen und Savannen) sich im Vergleich zu Bäumen und Sträuchern deutlich in den Kettenlängenverteilungsmustern der Alkane durch einen leichten Versatz zu längeren Kohlenstoffketten auszeichnen. Diese Tatsache nutzen z. B. Agrarwissenschaftler in der Ernährungsforschung von Herbivoren, als auch Klimaforscher zur Beurteilung der klimaabhängigen Grasverteilung der Erde in der geologischen Vergangenheit.
Alkane bei Tieren
Bei Tieren treten Alkane in ölhaltigen Geweben auf, spielen dort im Gegensatz zu den ungesättigten Kohlenwasserstoffen aber keine bedeutende Rolle. Ein Beispiel ist die Haileber, aus der sich ein Öl gewinnen lässt, das zu etwa 14 Prozent aus Pristan besteht, einem Alkan mit der Strukturbezeichnung 2,6,10,14-Tetramethylpentadecan (C19H40). Wichtiger ist das Vorkommen in Pheromonen, chemischen Botenstoffen, auf die vor allem Insekten zur Kommunikation angewiesen sind. Bei manchen Arten, wie dem Bockkäfer Xylotrechus colonus, der vor allem n-Pentacosan (C25H52), 3-Methylpentacosan (C26H54) und 9-Methylpentacosan (C26H54) produziert, werden sie durch Körperkontakt übertragen, so dass man von Kontaktpheromonen spricht. Auch bei anderen wie der Tse-Tse-Fliege Glossina morsitans morsitans, deren Pheromon vorrangig aus den vier Alkanen 2-Methylheptadecan (C18H38), 17,21-Dimethylheptatriacontan (C39H80), 15,19-Dimethylheptatriacontan (C39H80) und 15,19,23-Trimethylheptatriacontan (C40H82) besteht, wirken die Stoffe über Körperkontakt[13] und dienen als Sexuallockstoff – ein Umstand, den man sich bei der Bekämpfung dieses Krankheitsüberträgers zunutze macht.
Alkane und ökologische Beziehungen

Ein Beispiel, bei dem sowohl die pflanzliche als auch die tierische Alkannutzung eine Rolle spielt, bietet die ökologische Wechselbeziehung zwischen der zu den Sandbienen (Andrena) gehörigen Art Andrena nigroaenea und der zu den Orchideen (Orchidaceae) gezählten Großen Spinnen-Ragwurz (Ophrys sphegodes). Letztere ist zur Bestäubung auf Erstere angewiesen. Auch Sandbienen nutzen zur Partnerfindung Pheromone; im Falle von Andrena nigroaenea setzen die Weibchen der Art ein Gemisch ein, dass aus Tricosan (C23H48), Pentacosan (C25H52) und Heptacosan (C27H56) im Verhältnis 3:3:1 besteht – Männchen werden durch genau diesen Duftstoff angelockt. Die Orchidee macht sich diesen Umstand zunutze – Teile ihrer Blüte ähneln nicht nur optisch den Sandbienen, sondern strömen auch große Mengen der oben genannten drei Substanzen aus – und zwar in demselben Verhältnis. Selbst das die Blätter bedeckende Wachs hat die gleiche chemische Zusammensetzung wie der Sexuallockstoff der weiblichen Bienen. Als Resultat werden zahlreiche Männchen zu den Blüten gelockt und vollführen dort so genannte Pseudokopulationen, unternehmen also den Versuch, sich mit einer imaginären Partnerin auf der Blüte fortzupflanzen. Während dieses Unterfangen naturgemäß für die Bienen nicht von Erfolg gekrönt ist, wird durch die Kopulationsversuche Pollen auf das jeweilige Insekt übertragen, der nach frustriertem Abzug desselben zu anderen Blüten verbracht werden kann, also der Fortpflanzung der Orchidee dient. Die Spinnen-Ragwurz ist durch diesen als chemische Mimikry bezeichneten Alkaneinsatz in der Lage, auf die energieintensive Produktion konventioneller Insektenlockmittel weitgehend zu verzichten.[14]
Literatur
- Peter W. Atkins: Kurzlehrbuch Physikalische Chemie. Wiley-VCH, Weinheim 2001, ISBN 3-527-30433-9.
- Peter Pfeifer, Roland Reichelt (Hrsg.): H2O & Co Organische Chemie. Oldenbourg, München 2003, ISBN 3-486-16032-X.
- Kurt Peter C. Vollhardt, Neil E. Schore: Organische Chemie. Wiley-VCH, Weinheim 2000, ISBN 3-527-29819-3.
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Thieme, Stuttgart 2001, ISBN 3-13-541504-X.
- F. Rommerskirchen, A. Plader, G. Eglinton, Y. Chikaraishi, J. Rullkötter: Chemotaxonomic significance of distribution and stable carbon isotopic composition of long-chain alkanes and alkan-1-ols in C4 grass waxes. In: Organic Geochemistry, 37, 2006, S. 1303–1332, doi:10.1016/j.orggeochem.2005.12.013.
Weblinks
Einzelnachweise
- Eintrag zu alkanes. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.A00222.
- Der Brockhaus, Naturwissenschaft und Technik, Mannheim; Spektrum Akademischer Verlag, Heidelberg 2003.
- Uwe Meierhenrich: Amino Acids and the Asymmetry of Life, Springer-Verlag, Heidelberg / Berlin 2008, ISBN 978-3-540-76885-2.
- Nils O. B. Lüttschwager, Tobias N. Wassermann, Ricardo A. Mata, Martin A. Suhm: Das letzte Alkan mit gestreckter Grundzustandskonformation. In: Angewandte Chemie. Band 124, Nr. 39, 2012, S. 482–485, doi:10.1002/ange.201202894.
- Strukturisomere der Alkane, Skript der Uni Bayreuth, abgerufen am 21. Juli 2017.
- Siegfried Hauptmann, Jürgen Graefe, Horst Remane: Lehrbuch der Organischen Chemie. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1976. DNB 770047483
- Liste der Stereoisomere der Alkane (OEIS Liste A000628) Abgerufen am 23. Juli 2017.
- Anzahl der Konstitutionsisomere bis 100 C-Atome Abgerufen am 22. Juli 2017.
- Arnold Arni: Grundkurs Chemie I und II, Wiley-VCH, 2011, ISBN 978-3-527-33068-3, S. 18–19.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Heat of Combustion, S. 5-70.
- Eintrag zu CAS-Nr. 109-66-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Juni 2015. (JavaScript erforderlich)
- Eintrag zu CAS-Nr. 110-54-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Juni 2015. (JavaScript erforderlich)
- D. A. Carlson, P.A. Langley, P. Huyton: Sex pheromone of the tsetse fly: isolation, identification, and synthesis of contact aphrodisiacs. In: Science 201, 1978. S. 750–753; doi:10.1126/science.675256.
- M. Ayasse, W. Francke, B. S. Hansson, F. Ibarra, C. Löfstedt, H. F. Paulus, F. P. Schiestl: Orchid pollination by sexual swindle. In: Nature 399, 1999. S. 421; doi:10.1038/20829.