Tetrafluormethan
Tetrafluormethan (auch Tetrafluorkohlenstoff) ist eine chemische Verbindung aus der Reihe der Fluorkohlenwasserstoffe. Bei ihm sind alle Wasserstoffatome des Methans durch Fluoratome substituiert. Beide Bezeichnungen sind nach der IUPAC-Nomenklatur korrekt, abhängig davon, ob die Verbindung als organische (Tetrafluormethan) oder anorganische (Tetrafluorkohlenstoff) Verbindung angesehen wird.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
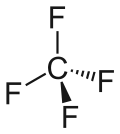 | ||||||||||||||||
| Keile zur Verdeutlichung der Geometrie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetrafluormethan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CF4 | |||||||||||||||
| Kurzbeschreibung |
geruch- und farbloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 88,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
3,72 kg·m−3 (15 °C, 1013 mbar)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
schwer in Wasser (20 mg·l−1 bei 20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Treibhauspotential |
7349 (bezogen auf 100 Jahre)[4] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−933,6 kJ/mol[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Tetrafluormethan kann einerseits durch Verbrennung von Kohlenstoff in Fluor, andererseits durch elektrische Entladung in einem Kohlenstoffmonoxid-Fluorgemisch dargestellt werden:[6]
Eine weitere Methode ist die Umsetzung von Siliciumcarbid mit Fluor zu Tetrafluormethan und Siliciumtetrafluorid:[7]
Die Umsetzung ist nahezu quantitativ, und die gasförmige Siliciumverbindung kann aus dem Gasgemisch durch Waschen mit einer Natriumhydroxidlösung (Hydrolyse) entfernt werden.
Eigenschaften
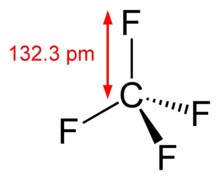
Physikalische Eigenschaften
Tetrafluormethan ist ein farb- und geruchloses Gas mit einem Schmelzpunkt von −184 °C und einem Siedepunkt von −128 °C. Tetrafluormethan ist in Wasser sehr schlecht (20 mg pro kg Wasser bei 20 °C[3]) löslich, in Ethanol (ca. 80 mg pro kg Ethanol bei 25 °C[8]) und Benzol (ca. 64 mg pro kg Benzol bei 25 °C[9]) etwas besser.
Chemische Eigenschaften
Tetrafluormethan ist sehr reaktionsträge und wird von Säuren und Laugen nicht angegriffen. Lediglich siedende Alkalimetalle und heiße Alkalimetalldämpfe vermögen es langsam anzugreifen.[7] Durch thermische Zersetzung oberhalb 1000 °C entstehen giftige Stoffe (Carbonylfluorid, Kohlenstoffmonoxid), in Gegenwart von Wasser auch der aggressive Fluorwasserstoff.
Es besitzt ein Treibhauspotenzial von 7349[4] und ist damit ein extrem starkes Treibhausgas.
Verwendung und Emissionen
Tetrafluormethan wird als Kältemittel zum Ersatz von FCKWs verwendet, da es keine abbauende Wirkung auf die Ozonschicht hat. Aufgrund des hohen Treibhauspotenzials jedoch wird in der F-Gase-Verordnung festgelegt, dass Anlagen mit den entsprechenden Gasen möglichst geringe Leckmengen abgeben sollen. Große Mengen Tetrafluormethan werden bei der Aluminiumerzeugung freigesetzt.
Toxikologie
Tetrafluormethan gilt als ungiftig. Es kann jedoch in geschlossenen Räumen durch Verdrängen der Luft zur Erstickung führen. Bei geringeren Konzentrationen ist eine narkotische Wirkung möglich.[2]
Siehe auch
Weblinks
Einzelnachweise
- Eintrag zu Tetrafluormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Datenblatt Tetrafluoromethane bei Air Liquide.
- B. A. Cosgrove, J. Walkley: Solubilities of gases in H2O and 2H2O. in: J. Chromatogr. A 216, 1981, S. 161–167; doi:10.1016/S0021-9673(00)82344-4.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage, Band 1, Academic Press 1963, S. 203–204.
- Homer F. Priest: Anhydrous metal fluorides. In: Ludwig F. Audrieth (Hrsg.): Inorganic Syntheses. Band 3. McGraw-Hill, Inc., 1950, S. 171–183 (englisch).
- Shiqing Bo, Rubin Battino, Emmerich Wilhelm: The Solubility of Gases in Liquids. 19. The Solubility of He, Ne, Ar, Kr, Xe, CH4, CF4, SF6 in Normal 1-Alkanols n-CIH2I+1OH (1 ≤ I ≤ 11) at 298.15 K. In: J. Chem. Eng. Data Band 38, Nr. 4, 1993, S. 611–616; doi:10.1021/je00012a035.
- Graham Archer, Joel H. Hildebrand: The Solubility and Entropy of Solution of Carbon Tetrafluoride and Sulfur Hexafluoride in Nonpolar Solvents. In: J. Phys. Chem. Band 67, Nr. 9, 1963, S. 1830–1833; doi:10.1021/j100803a021.
