Synthesegas
Als Synthesegas bezeichnet man im weitesten Sinne ein Gasgemisch, das zu einer Synthese eingesetzt wird, so z. B. auch das Gemisch aus Stickstoff und Wasserstoff für die Ammoniaksynthese. Im engeren Sinn versteht man unter Synthesegas industriell hergestellte Gasgemische, die hauptsächlich Kohlenstoffmonoxid und Wasserstoff neben wechselnden Mengen weiterer Gase enthalten. Je nach Herstellungsverfahren oder Verwendungszweck sind auch einige andere Begriffe für Synthesegas in Gebrauch: Wird Synthesegas aus Wasser und Kohle gewonnen, so wird es Wassergas genannt, bei Methan als Quelle Spaltgas. Methanol-Synthesegas ist Synthesegas für die Methanolherstellung, Oxogas für die Hydroformylierung (oder Oxosynthese).
Herstellung
Die Herstellung von Synthesegas kann prinzipiell aus festen (s – solid), flüssigen (l – liquid) und gasförmigen (g – gaseous) Edukten (Ausgangsstoffen) erfolgen.
Synthesegas aus festen Edukten
Bei der Herstellung von Synthesegas aus festen Edukten ist vor allem die Kohlevergasung zu nennen. Kohle – C(s) wird hierbei in einer Mischung aus partieller (teilweiser/unvollständiger) Oxidation mit Luft- oder reinem Sauerstoff – O2(g) und Vergasung mit Wasserdampf – H2O(g) zu einem Gemisch aus Kohlenmonoxid – CO(g) und Wasserstoff – H2(g) umgesetzt. Durch das Boudouard-Gleichgewicht steht CO(g) noch mit C(s) und Kohlendioxid – CO2(g) im Gleichgewicht:
Weiterhin muss das Wassergas-Gleichgewicht berücksichtigt werden:
Die Umsetzung mit Sauerstoff liefert dabei durch die exotherme Reaktion die notwendige Energie zur Erzielung der hohen Reaktionstemperatur für die endotherme Vergasungsreaktion von Kohle mit Wasserdampf.
Durch geschickte Wahl der Einsatzstoffe kann die Zusammensetzung des Synthesegases gesteuert werden (je nach gewünschtem Kohlenmonoxid- und Wasserstoffgehalt).
Da in Kohle neben Kohlenstoff noch weitere Elemente enthalten sind (Schwefel, Stickstoff, Vanadium, …), muss das erhaltene Synthesegas nach dem Reaktor noch aufwendig gereinigt und aufbereitet werden. Hierbei müssen vor allem Wasser, CO2, Ruß und H2S entfernt werden.
Neben Kohle ist prinzipiell auch der Einsatz anderer Feststoffe wie z. B. Biomasse (Holz, Stroh) denkbar, jedoch ist hierbei auch eine Vorbehandlung der Einsatzstoffe und eine Nachbehandlung bzw. Reinigung des Synthesegases notwendig.
Synthesegas aus flüssigen Edukten
Als flüssige Edukte für Synthesegas können unterschiedliche Rohöldestillate eingesetzt werden, sowohl leichtsiedende als auch hochsiedende Fraktionen. Leicht siedende Destillate können nach Entfernung von Schwefel durch Umsetzung mit Wasserdampf nach dem Dampfreformierung-Verfahren umgesetzt werden. Das Steam-Reforming-Verfahren ist eine endotherme Reaktion, welche an einem heterogenen Katalysator durchgeführt wird (Reaktion am Beispiel Pentan):
Beim Einsatz von hochsiedenden Ölfraktionen (flashed visbroken residue, siehe Cracken) wird die partielle Oxidation durchgeführt, welche ohne Katalysator auskommt (Reaktion am Beispiel Pentan):
Synthesegas aus gasförmigen Edukten
Das wichtigste gasförmige Edukt zur Synthesegaserzeugung ist Erdgas. Erdgas liefert im Vergleich mit den anderen Edukten den höchsten Anteil an Wasserstoff im Verhältnis zu Kohlenmonoxid.
Dampfreformierung
Das Erdgas wird hierbei mit Wasserdampf nach dem Dampfreformierungs-Verfahren (englisch Steam Reforming) umgesetzt:
Plasma-Konverter
Ein im Jahr 2012 entwickeltes zweistufiges Verfahren produziert Synthesegas, welches nur aus Kohlenmonoxid und Wasserstoff besteht. Im ersten Schritt wird Methan mit Hilfe von Plasma bei mehr als 1000 °C in eine Mischung aus Kohlenstoff und Wasserstoff zersetzt[1] (Reaktion: CH4 + Energie → C + 2 H2). Im zweiten Schritt wird CO2 zu der Mischung aus Kohlenstoff und Wasserstoff gegeben. Der Kohlenstoff und das CO2 reagieren bei hoher Temperatur zu Kohlenmonoxid (Reaktion: C + CO2 → 2 CO). Alternativ kann Wasser anstelle von CO2 verwendet werden, um eine höhere Wasserstoffkonzentration im Synthesegas zu erhalten[2]. In diesem Fall ist die zweite Reaktion: C + H2O → CO + H2. Zusammen mit dem Wasserstoff aus dem ersten Schritt erhält man in beiden Alternativen ein hochreines Synthesegas, welches nur aus CO und H2 besteht[3].
Das Verhältnis von CO zu H2 kann jeweils variiert werden. Wenn das Synthesegas an einen nachfolgenden Syntheseprozess (z. B. Fischer-Tropsch-, DME-, Benzin- und Alkohol-Synthese) angepasst ist, ergibt sich ein PGtL-Verfahren (PGtL - Power-and-Gas-to-Liquid).[4]
Partielle Oxidation
Neben dem Dampfreformierungs- bzw. Steam-Reforming-Verfahren kann man Erdgas auch durch partielle Oxidation (POX) zu Synthesegas umsetzen:
Synthesegas für die Ammoniak-Synthese stellt man auch durch partielle Oxidation her, wobei hier Luft anstelle von reinem Sauerstoff verwendet wird. Das anfallende Kohlenmonoxid wird in einer zweiten Reaktionsstufe mit Wasserdampf zu CO2 und weiterem Wasserstoff konvertiert (umgesetzt):
Nach Abtrennung von CO2 wird dann eine Mischung aus N2 und H2 erhalten, welche anschließend noch auf das gewünschte N2/H2-Molverhältnis eingestellt werden muss.
Synthesegas aus Luft und Strom
Aus der Umgebungsluft per Direct air capture, oder konzentrierter aus Rauchgas, kann Mithilfe der Aminwäsche oxidierter Kohlenstoff (CO2) gewonnen werden, der im Sabatier-Prozess zu Methan gewandelt werden kann. Für das Heizen der Katalysatoren, den Betrieb des Aminwäschers und der Elektrolyse des Wassers bei der Wasserstoffgewinnung wird Strom benötigt. Bei diesem Prozess erfolgt der Energieumsatz mit einem Wirkungsgrad bis 80 Prozent. Das entstehende Gas ist auch die Vorstufe zur Herstellung von E-Fuel (Power-to-Liquid), welcher nachfolgend per Fischer-Tropsch-Verfahren und Hydrocracken erzeugt werden kann.[5]
Synthesegasreinigung
An die meisten der genannten Herstellungsverfahren schließen sich nach dem Reaktor mehr oder weniger aufwändige und komplexe Reinigungs- und Aufbereitungsverfahren an. Im Wesentlichen sind dies:
- Rußabtrennung
- Wasserentfernung und Trocknung
- Abtrennung von Schwefelverbindungen
- Einstellung des gewünschten CO : H2-Verhältnisses
- CO2-Abtrennung.
Verwendung
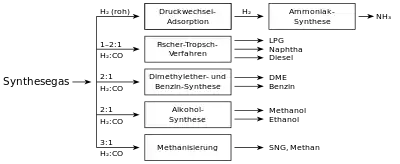
Am häufigsten werden Synthesegase verwendet:
- in der Methanolsynthese
- in der Ammoniaksynthese nach dem Haber-Bosch-Verfahren
- in der Oxosynthese
- sowie
- in der Fischer-Tropsch-Synthese
Neben diesen chemisch-technischen Anwendungsbereichen kann Synthesegas auch über eine Fermentation biotechnologisch genutzt werden. Produkte dieser Option können bsp. Alkohole wie Ethanol, Butanol und 1,2-Propandiol, Aceton sowie organische Säuren sein.
Literatur
- Klaus Weissermel, Hans-Jürgen Arpe: Industrielle Organische Chemie. 6. Auflage. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31540-6, S. 15–30.
- Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner: Industrial Inorganic Chemistry. 2. Auflage. Wiley-VCH, Weinheim 2000, ISBN 978-3-527-29849-5, S. 32–38.
- Anonymus: Dellwik-Fleischer's Wassergasverfahren und seine Anwendungen. In: Polytechnisches Journal. 314, 1899, S. 65–69.
Siehe auch
Einzelnachweise
- dieBrennstoffzelle.de - Kvaerner-Verfahren. Abgerufen am 21. November 2019.
- Kühl: EP 2794467 B1 "Verfahren und Anlage zur Erzeugung von Synthesegas" Caphenia / CCP Technology. In: Espacenet. Europäisches Patentamt EPA, abgerufen am 21. November 2019.
- Kühl: EP 2794466 B1 "Verfahren und Anlage zur Umwandlung von Kohlendioxid in Kohlenmonoxid" Caphenia / CCP Technology. In: Espacenet. Europäisches Patentamt EPA, abgerufen am 21. November 2019.
- Kühl: EP 3160899 B1 "Verfahren und Vorrichtung zur Herstellung von H2-reichem Synthese Gas" Caphenia / CCP Technology. In: Espacenet. Europäisches Patentamt EPA, abgerufen am 9. Februar 2021.
- http://www.kit.edu/kit/pi_2019_107_kohlendioxidneutrale-kraftstoffe-aus-luft-und-strom.php