Aminoalkohole
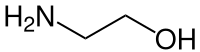
Aminoalkohole, auch Alkanolamine, bilden in der organischen Chemie eine Stoffgruppe von Verbindungen, die zugleich mindestens zwei funktionelle Gruppen enthalten, davon eine Hydroxygruppe und eine Aminogruppe. In der Regel spricht man von primären Aminoalkoholen, bei denen die Verbindung eine primäre Aminogruppe (–NH2) besitzt.
| Aminoalkohole |
|---|
| Allgemeine Struktur der (primären) Aminoalkohole mit der blau markierten primären Amino- und Hydroxygruppe. Der Rest R stellt dabei einen aliphatischen, cyclischen oder aromatischen Rest dar. |
Die Bezeichnung Alkanolamine gilt als fachsprachliche Trivialbezeichnung, Aminoalkohole als systematischer Name der Stoffgruppe.[1]
N-alkylierte Aminoalkohole
Aminoalkohole, deren Verbindungen eine sekundäre (–NHR) oder tertiäre (–NR2) Aminofunktion aufweisen, werden als Alkylalkanolamine oder Alkylaminoalkohole bezeichnet. Alkylalkanolamine werden durch Alkylierung der entsprechenden Epoxide hergestellt. Dabei werden primäre und sekundäre Amine als Alkylierungsmittel eingesetzt und es entstehen die entsprechenden N-alkylierte Derivate der primären Aminoalkohole.
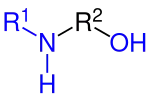 Allgemeine Strukturformel der sekundären Aminoalkohole (N-Alkylalkanolamin)
Allgemeine Strukturformel der sekundären Aminoalkohole (N-Alkylalkanolamin)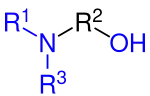 Allgemeine Strukturformel der tertiären Aminoalkohole (N,N-Dialkylalkanolamin)
Allgemeine Strukturformel der tertiären Aminoalkohole (N,N-Dialkylalkanolamin)
Einteilung
Je nach der relativen Stellung („Entfernung“) der Hydroxy- und der Aminogruppe zueinander unterscheidet man zwischen
- α-Aminoalkohole [1,1-Aminoalkohole, meist Halbaminale (Synonym: Halbaminoacetal) genannt],
- β-Aminoalkoholen (1,2-Aminoalkohole),
- γ-Aminoalkoholen (1,3-Aminoalkohole) und
- δ-Aminoalkoholen (1,4-Aminoalkohole) etc.
Relative Stabilität
- α-Aminoalkohole: Halbaminale können stabil sein, wenn an das Stickstoffatom kein Wasserstoffatom gebunden ist. Sie können oft nicht direkt beobachtet werden. Dies erfordert in der Regel spezielle Bedingungen.[2] Wenn an das Stickstoffatom eines Halbaminals ein Wasserstoffatom gebunden ist, erfolgt meist eine Wasserabspaltung unter Bildung eines Imins.
- β-Aminoalkohole, γ-Aminoalkohole und δ-Aminoalkoholen etc. sind in der Regel stabil.
Herstellung
1,1-Aminoalkohole
Die folgende Reaktion zeigt ein Beispiel für die Bildung eines Halbaminals aus dem sekundären Amin Carbazol und Formaldehyd.[3][4]
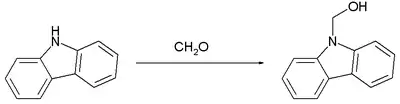
Die Bildung von Halbaminalen ist eine Schlüsselreaktion bei der asymmetrischen Synthese von Saxitoxin.[5]
1,2-Aminoalkohole
Der einfachste Aminoalkohol, 2-Aminoethanol (Colamin), kann durch die Reaktion von Oxiran mit Ammoniak oder durch die Umsetzung von Aziridin mit Wasser dargestellt werden.[6] Die Ringöffnung eines Oxirans mit einem Azid führt zu einem Azido-substituiertem Alkohol, dessen anschließende Reduktion zu dem entsprechenden 1,2-Aminoalkohol führt.[7]
Durch die Reduktion von enantiomerenreinen Aminosäureestern mit Lithiumaluminiumhydrid lassen sich in hoher Ausbeute optisch aktive Aminoalkohole synthetisieren.[8] Die Reduktion von Aminosäuren mit Boran (BH3) liefert ebenfalls Aminoalkohole.[9] Die chiralen – von α-Aminosäuren durch Reduktion abgeleiteten – 1,2-Aminoalkohole werden oft mit Trivialnamen bezeichnet, die sich von aus der Aminosäurenomenklatur ergeben, z. B.:
- (S)-Prolin ergibt (S)-Prolinol
- (S)-Alanin ergibt (S)-Alaninol
- (S)-Valin ergibt (S)-Valinol
- (S)-Leucin ergibt (S)-Leucinol
- (S)-Phenylalanin ergibt (S)-Phenylalaninol
- (R)-Phenylglycin ergibt (R)-Phenylglycinol
Die Umsetzung von enantiomerenreinen Aminosäureestern mit Grignard-Verbindungen ergibt unter Konfigurationserhalt Aminoalkohole, die zugleich tertiäre Alkohole sind.
1,3-Aminoalkohole
Bei der Ringöffnung eines Oxetans mit einem Amin kann sich ein 1,3-Aminoalkohol bilden, allerdings verläuft die Reaktion nicht so glatt wie die analoge Ringöffnung eines Oxirans mit einem Amin.[10]
Verwendung
Technisch wichtige Aminoalkohole sind Mono-, Di- und Triethanolamin, Dimethylaminoethanol, Diethylaminoethanol, N-Methyldiethanolamin sowie Mono-, Di- und Triisopropanolamin. Alkanolamine können in der Gasreinigung zur Schwefelwasserstoff- und Kohlendioxid-Absorption eingesetzt werden.[11][12] Hierbei lösen sich die genannten sauren Gase zunächst in einer wässrigen Alkanolaminlösung. Dann reagieren sie mit der Aminogruppe des Alkanolamins.
Arzneistoffe
Zahlreiche Arzneistoffe zählen zu den 2-Aminoalkoholen. Ein Beispiel ist das Muskelrelaxans Phenyramidol.[13][14] Die meisten β-Blocker zählen zu den Aminoalkoholen, wie z. B. Propanolol,[15] Acebutolol, Atenolol, Betatoxol, Bisoprolol, Carteolol, Nebivolol, Labetalol, Metoprolol, Pindolol, Timolol und Penbutolol.
Katalysatoren in der organischen Synthese
Bei der katalytischen enantioselektiven Organozinkaddition an Aldehyde werden chirale Aminoalkohole als Katalysatoren eingesetzt.[16][17][18] Chirale 1,2-Aminoalkohole benutzt man zur Herstellung von Oxazaborolidinen (CBS-Katalysatoren), die in der enantioselektiven Reduktion (CBS-Reduktion) unsymmetrischer Ketone zu sekundären Alkoholen als Katalysatoren eingesetzt werden.[19] Die Namen dieser Aminoalkohole leiten sich dabei ab von den Trivialnamen der Aminosäuren aus denen diese synthetisiert wurden:
-Prolinol_Structural_Formula_V1.svg.png.webp) (S)-Prolinol
(S)-Prolinol-Valinol_Structural_Formula_V1.svg.png.webp) (S)-Valinol
(S)-Valinol-Phenylalaninol_Structural_Formula_V1.svg.png.webp) (S)-Phenylalaninol
(S)-Phenylalaninol-Phenylglycinol_Structural_Formula_V1.svg.png.webp) (R)-Phenylglycinol
(R)-Phenylglycinol
Einzelnachweise
- Eintrag zu Alkanolamine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Oktober 2019.
- Stabilization of Labile Carbonyl Addition Intermediates by a Synthetic Receptor Tetsuo Iwasawa, Richard J. Hooley, Julius Rebek Jr. Science 317, 493 (2007) doi:10.1126/science.1143272.
- Milata Viktor, Kada Rudolf, Lokaj J n: Carbazol-9-yl-methanol. In: Molbank. 2004, 2004, S. M354, doi:10.3390/M354.
- Reaktion in Methanol im Rückfluss mit Natriumcarbonat. Durch saure Katalyse reagiert das Aminoacetal zum Imin N,N´-Biscarbazol-9-yl-methan.
- (+)-Saxitoxin: A First and Second Generation Stereoselective Synthesis James J. Fleming, Matthew D. McReynolds, and J. Du Bois J. Am. Chem. Soc., 129 (32), 9964–9975, 2007. doi:10.1021/ja071501o.
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 502, ISBN 3-342-00280-8.
- Michael B. Smith: March's advanced organic chemistry, John Wiley & Sons, 7. Auflage, 2013, S. 489, ISBN 978-0-470-46259-1.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 85, 1982, ISBN 3-527-25892-2.
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie, Springer Spektrum, 2013, 2. Auflage, S. 1212. ISBN 978-3-642-34715-3.
- Michael B. Smith: March's advanced organic chemistry, John Wiley & Sons, 7. Auflage, 2013, S. 490, ISBN 978-0-470-46259-1.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 118.
- Kohl, A.L., Nielsen, R.B.: Gas Purification, Gulf Publ. Co., Houston, TX, 5th ed., 1997.
- Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie, Springer Spektrum, 2013, 2. Auflage, S. 772–773. ISBN 978-3-642-34715-3.
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 7321–7322, ISBN 978-0-911910-00-1.
- Joachim Buddrus: Grundlagen der Organischen Chemie, 4. Auflage, de Gruyter Verlag, Berlin, 2011, S. 351–352, ISBN 978-3-11-024894-4.
- Thomas Mehler, Jürgen Martens: New Thioether Derivatives as Catalysts for the Enantioselective Addition of Diethylzinc to Benzaldehyde, In: Tetrahedron: Asymmetry 1994, 5, 207–210, doi:10.1016/S0957-4166(00)86174-1.
- Sabine Wallbaum, Jürgen Martens: Catalytic Enantioselective Addition of Diethylzinc to Aldehydes: Application of a new Bicyclic Catalyst, Tetrahedron: Asymmetry 1993, 4, 637–640, doi:10.1016/S0957-4166(00)80167-6.
- Viola Peper, Jürgen Martens: New β-Amino Alcohols as Chiral Ligands for the Catalytic Enantioselective Reduction of Prochiral Ketones and the Nucleophilic Addition of Diethylzinc to Benzaldehyde, Chemische Berichte 1996, 129, 691–695, doi:10.1002/cber.19961290616.
- Sabine Wallbaum und Jürgen Martens: Asymmetric Syntheses with Chiral Oxazaborolidines, Tetrahedron: Asymmetry 3 (1992) S. 1475–1504, DOI:10.1016/S0957-4166(00)86044-9.