Mercaptoessigsäure
Mercaptoessigsäure (andere Bezeichnung: Thioglycolsäure) ist eine farblose, viskose Flüssigkeit und gehört zur Gruppe der Thiole, ihre Salze heißen Thioglycolate. Sie ist chemisch verwandt mit der Glycolsäure.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
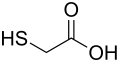 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Mercaptoessigsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C2H4O2S | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 92,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,325 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
220 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
3,68 (25 °C)[4] | |||||||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser[3], Ethanol, Chloroform, Toluol und Diethylether[2] | |||||||||||||||||||||
| Brechungsindex |
1,5080 (20 °C)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 1 ml·m−3 bzw. 4 mg·m−3[7] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Synthese
Die Synthese erfolgt aus Chloressigsäure und Natriumhydrogensulfid durch nukleophile Substitution.[8]
Verwendung
Sie wird seit etwa 1940 in Enthaarungsmitteln und in Friseurprodukten für Dauerwellen benutzt. Diese enthalten etwa 1 bis 11 % Mercaptoessigsäure als Ammoniumsalz (Ammoniumthioglycolat):
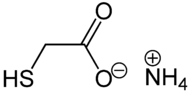
Die Verwendung für Dauerwellen beruht auf der von Leonor Michaelis entdeckten Interaktion von Keratin – aus dem Haare bestehen – mit Thioglycolsäure. Dabei werden Disulfidbrücken zwischen jeweils zwei Cystein-Einheiten des Keratins durch Reduktion getrennt.[9]
Gegebenenfalls findet man auch Kaliumthioglycolat in Enthaarungsmitteln.[10] Außerdem wird sie bei der Lederverarbeitung und bei der Herstellung von Stabilisatoren für PVC eingesetzt. Des Weiteren lassen sich mit ihr Eisenionen durch eine intensive Rotfärbung nachweisen. Die Reaktion von Mercaptoessigsäure mit cyclischen Iminen führt zu bicyclischen Lactamen.[11]
Sicherheitshinweise
Beim Erhitzen zersetzt sich Mercaptoessigsäure unter Bildung von toxischen Dämpfen (Schwefelwasserstoff und Schwefeloxide).
Einzelnachweise
- Eintrag zu THIOGLYCOLIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- Eintrag zu Sulfanylessigsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. März 2014.
- Eintrag zu Thioglykolsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. April 2020. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dissociation Constants of Organic Acids and Bases, S. 8-42.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-484.
- Eintrag zu Mercaptoacetic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 68-11-1 bzw. Mercaptoessigsäure), abgerufen am 2. November 2015.
- Siegfried Hauptmann: Organische Chemie, Verlag Harry Deutsch, 1985, Seite 476, ISBN 3-87144-902-4.
- Leonor Michaelis. 1875–1949 (PDF; 2,4 MB). A Biographical Memoir by L. Michaelis, D. A. MacInnes, S. Granick J., National Academy of Sciences.
- W. Bergfeld, D. Belsito, J. Marks, Jr., F. Andersen: Safety of ingredients used in cosmetics, In: Journal of the American Academy of Dermatology. 2005; 52: 125–132.
- S. Köpper, K. Lindner, J. Martens: Die Anlagerung von Mercaptocarbonsäuren an 3-Thiazoline und anschließende Lactamisierung, Tetrahedron 48 (1992) 10277–10292.

