Milchsäure
Milchsäure (lat. acidum lacticum) ist eine Hydroxycarbonsäure, enthält somit sowohl eine Carboxygruppe als auch eine Hydroxygruppe. Sie wird deswegen auch als 2-Hydroxypropionsäure bezeichnet, nach den Nomenklaturempfehlungen der IUPAC ist jedoch die Bezeichnung 2-Hydroxypropansäure zu verwenden. Die Salze und Ester der Milchsäure heißen Lactate.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
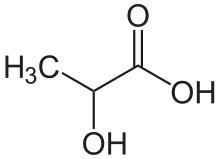 | ||||||||||||||||||||||
| Strukturformel ohne Angabe der Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Milchsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C3H6O3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, fast geruchlose, ölige Flüssigkeit (Racemat)[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
G01AD01 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 90,08 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig (Racemat) | |||||||||||||||||||||
| Dichte |
1,21 g·cm−3 (Racemat)[3] | |||||||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
3,90 (25 °C, Racemat)[4] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,4392 (20 °C; Racemat)[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Geschichte
Milchsäure wurde historisch sowohl in Europa wie auch in Asien zur Säuerung und Konservierung von Lebensmitteln, insbesondere für Milch (Sauermilch), Gemüse (z. B. Sauerkraut) und auch zur Herstellung von Silagen als Futtermittel bereits seit Jahrhunderten oder Jahrtausenden genutzt.
Die erste Entdeckung und Isolierung der Milchsäure geht auf den deutsch-schwedischen Chemiker Carl Wilhelm Scheele im Jahr 1780 zurück, der sie aus saurer Milch in Form eines braunen Sirups isolierte.[8] Die Fleischmilchsäure [L-(+)-Milchsäure] wurde von Jöns Jakob Berzelius im Jahr 1808 entdeckt und ihre Struktur 1873 von Johannes Wislicenus aufgeklärt. Henri Braconnot, ein französischer Chemiker, fand im Jahre 1813 heraus, dass Milchsäure in einem Fermentationsprozess hergestellt werden kann.[8] 1856 entdeckte Louis Pasteur die Milchsäurebakterien und entwickelte das Grundverständnis für die Milchsäuregärung. Die großtechnische Produktion von Milchsäure begann 1881 in den USA,[8] und 1895 machte auch Boehringer Ingelheim die Entdeckung, wie Milchsäure mit Hilfe von Bakterien in großen Mengen hergestellt werden konnte.
Eigenschaften
Milchsäure ist in Form von Lactat ein wichtiges Zwischenprodukt im Stoffwechsel, zum Beispiel als Produkt beim Abbau von Zuckern durch die Milchsäuregärung. Weltweit werden jährlich etwa 250.000 Tonnen (Stand 2010) Milchsäure industriell produziert,[9] die vor allem in der Lebensmittelindustrie sowie zur Herstellung von Polylactiden (PLA; auch: Polymilchsäuren) genutzt werden.
Der spezifische Drehwinkel beträgt für D-Milchsäure bei 20 °C [α]D20 = −2,6 (H2O) und für L-Milchsäure [α]D20 = +2,6 (H2O). Bei 15 °C wird für L-Milchsäure ein Drehwinkel [α]D15 = +3,82 (H2O)[4] gemessen.
Milchsäure bildet intermolekular Ester. Unter Abspaltung von Wasser entsteht als Dimer Lactoylmilchsäure, die beim längeren Stehen oder beim Erhitzen zu Polymilchsäure weiterverestert. Diese Makromoleküle erreichen jedoch keine relevanten Kettenlängen, um das Produkt technisch verwerten zu können.
In wässriger Milchsäurelösung liegt ein chemisches Gleichgewicht zwischen Milchsäure und ihren durch intermolekulare Wasserabspaltung entstehenden Polyester (Estoliden) vor. In 90%iger Milchsäurelösung findet man etwa 70 % als freie Säure und 20 % als ihre Estolide vor. Aus zwei Milchsäuremolekülen entstehen unter Ringschluss und Abspaltung von zwei Wassermolekülen Dilactid mit einem sechsgliedrigen Ring (Dilacton). Diese Verbindung wird in wässriger Milchsäurelösung jedoch nicht beobachtet. Aus Dilactiden lassen sich mittels Ringöffnungspolymerisation hochwertige Polyester erzeugen. Der entstehende Kunststoff ist biologisch abbaubar und zudem immunologisch neutral.
Isomerie
Aufgrund ihrer unterschiedlichen optischen Aktivität wird die D-(−)-Milchsäure (Syn.: (R)-Milchsäure) auch als linksdrehende Milchsäure und die L-(+)-Milchsäure (Syn.: (S)-Milchsäure) auch als rechtsdrehende Milchsäure bezeichnet.[10] Racemische Milchsäure ist ein 1:1-Gemisch aus (R)- und (S)-Milchsäure. ‚L‘ steht für lateinisch laevus = „links liegend“, ‚D‘ für lateinisch dexter = „rechts“.
| Isomere von Milchsäure | ||
| Name | L-Milchsäure | D-Milchsäure |
| Andere Namen | (S)-Milchsäure (+)-Milchsäure Fleischmilchsäure | (R)-Milchsäure (−)-Milchsäure |
| Strukturformel | 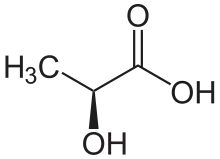 | 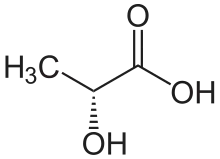 |
| CAS-Nummer | 79-33-4 | 10326-41-7 |
| 50-21-5 (unspez.) | ||
| EG-Nummer | 201-196-2 | 233-713-2 |
| 200-018-0 (unspez.) | ||
| ECHA-Infocard | 100.001.088 | 100.030.636 |
| 100.000.017 (unspez.) | ||
| PubChem | 107689 | 61503 |
| 612 (unspez.) | ||
| Wikidata | Q27080955 | Q27077083 |
| Q161249 (unspez.) | ||
Vorkommen

L-(+)-Milchsäure kommt in Schweiß, Blut, Speichel sowie im Muskelserum, in der Niere und Galle vor. Das Racemat, eine 1:1-Mischung aus D- und L-Milchsäure, findet sich z. B. in Sauermilch- und Molkeprodukten, Tomatensaft und Bier. Bei allen Produkten, die per Milchsäuregärung haltbar gemacht werden, ist der Anteil der beiden Enantiomeren abhängig vom verwendeten Bakterienstamm und den Reaktionsbedingungen.
Auch Pilze erzeugen Milchsäure, z. B. Vertreter der Gattungen Rhizopodus, Allomyces und Blastocladiella.[11]
Herstellung
Die Herstellung von Milchsäure kann sowohl biotechnologisch über eine Fermentation von Kohlenhydraten (Zucker, Stärke) wie auch synthetisch auf der Basis petrochemischer Rohstoffe (Acetaldehyd) erfolgen.
Fermentative Herstellung
Etwa 70 bis 90 % der Weltproduktion an Milchsäure wird derzeit fermentativ hergestellt,[12] wobei beide reinen Enantiomere kommerziell durch Fermentationsverfahren mit Milchsäurebakterien in signifikanten Mengen produziert werden.[13] In der Regel wird stammspezifisch nur eines der Stereoisomere gebildet, allerdings kann es durch das Enzym Lactat-Racemase auch zu anderen Mischungsverhältnissen kommen.[14]
Industriell erfolgt die Herstellung von Sauermilchprodukten durch Vergärung von Milch oder Molke vor allem durch die Lactobacillus-Arten Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus delbrueckii subsp. bulgaricus (Lactobacillus bulgaricus) und Lactobacillus helveticus, weiterhin durch Streptococcus salivarius subsp. thermophilus (Streptococcus thermophilus) und Lactococcus lactis.[15] Für industriell genutzte Milchsäure werden Zuckerdicksaft oder Stärkehydrolysate und Lactobacillus delbrueckii sowie Pentose-haltige Sulfitablaugen und Lactobacillus pentosus verwendet.[16] Die Bakterienstämme werden nach ihrer Eigenart eingeteilt, Glucose nur zu Lactat oder auch zu anderen Produkten zu vergären: homofermentative Arten, wie Lactobacillus casei und Lactococcus lactis, bilden pro Mol Glucose zwei Mol Lactat, während heterofermentative Arten, wie Leuconostoc mesenteroides und Lactobacillus brevis, neben einem Mol Lactat pro Mol Glucose auch Essigsäure, Kohlenstoffdioxid und Ethanol produzieren.[17]
Ein Vorteil der fermentativen Herstellung ist, dass sie – anders als die synthetische Herstellung – stereospezifisch ist. So kann mit bestimmten Stämmen gezielt das L-Isomer hergestellt werden, welches für moderne Anwendungen gefragter ist.[14]
Synthetische Herstellung
Synthetisch wird Milchsäure durch Anlagerung von Cyanwasserstoff (Blausäure, HCN) an Acetaldehyd zu Acetaldehydcyanhydrin (Milchsäurenitril, Lactonitril) hergestellt. Das Nitril wird dann mit Salzsäure zu Milchsäure und Ammoniumchlorid hydrolysiert. Dieser Syntheseweg wird von dem japanischen Unternehmen Musashino als letztem Großproduzenten für synthetische Milchsäure realisiert.[8]
Verwendung
Ernährung, Futter- und Genussmittel

Eine Reihe von Lebensmitteln werden direkt durch Milchsäuregärung hergestellt. Darunter fallen vor allem die Sauermilchprodukte wie Sauermilch, Joghurt, Kefir und Buttermilch. Diese werden durch Infektion von pasteurisierter Milch mit Starterkulturen der Milchsäurebakterien hergestellt. Weitere Produkte sind lactofermentierte Gemüse wie Sauerkraut, rote Bete in einigen Borschtsch-Varianten oder Kimchi sowie Sauerteig und entsprechend Sauerteigprodukte. Auch Silagen, durch Vergärung haltbar gemachte Frischfuttermittel, basieren auf der Milchsäuregärung.[17]
Als Lebensmittelzusatzstoff trägt Milchsäure die Bezeichnung E 270. Sie wird in der Lebens- und Genussmittelindustrie vielfältig als Säuerungsmittel eingesetzt, so etwa in Backwaren, Süßwaren und vereinzelt auch in Limonaden. Durch die Änderung des pH-Wertes in den Lebensmitteln auf einen pH von etwa 4 kommt es zu einer Konservierung der Lebensmittel, da eine Besiedlung mit anderen Mikroorganismen weitgehend ausgeschlossen wird.[17]
Bierbrauer schätzen Milchsäure beim Brauwasser als pH-senkend. Dies ist besonders der Fall bei hellen Bieren, bei denen das Malz weniger säuernde Eigenschaften hat. Hier wird oft mit Milchsäurebakterien behandeltes Sauermalz eingesetzt, um dem Reinheitsgebot zu entsprechen. Auch darf die Maische und die Bierwürze mit Milchsäurebakterien direkt angereichert werden. Biologisch hergestellte Milchsäure ist also zulässig, technisch erzeugte dagegen nicht.[18] Die Einhaltung des deutschen Reinheitsgebotes erfordert deshalb zusätzlichen Herstellungsaufwand zur Fermentation.[19]
In Form der Salze Calciumlactat oder Calciumlactatgluconat kann sie zudem zur Calciumanreicherung zugesetzt werden.
Stoffliche Nutzung
Milchsäure ist das Monomer der Polylactide bzw. Polymilchsäuren (PLA), die als biologisch abbaubare und bio-basierte Kunststoffe vielfältige Verwendung finden.
Milchsäure wirkt antibakteriell und wird deshalb Flüssigseifen, Reinigern und Geschirrspülmitteln zugegeben. Die Desinfektionswirkung entfaltet sie optimal bei einem pH-Wert von 3 bis 4.[20] Sie wurde und wird auch als Mittel zur Schwangerschaftsverhütung eingesetzt.[21]
Milchsäure wird als Kalklöser in der Gerberei zum Entkalken von Häuten verwendet. Auch in der Textilindustrie und der Druckerei wird sie hierzu eingesetzt. Manche Reinigungstabs für Kaffeemaschinen, Trinkwassersprudler und ähnliche Geräte enthalten Milchsäure als Kalklöser.
Imker nutzen Milchsäure zur Behandlung von Bienen gegen die Varroamilbe, wobei darauf zu achten ist, dass die behandelten Bienenstöcke bzw. Waben brutfrei sind.[22] Arachnologen verwenden Milchsäure, um die präparierte Epigyne von Spinnenweibchen oder andere Chitinstrukturen aufzuhellen und um Gewebereste aufzulösen.
Die Pharmazeutische Technologie nutzt Milchsäure, um wasserunlösliche Arzneistoffe in Salze der Milchsäure (Lactate) umzuwandeln; diese sind besser wasserlöslich (Beispiel: Ciprofloxacin).[23]
In der Kosmetik wird Milchsäure in Hautcremes und anderen Produkten zur Behandlung von Akne genutzt.
Physiologie
Bei starker Betätigung der Skelettmuskulatur kann es zum Anstieg des Blut-Lactatgehaltes von 5 mg/dl auf 100 mg/dl kommen. Die Ursache ist, dass bei anaeroben Bedingungen, wie beispielsweise bei schneller Betätigung der Skelettmuskulatur, Energie in Form von NAD+ aus der Reduktion von Pyruvat mittels der Lactatdehydrogenase für die Fortführung der Glykolyse gewonnen werden muss. Die dabei anfallende Milchsäure (Lactat und H+) wird über den Monocarboxylat-Transporter 1 aus den Zellen geschwemmt. Dieser Vorgang wurde früher als Ursache des Muskelkaters verstanden, jedoch wird diese Theorie heute größtenteils als falsch betrachtet.
Für den Menschen ist die rechtsdrehende L-(+)-Milchsäure die physiologische. Oral eingenommen wird sie im Organismus schneller abgebaut als die linksdrehende D-(−)-Milchsäure.[24]
Weblinks
- Kathrin Einschütz: Wirksamkeitsprüfung verschiedener Verfahren zur Verminderung der Keimbelastung auf Handgeräten der Fleischgewinnung. Dissertation. FU Berlin, 2004 urn:nbn:de:kobv:188-2004002043 (Antibakterielle und konservierende Eigenschaften der Milchsäure)
Einzelnachweise
- Eintrag zu E 270: Lactic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu LACTIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- Eintrag zu Milchsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Eintrag zu Milchsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. März 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-318.
- Eintrag zu L-(+)-lactic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Januar 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Lactic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Surinder P. Chahal, John N. Starr: Lactic Acids. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012, doi:10.1002/14356007.a15_097.pub2.
- Wim Soetart, Erick J. Vandamme (Hrsg.): The Scope and Impact of Industrial Biotechnology. In: Industrial Biotechnology. Sustainable Growth and Economic Success. Wiley-VCH, Weinheim 2010, ISBN 978-3-527-31442-3, S. 9 (englisch).
- Werner Eisner et al.: Elemente Chemie II Gesamtband. Ernst Klett Verlag, Stuttgart 2000, ISBN 3-12-756700-6, S. 343.
- Hans G. Schlegel: Allgemeine Mikrobiologie. 8. Auflage. Thieme, 2008.
- Hans-Josef Endres, Andrea Siebert-Raths: Technische Biopolymere. Hanser-Verlag, München 2009, ISBN 978-3-446-41683-3, S. 103.
- J. Crosby: Chirality in Industry – An Overview. In: A. N. Collins, G. N. Sheldrake, J. Crosby (Hrsg.): Chirality in Industry. Wiley, Heidelberg 1992, ISBN 0-471-93595-6, S. 10.
- Christoph Syldatk und Rudolf Hausmann: Organische Säuren. In: Hermann Sahm, Garabed Antranikian, Klaus-Peter Stahmann & Ralf Takors (Hrsg.): Industrielle Mikrobiologie. Springer Spektrum, Berlin, Heidelberg 2013, ISBN 978-3-8274-3039-7, Kap. 5, S. 92–107, doi:10.1007/978-3-8274-3040-3.
- Hans G. Schlegel, Christiane Zaborosch: Allgemeine Mikrobiologie. 7. Auflage. Thieme Verlag, Stuttgart/New York 1992, ISBN 3-13-444607-3, S. 296–304.
- Christoph Syldatk: Organische Säuren. Essigsäure (Acetat). In: Garabed Antranikian: Angewandte Mikrobiologie. Springer-Verlag, Berlin / Heidelberg 2006, ISBN 3-540-24083-7, S. 344–347.
- Rolf D. Schmid: Taschenatlas der Biotechnologie und Gentechnik. 2. Auflage. Wiley-VCH, Weinheim 2006, ISBN 3-527-31310-9, S. 12–13.
- Der Umgang mit den Grundzutaten. Abgerufen am 17. November 2020.
- Universität Hohenheim: PM Detailansicht: Universität Hohenheim. Abgerufen am 17. November 2020.
- Kathrin Einschütz: Wirksamkeitsprüfung verschiedener Verfahren zur Verminderung der Keimbelastung auf Handgeräten der Fleischgewinnung. Dissertation. FU Berlin, 2004 urn:nbn:de:kobv:188-2004002043.
- Magnus Hirschfeld: Geschlechtskunde. Band 2, 1930, S. 454f.
- Gebrauchsinformation Milchsäure 15 % ad us. vet. Serumwerk Bernburg AG, Stand: 14. Januar 2009.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dietmar Reichert: Pharmaceutical Substances. 4. Auflage. 2 Bände. Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2, S. 482–484 (seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen).
- Dieter Thierbach: Rätsel des Alltags – Was ist rechtsdrehende Milchsäure?
