Gaschromatographie
Die Gas-Flüssigkeits-Chromatographie (GLC) oder einfach Gaschromatographie (GC) ist sowohl eine Adsorptions- als auch eine Verteilungschromatographie, die als Analysenmethode zum Auftrennen von Gemischen in einzelne chemische Verbindungen weite Verwendung findet. Die GC ist nur anwendbar für Komponenten, die gasförmig oder unzersetzt verdampfbar sind (Siedebereich bis 400 °C). Bei dieser Art der Chromatographie wird als mobile Phase ein Inertgas wie Stickstoff oder Helium verwendet, in besonderen Fällen auch Wasserstoff. Das Trägergas wird durch eine gewickelt gebogene, kapillarartige Röhre gedrückt, die sogenannte Säule, welche meist eine Länge von 10–200 Meter besitzt.
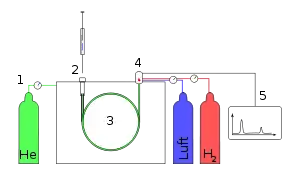
Diese Trennsäule besteht entweder aus Metall (bei älteren Modellen), heute aber überwiegend aus Quarzglas, das zur Erhöhung der Bruchsicherheit beschichtet ist. Sie ist innen mit einer definierten stationären Phase ausgekleidet (häufig mit zähflüssigen Polyorganosiloxanen) und befindet sich in einem temperierbaren Ofen.
Nach Eingabe einer Probesubstanz, die nun vom Trägergas transportiert wird, verweilen die Komponenten je nach Polarität und Dampfdruck der einzelnen Gasmoleküle unterschiedlich lange an der stationären Phase der Säule. Ein Detektor misst den Austrittszeitpunkt am Säulenende; mit einem am Detektor angebrachten Schreiber kann dieser Zeitpunkt und die Menge der Substanz grafisch dargestellt und mit Standardsubstanzen verglichen werden. Damit ist eine sehr schnelle und leichte qualitative und quantitative Bestimmung auch sehr komplexer Stoffgemische möglich. Im Unterschied zur Hochleistungsflüssigkeitschromatographie (HPLC) sind nur ausreichend flüchtige Substanzen nachweisbar.
Technikgeschichte


Die Entwicklung der Gaschromatographie wurde durch grundlegende Arbeiten von Archer J. P. Martin, Erika Cremer und Fritz Prior geprägt. Das erste Gaschromatogramm der Geschichte entstand kurz nach dem Zweiten Weltkrieg und stammt aus dem Labor von Erika Cremer. Es zeigt die Trennung von Luft und Kohlendioxid an Aktivkohle.[1] 1951 wurde ein erster Gaschromatograph im heutigen Sinne von Anthony Trafford James und Archer J. P. Martin entwickelt. Ihre erste publizierte Arbeit 1952[2] zeigte die GC-Trennung von Carbonsäuren. Die Entwicklung des Elektroneneinfangdetektors (ECD) 1957 durch James E. Lovelock[3][4] ermöglichte es, chlorierte Umweltgifte wie PCB und chlorierte Pestizide wie DDT durch GC empfindlich nachzuweisen. In den Folgejahren entstand eine Reihe von Firmen, die kommerzielle Gaschromatographen anboten wie die F&M Scientific Corporation of Avondale, Pennsylvania, die 1965 von Hewlett-Packard übernommen wurde. In den 1970er Jahren erfolgte die Entwicklung der Kapillargaschromatographie, ein Meilenstein war dabei die Erfindung der "Fused Silica Column" durch Raymond D. Dandenau und Ernest Zerrender.[5] Es folgten bald darauf die ersten praxistauglichen Kopplungen zwischen Kapillargaschromatographie und Massenspektrometrie (GC-MS). Heute ist die Gaschromatographie eine der wichtigsten Analysentechniken in chemischen Labors.[6][7]
Messprinzip
Die chromatographische Auftrennung eines Stoffgemisches in einem Gaschromatographen erfolgt bei einer unpolaren Trägersäule im einfachsten Falle ausschließlich aufgrund der unterschiedlichen Siedepunkte der Einzelsubstanzen in dem Gemisch, wobei keine spezielle Wechselwirkung mit der stationären Phase erfolgt, sondern „nur“ eine zehntausendfach wiederholte Adsorption- und Desorption. Bei polaren Trennsäulen werden aber Alkohole, Ester, Ketone mit gleichen Siedepunkten wie ähnliche Paraffine stärker festgehalten. Die spezielle Wechselwirkung – genauer das Gleichgewicht zwischen der Gasphase und der stationären Phase – ist als Raoultsches Gesetz bekannt. Je höher der Partialdampfdruck einer Substanz nach dem Raoultschen Gesetz, d. h., je länger sich die Substanz in der Gasphase befindet, desto kürzer wird die Retentionszeit.
Die Stärke der Wechselwirkungen, zwischen den Probenkomponenten und der stationären Phase, wird sowohl von deren Struktur als auch von deren funktionellen Gruppen bestimmt. Dabei treten bei unpolaren Substanzen ausschließlich Dispersionswechselwirkungen (Van-der-Waals-Bindungen) auf, während polare Trennphasen auch polare Wechselwirkungen eingehen können, z. B. Wasserstoffbrückenbindungen oder Donator-Akzeptor-Bindungen. Letztere trennen nach dem Prinzip: Gegensätze ziehen sich an. Das bedeutet, dass Trennphasen, die z. B. Wasserstoff zur Wasserstoffbrückenbindung aufzunehmen in der Lage sind, Substanzen trennen, die Wasserstoff zur Brückenbindung bereitstellen können (z. B. Alkohole). Auch können zum Beispiel Enantiomere, welche sich in ihren Siedepunkten nicht unterscheiden und somit gleiche Retentionszeiten aufweisen würden, durch ihre verschieden starken Wechselwirkungen mit speziellen Derivaten von Cyclodextrinen aufgetrennt werden.
Eine Grundbedingung für die Gaschromatographie ist, dass sich der Stoff, den man untersuchen möchte, unzersetzt verdampfen lässt – sofern er nicht schon gasförmig vorliegt. Mittels Derivatisierung lassen sich der GC ansonsten schwer zugängliche Analyten wie Alkohole, Amine, Fettsäuren oder Zucker soweit thermisch stabilisieren, dass sie ohne Schwierigkeiten auf handelsüblichen Phasen aufgetrennt werden können. Mögliche Derivate sind bei Carbonsäuren die Methylester (Umwandlung mit BF3 und MeOH), bei Alkoholen die Silylether.

Wichtige Geräteteile
Ein Gaschromatograph besteht aus drei wesentlichen Bauteilen: Injektor, Trennsäule im GC-Ofen und Detektor. Im Injektor wird die Probe, gelöst in einem niedrig siedenden Lösemittel, durch eine Durchstichmembran (Septum) eingespritzt. Dieser Injektor wird in der Regel beheizt (bis zu 450 °C), um eine rasche und vollständige Verdampfung der Probe zu erreichen. Möglich ist auch die septumfreie Aufgabe und langsame Verdampfung mittels eines Kaltaufgabesystems (KAS/PTV). Die Substanzen werden durch das Trägergas (Säulenvordruck normalerweise bis zu 6 bar) in die Trennsäule (Kapillare) transportiert, welche in den so genannten GC-Ofen eingebaut ist. Dieser dient dazu, die Trennsäule präzise zu temperieren, um so durch konstante Temperatur (isotherm) oder durch eine kontrollierte Temperaturerhöhung eine ebenso schnelle wie weitgehende Trennung des Stoffgemisches zu erreichen.
Am Ende der Säule folgt der Detektor, der ein elektronisches Signal erzeugt, wenn eine Substanz das Trennsystem verlässt. Das elektronische Signal kann als Peak (engl. Gipfel) auf dem Schreiber registriert werden. Die Signale werden dann an einem Integrator oder heute meist an einem Computersystem mit entsprechender Auswertungssoftware verarbeitet. Die Dauer für die Trennung eines Stoffgemisches mit der Darstellung der verschiedenen Peaks zu einem Chromatogramm beträgt häufig zwischen 30 und 60 Minuten.
Injektoren
Der Injektor dient der Aufgabe des zu untersuchenden Stoffgemisches auf die Trennsäule. Gängige Injektoren / Methoden sind:
- Split/Splitless-Injektoren (SSL)
- On-Column-Injektionen (OCI) mit Direktaufgabe auf die Säule
- Kaltaufgabesysteme (je nach Hersteller KAS oder PTV)
- Direktaufgabesysteme mittels Ventilschaltungen
Für gepackte Säulen beträgt die optimale Menge der Probe je Komponente zwischen 0,1 und 1 μl, für Kapillarsäulen sollte die optimale Probemenge um den Faktor 100 bis 1000 kleiner sein. Zur Injektion einer Probe, die man auch durch ein Lösungsmittel noch verdünnen kann, gibt es spezielle 1–10 μl Spritzen. Wichtig für die Injektion ist, dass sich keine Luft (-blasen) in der Spritze befindet, diese würde nämlich zu einer Oxidation der Substanzen im Ofenraum beitragen.
Gerade mit Split/Splittless-Injektoren und Kaltaufgabesystemen werden häufig sogenannte Autosampler eingesetzt, die die sequentielle Abarbeitung einer Vielzahl an Proben erlauben. Daneben werden u. a. auch Headspace-Probengeber, Purge&Trap-Systeme und Pyrolysatoren zur Probenaufgabe verwendet. Eine recht neue Entwicklung ist der Einsatz von Festphasenmikroextraktion (SPME) oder Stir Bar Sorptive Extraction (SBSE).
Verwendete Trennsäulen
Wichtige Kenngrößen der Trennsäulen sind:
- der Säulendurchmesser
- die Säulenlänge
- und der Typ der stationären Phase (Belegung).
Früher wurden meist gepackte Säulen eingesetzt. Bei ihnen befindet sich im Inneren eines dünnen (< 1 cm) Metall- oder Glasrohres von wenigen Metern Länge, der sogenannten Säule, ein festes, inertes Trägermaterial. Wird das Gas mit der zu analysierenden Substanz direkt über das Trägermaterial geleitet, so spricht man von einer GSC („Gas-Solid-Chromatography“). Ist die Trägersubstanz zudem mit einer dünnen Schicht einer hochmolekularen, zähflüssigen und wenig flüchtigen Flüssigkeit überzogen, so handelt es sich um eine GLC („Gas-Liquid-Chromatography“). Diese Flüssigkeit übernimmt hier die Funktion der eigentlichen stationären Phase. Das bevorzugt verwendete Inertgas ist hier Stickstoff.
In den letzten Jahrzehnten wird überwiegend mit der von Marcel J. E. Golay 1958 entwickelten Kapillargaschromatographie gearbeitet. Der Vorteil besteht in der ca. 100–1000 fach besseren Auftrennung, (einer Trennstufenzahl von ca. 300.000) von Stoffen verglichen mit gepackten Säulen, so dass sich auch die Analysezeit verkürzen lässt. Dabei haben die zur Stabilisierung außen mit Polyimid beschichteten Quarzglas-Trennsäulen normalerweise einen Innendurchmesser von 0,1 bis 0,5 mm und eine Länge von 10 bis 60 m. Zur Auftrennung von Fettsäureestern werden sogar kombinierte Säulen bis 100 m verwendet. Die stationäre Phase kleidet die Kapillare dabei nur als dünner Film mit in der Regel 0,1 bis 5 µm aus. Der Vorteil besteht in der drastisch besseren Auftrennung ähnlicher Stoffe, verglichen mit gepackten Säulen. Der Trend in der GC geht momentan zu immer dünneren und kürzeren Säulen, weil dadurch der Zeitaufwand für Analysen deutlich gesenkt werden kann. Das bevorzugt verwendete Inertgas ist Helium, aber auch Wasserstoff oder seltener Stickstoff werden verwendet.
Ein wichtiges Kriterium zur Klassifizierung der stationären Phase ist die Polarität ihrer Belegung. Analyten auf unpolaren Säulen (Typ DB-1 o. ä.) eluieren meist nach ihren Siedepunkten. Polare Verbindungen treten bei polaren Säulen dagegen selektiv mit den polaren stationären Phasen in Wechselwirkung und werden entsprechend ihrer Polarität länger zurückgehalten und eluieren später als vergleichbare unpolare Verbindungen wie z. B. Alkane. Bei der Verwendung von Säulen unterschiedlicher Hersteller ist zu beachten, dass identische stationäre Trennphasen mit den unterschiedlichsten Bezeichnungen versehen werden. Der folgenden Liste gängiger stationäre Trennphasen ist zu entnehmen, welche Trennsäulen unterschiedlicher Hersteller hinsichtlich Zusammensetzung der Belegung der Trennsäulen vergleichbar sind.
| Zusammensetzung der Belegung der Trennsäule | Herstellerbezeichnung | Temperaturbereich | Polarität |
|---|---|---|---|
| Polydimethylsiloxan 100 % Methyl | DB-1, SB-1, BP-1, CP-Sil 5 CB, OV–1, OV–101, PB-1, SPB-1, RTX-1, PE-1, Ultra 1, ZB-1, AT-1, SE-30 | −50 °C bis +350 °C | unpolar |
| Polyphenylmethylsiloxan 5 % Phenyl, 95 % Dimethyl | DB-5, SB-5, BP-5, CP-Sil 8 CB, PVMS-5, PB-2, SPB-5, Rtx-5, PE-2, Ultra 2, ZB-5, AT-5, SE-54, Optima-5, RSL-200 | −20 °C bis +350 °C | leicht polar |
| Polyphenylmethylsiloxan 14 % Phenyl, 86 % Dimethyl | DB-624, SB-624, CP-Sil 13 CB, VOCOL, Rtx-Volatiles, PE-502, AT-62 | ±0 °C bis +250 °C | mittelpolar |
| Polycyanopropylphenylmethylsiloxan 6 % Cyanopropylphenyl, 94 % Dimethyl | DB-1301, SB-1301, Rtx-1301, AT-1301 | ±0 °C bis +230 °C | polar |
| Polyphenylmethylcyanosiloxan 6 % Phenyl, 6 % Cyano, 88 % Methyl | DB-1701, SB-1701, BP-10, CP-Sil 19 CB, PB-1701, SPB-7, Rtx-1701, PE-1701, PAS-1701, AT-1701, RSL-300 | −50 °C bis +225 °C | polar |
| Polyethylenglycol | DB-WAX, SB-Wax, BP-20, CP-Wax 52 CB, Supelcowax-10, Stabilwax, PE-CW, HP-20M, AT-Wax | ±0 °C bis +220 °C | polar |
| Polyethylenglykol-2-nitroterephthalsäureester | OPTIMA FFAP, DB-FFAP, HP-FFAP, CP-Sil 58 CB, 007-FFAP, CP-FFAP, Nukol | ±0 °C bis +250/260 °C | polar |
Seit Beginn der 1990er Jahre wurden von den Säulenherstellern große Anstrengungen unternommen, blutungsarme Säulen zu entwickeln, die vor allem in der GC-MS eingesetzt werden. Diese sind häufig an der Zusatzbezeichnung "-ms" zu erkennen.[8]
Trennsäulen, die mit einer chiralen stationären Phase belegt sind, können für die Enantiomerenanalytik benutzt werden. Dies erlaubt die Bestimmung des Enantiomerenverhältnisses in Enantiomerengemischen und die Analyse der Enantiomerenreinheit vermeintlich reiner Enantiomerer.
Detektoren


Folgende Detektoren werden eingesetzt:
- Flammenionisationsdetektor (FID), allgemein für die Quantifizierung organischer Verbindungen, ist der am meisten verbreitete Detektor in der Gaschromatographie
- Wärmeleitfähigkeitsdetektor (WLD o. engl. TCD), für Permanentgase
- Photoionisationsdetektor (PID)
- Flammenphotometrischer Detektor (FPD), elementspezifisch
- Stickstoff-Phosphor-Detektor (engl. NPD, auch Thermionischer Detektor, TID), Stickstoff-Phosphor-spezifisch
- Elektroneneinfangdetektor (ECD), für halogenierte organische Verbindungen
- Pulsed charge detector (engl. PD), ebenfalls für halogenierte organische Verbindungen
- Atomemissionsdetektor (AED), elementspezifisch
- Echelle-Plasma-Emissions-Detektor (EPED), elementspezifisch
- Massenspektrometer, massenselektiver Detektor (MS oder MSD)
- Ionen-Mobilitäts-Spektrometer (IMS) für flüchtige organische Verbindungen
- Geruchsdetektor (menschliche Nase)
Teilweise werden für spezielle Fragestellungen auch zwei (oder mehrere) Detektoren hintereinander geschaltet (Tandem-Prinzip). Grundvoraussetzung dafür ist aber, dass die vorderen Detektoren die Messung nicht zerstörend durchführen (also z. B. ein ECD/WLD, aber kein FID/NPD).
Die elektronischen Signale des Detektors werden in Abhängigkeit von der Zeit seit der Injektion (Retentionszeit) als 2D-Graph, dem sogenannten Chromatogramm, dargestellt. Dies geschieht in der Regel mithilfe von elektronischen Auswerteeinheiten (Computer mit Chromatographiedatensystem), selten nur noch mit Plottern.
Anwendung in der Analytik

Die Gaschromatographie ist eine sehr empfindliche Methode zur Analyse von Stoffgemischen. Es lassen sich selbst minimale Substanzmengen (10−9 Gramm) nachweisen. Man kann mit ihr komplexe Stoffgemische in die einzelnen Komponenten auftrennen. In vielen Fällen reicht allein die Zeit, die eine Substanz vom Zeitpunkt der Einspritzung bis zum Passieren des Detektors benötigt, die Retentionszeit, um eine Substanz zu identifizieren. Durch Kombination mit einem Massenspektrometer, die sogenannte GC/MS-Kopplung, können sehr geringe Substanzmengen nachgewiesen werden, und gleichzeitig Strukturaufklärung betrieben werden.
Anwendung findet die Gaschromatographie in der Analytik von Agrarprodukten auf Herbizide, Fleischprodukte auf Hormone, der Untersuchung von Arzneimittel, von Aromen und ätherischen Ölen, von Kohlenhydraten, von Erdölkomponenten und in der forensischen Chemie, bei Dopingtests, bei Luft- und Meerwasseruntersuchungen in der Umweltanalytik. Auch hochmolekulare Substanzen, wie Triglyceride und Wachse[9] lassen sich auf temperaturstabilen stationären Siliconphasen trennen, identifizieren und quantitativ bestimmen. Schwer flüchtige Analyten müssen vor der Analyse eventuell erst derivatisiert also in leichter flüchtige Substanzen umgewandelt werden. Dieses kann z. B. mit Trimethylsulfoniumhydroxid oder Chlortrimethylsilan geschehen, indem polare Gruppen in unpolare methylierte Gruppen umgewandelt werden.
Verwendung in der quantitativen Analyse
Die Größe der vom Detektor angezeigten Flächeneinheiten steht in den seltensten Fällen in direktem Verhältnis zu den tatsächlichen Massenanteilen in der zu analysierenden Probe. Das macht eine Kalibrierung mit Referenzmaterialien definierten Gehalts notwendig. Um (zufällige) Fehler des Gaschromatographen (vor allem des Injektionssystems) auszuschließen, werden gerade in der Gaschromatographie gerne interne Standards eingesetzt. Als interner Standard dient hier eine zusätzliche Substanz, dessen Retentionszeit in der Nähe der zu bestimmenden Analyten liegt, aber diese nicht überlagert. Sie wird dem Analyt und dem Referenzmaterial bzw. den daraus hergestellten Lösungen zugesetzt. Nach der Messung werden jeweils die Peakflächen von Analyt und Referenzmaterial zu der Peakfläche des internen Standards ins Verhältnis gesetzt und damit die Fehler des Injektionssystems so weit wie möglich herausgerechnet. Nach erfolgter Kalibrierung kann die Konzentration cP einer Probe P mithilfe der folgenden Gleichung ermittelt werden.
cS ist die eingewogene Konzentration an Standard, A bezeichnet die Fläche des Peaks im Chromatogramm und r bezeichnet die Sensitivität einer Substanz (wie viel Signal zeigt der Detektor an pro M). r kann für einen spezifischen Detektor einmalig gemessen und dann tabelliert werden.
Literatur
- Ernst Bartholomé u. a. (Hrsg.): Ullmanns Encyklopädie der technischen Chemie. Band 5: Hans Kelker (Hrsg.): Analysen- und Meßverfahren. 4., neubearbeitete und erweiterte Auflage. Verlag Chemie, Weinheim u. a. 1980, ISBN 3-527-20005-3, S. 118 ff.
- Eberhardt Leibnitz, Hans Georg Struppe (Hrsg.): Handbuch der Gaschromatographie. 3., überarbeitete und stark erweiterte Auflage. Akademische Verlagsgesellschaft Geest & Portig KG, Leipzig 1984, ISBN 3-89141-001-8.
- Gerhard Schomburg: Gaschromatographie. Grundlagen, Praxis, Kapillartechnik. 2., bearbeitete und erweiterte Auflage. VCH, Weinheim u. a. 1987, ISBN 3-527-26461-2.
- Reiner Wittkowski, Reinhard Matissek (Hrsg.): Capillary Gas Chromatography in Food Control and Research, B. Behr's Verlag GmbH & Co., Hamburg 1992, ISBN 3-86022-037-3.
- Peter J. Baugh (Hrsg.): Gaschromatographie. Eine anwenderorientierte Darstellung. Vieweg, Braunschweig u. a. 1997, ISBN 3-540-67009-2.
- Walter David, Burkhard Kusserow: GC-Tips. Problemlösungen rund um den Gaschromatographen. Hoppenstedt, Darmstadt 1999, ISBN 3-8203-0469-X.
- Bruno Kolb: Gaschromatographie in Bildern. Wiley-VCH, Weinheim u. a. 1999, ISBN 3-527-29880-0.
- Keith D. Bartle, Peter Myers: History of gas chromatography. In: Trends in Analytical Chemistry. Bd. 21, Nr. 9/10, 10. September 2002, S. 547–557, doi:10.1016/S0165-9936(02)00806-3.
Weblinks
- ETH Zürich, Analytische Chemie: Gaschromatographie (GC) (PDF; 991 kB)
- In NetLogo ist eine Simulation implementiert.[10]
Einzelnachweise
- vgl. LC GC International, Vol. 3 No. 11.
- A. T. James, A. J. P. Martin: Gas-liquid partition chromatography: the separation and micro-estimation of volatile fatty acids from formic acid to dodecanoic acid. In: Biochemical Journal. 50, 1952, S. 679–690.
- J. E. Lovelock: A sensitive detector for gas chromatography. In: Journal of Chromatography A. 1, Nr. 1, 1958, S. 35–46. doi:10.1016/S0021-9673(00)93398-3.
- J. E. Lovelock: The electron capture detector. In: Journal of Chromatography A. 99, Nr. 1, 1974, S. 3–12. doi:10.1016/S0021-9673(00)90840-9.
- Dandenau, Raymond D. und E.H. Zerenner: An investigation of glasses for capillary chromatography. In: Journal of High Resolution Chromatography. 2, Nr. 6, 1979, S. 351–356. doi:10.1002/jhrc.1240020617.
- Infografik - Der unglaubliche Fortschritt der Analytischen Chemie. In: Deutsches Lackinstitut. Abgerufen am 10. August 2019.
- Dioxinanayltik. In: Bundesinstitut für Risikobewertung. Abgerufen am 10. August 2019.
- Wolfgang Brodacz, Marc Platthaus: Vergleich und Kombination von GC-Phasen. LaborPraxis, 4/2004.
- N. Limsathayourat, H.-U. Melchert: High-temperature capillary GLC of hydrocarbons, fatty-acid derivatives, cholesterol esters, wax esters and triglycerides in beeswax analysis. In: Fresenius’ Journal of Analytical Chemistry. 318, Nr. 6, 1984, S. 410–413, doi:10.1007/BF00533223.
- Uri Wilensky: NetLogo Models Library: Gas Chromatography. Abgerufen am 27. November 2018 (englisch).