Acetylierung
Als Acetylierung wird in der organischen Chemie der Austausch von einem Wasserstoffatom durch eine Acetylgruppe bezeichnet.[1] Der Austausch kann an den funktionellen Gruppen −OH, −SH und −NH2, aber auch direkt an einer −C−H-Bindung erfolgen, wobei entsprechende Verbindungen wie etwa Acetate oder Ketone entstehen.[1] Beispielsweise entsteht durch die Acetylierung von Morphin Diacetylmorphin (Heroin).
Acetylierung in der organischen Chemie
Acetylgruppen sind in der organischen Chemie als Schutzgruppe weit verbreitet. Am verbreitetsten ist die Verwendung von Essigsäureanhydrid, womit bei Raumtemperatur quantitative Ausbeuten erzielt werden können.[2][3] Auch katalysierte Reaktionen einer Stammverbindung mit Acetylchlorid werden verwendet.[4][5]
Acetylierung in der Biochemie
In der Biochemie wird die Acetylierung eines Proteins in der Regel durch Acetyltransferasen (Enzyme) katalysiert. Die Abspaltung (Desacetylierung, Deacetylierung [aus dem Englischen abgeleitet]) der Acetylgruppe, also die Umkehrung dieser Reaktion, wird von Desacetylasen (Deacetylasen) katalysiert.
Die Acetylierung beziehungsweise Desacetylierung eines Proteins ist ein Regulationsmechanismus für die Funktion des Proteins.
Bekanntestes Beispiel für Proteine, deren Funktion auf diese Weise beeinflusst wird, sind die Histon-Proteine, die am Aufbau des Chromatins beteiligt sind. Hier bedeutet der acetylierte oder deacetylierte Zustand der Histone ein Signal für weitere Proteine, die daran erkennen können, ob die Genexpression der Gene in dieser Region des Chromatins aktiviert oder reprimiert werden soll.
Arzneistoffsynthese
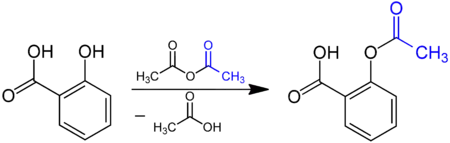
Im Herstellprozess von Acetylsalicylsäure ist die Acetylierung der phenolischen Hydroxygruppe der Salicylsäure ein Schlüsselschritt. Viele weitere Arzneistoffe werden durch Acetylierung hergestellt, z. B. Acetylcystein aus Cystein.[7] Weitere Beispiele sind Acetylcholin, β-Acetyldigoxin und Oxaceprol.
Siehe auch
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 47.
- H. Büchi, H.G. Khorana: CV. Total synthesis of the structural gene for an alanine transfer ribonucleic acid from yeast. Chemical synthesis of an icosadeoxyribonucleotide corresponding to the nucleotide sequence 31 to 50. In: Journal of Molecular Biology. 72, 1972, S. 251–288, doi:10.1016/0022-2836(72)90148-9.
- R. I. ZHDANOV, S. M. ZHENODAROVA: Chemical Methods of Oligonucleotide Synthesis. In: Synthesis. 1975, 1975, S. 222–245, doi:10.1055/s-1975-23714.
- Gilbert Stork, Takashi Takahashi, Isao Kawamoto, Toshio Suzuki: Total synthesis of prostaglandin F2.alpha. by chirality transfer from D-glucose. In: Journal of the American Chemical Society. 100, 1978, S. 8272–8273, doi:10.1021/ja00494a045.
- Alan C. Spivey, Stellios Arseniyadis: Nucleophilic Catalysis by 4-(Dialkylamino)pyridines Revisited?The Search for Optimal Reactivity and Selectivity. In: Angewandte Chemie International Edition. 43, 2004, S. 5436–5441, doi:10.1002/anie.200460373.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dieter Reichert: Pharmaceutical Substances, Thieme-Verlag Stuttgart, 5. Auflage (2009), S. 16–17, ISBN 978-3-13-558405-8.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dieter Reichert: Pharmaceutical Substances, Thieme-Verlag Stuttgart, 5. Auflage (2009), S. 13–14, ISBN 978-3-13-558405-8.