Dehydratisierung (Chemie)
Die Dehydratisierung oder Dehydratation bezeichnet die Abspaltung von Wasser infolge einer chemischen Reaktion, also einer Eliminierungsreaktion (Elimination), aber auch die Abspaltung von Kristallwasser oder von Wasser aus Aquakomplexen.[1]
Im Gegensatz dazu bezeichnet der verwandte Begriff Dehydrierung die chemische Abspaltung von Wasserstoff.
In Gegenwart von wasserabspaltenden Mitteln, wie konzentrierter Schwefelsäure, Phosphorsäure oder wasserfreiem Zinkchlorid, reagieren Alkohole in der Wärme unter intramolekularer Wasserabspaltung zu den entsprechenden Alkenen. Besonders leicht dehydratisieren die tertiären Alkohole. Großtechnisch kann die Dehydratisierung der Alkohole unter Druck katalytisch in der Gasphase durchgeführt werden. Allerdings hat – wegen der leichten Verfügbarkeit von Alkenen aus petrochemischen Quellen – die Bedeutung der Dehydratisierung von Alkoholen zu Alkenen abgenommen. Vielmehr werden Alkohole in großem Umfang durch Hydratisierung von Alkenen gewonnen.
Man kann die Vorzugsrichtung, an welcher die Doppelbindung gebildet wird, der Saytzeff-Regel – nach Alexander Michailowitsch Saizew (1841–1910) – entnehmen. Sie besagt, dass das erforderliche Wasserstoffatom vom wasserstoffärmsten benachbarten Kohlenstoffatom entfernt und das höchstsubstituierte (und somit thermodynamisch stabilste) Alken gebildet wird.
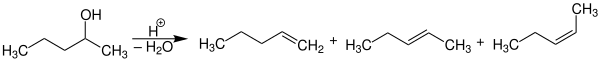
Alkohole können auch in einer intermolekularen Dehydratisierung reagieren. So entsteht aus je zwei Molekülen Ethanol bei der technischen Dehydratisierung in der Gasphase bei 260 °C ein Molekül Diethylether.[2]
Ein weiteres wichtiges Beispiel für eine Dehydratisierung ist die Bildung von Säureanhydriden durch Wasserabspaltung aus den entsprechenden Säuren, zum Beispiel die technische Herstellung von Essigsäureanhydrid aus Essigsäure oder von Phthalsäureanhydrid aus Phthalsäure.
Einzelnachweise
- Eintrag zu Dehydratisierung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 270.