Caprylsäure
Caprylsäure ist der Trivialname für die Carbonsäure Octansäure, eine gesättigte Fettsäure. Der Name leitet sich wie bei der Capronsäure und der Caprinsäure aus dem Lateinischen capra oder caper für Ziege beziehungsweise Ziegenbock ab.

| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
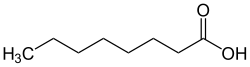 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Caprylsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C8H16O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses Öl mit schwach ranzigem Geruch und brennendem Geschmack.[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 144,21 g·mol−1[4] | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,9073 g·cm−3 (25 °C)[4] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
237 °C[5] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
4,89 (25 °C)[7] | |||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (0,68 g·l−1 bei 20 °C)[5] | |||||||||||||||||||||
| Brechungsindex |
1,4285 (20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Vorkommen und Herstellung
Caprylsäure ist als Triglycerid (Glycerol-Triester) im Öl bzw. Fett der Kokosnuss (Kokosöl) zu etwa 5–9 % enthalten, in Butter zu ca. 1,2 %.[9] Ebenfalls als Triglycerid findet sich Caprylsäure in Ziegenbutter, Milch, Palm-, Weinfuselöl, Fleischprodukten, Meeresfrüchten und Käse.[3] Sie findet sich in hoher Konzentration in den Samenölen verschiedener Arten der Köcherblümchen (Cuphea spp.) und der Ulmengewächse (Ulmus spp.).[10] Das Wehrsekret des Geißelskorpions Mastigoproctus giganteus besteht zu 5 % aus Caprylsäure. Als freie Säure kommt sie auch in Äpfeln, Bananen und Erdbeeren vor. Während des Reifeprozesses wird sie in Erdbeeren zu 1-Octanol und dessen Ester, die die Hauptaromakompenten bilden, verstoffwechselt.[11] Weiter kommt sie in Salbei (Salvia sclarea), Thymian (Thymus vulgaris), Melonen, wie Wassermelonen (Citrullus lanatus) und Zuckermelonen (Cucumis melo), Ingwer (Zingiber officinale), Noni (Morinda citrifolia), Roselle (Hibiscus sabdariffa), Cashewnüssen (Anacardium occidentale), Schwarzem Holunder (Sambucus nigra) und der Gemeinen Akelei (Aquilegia vulgaris) vor.[12]
Die Carbonsäure wird synthetisch aus Octanol oder Octanal durch Oxidation hergestellt.[3] Auch eine biotechnologische Herstellung mit Bakterien (Escherichia coli) und Hefen (Saccharomyces cerevisiae) ist möglich, wenn auch derzeit noch nicht in wirtschaftlich relevantem Maßstab.[13][14][15]
Eigenschaften
Caprylsäure ist ein in reiner Form farbloses Öl mit schwach ranzigem Geruch und brennendem Geschmack.[3] Die Carbonsäure schmilzt bei 16,5 °C und siedet bei 237 °C. Sie ist schlecht wasserlöslich,[5] ist aber mit vielen organischen Lösemitteln mischbar.[3] Ihre Salze und Ester heißen Caprate bzw. Octanoate. Caprylsäure reizt Augen und Haut.
Verwendung
Verwendung findet Caprylsäure bei der Herstellung von Seifen, Farbstoffen, natürlichen Insektiziden,[12] Fungiziden[12] und antiseptischen[12] Arzneimitteln.
Caprylsäure wird auch in Insektensprays eingesetzt und als „Naturprodukt“ beworben, da es sich nicht um ein klassisches Insektizid handelt. Caprylsäure löst den Chitinpanzer der Insekten auf, woran diese sterben.
Die Caprylsäure wird auch medizinisch gegen Pilzinfektionen (Kandidose) und einige Bakterieninfektionen verwendet.
Einzelnachweise
- Otto Ule, Karl Müller: Die Natur. Zeitung zur Verbreitung naturwissenschaftlicher Kenntnis, Bd. 8, Halle 1859, S. 171, eingeschränkte Vorschau in der Google-Buchsuche.
- Eintrag zu CAPRYLIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. Mai 2020.
- Eintrag zu Octansäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Mai 2013.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-404.
- Eintrag zu Octansäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- C. D. Cappa, E. R. Lovejoy, A .R. Ravishankara: Evaporation Rates and Vapor Pressures of the Even-Numbered C8−C18 Monocarboxylic Acids. In: J. Phys. Chem. A 112, (2008), 3959–3964, doi:10.1021/jp710586m.
- Eintrag zu Octanoic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Eintrag zu Octanoic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Butter im Deutschen Ernährungsberatungs- und -informationsnetz (DEBInet), entnommen aus dem Bundeslebensmittelschlüssel.
- Octanoic acid bei PlantFA Database, abgerufen am 7. November 2017.
- Roland Tressl, Friedrich Drawert: Über die Biogenese von Aromastoffen bei Pflanzen und Früchten XIII. Mitt.: Einbau von 8-14C-Caprylsäure in Bananen- und Erdbeeraromastoffe. In: Zeitschrift für Naturforschung B. 26, 1971, S. 774–779 (PDF, freier Volltext).
- CAPRYLIC-ACID (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 18. Juli 2021.
- Jan Gajewski, Renata Pavlovic, Manuel Fischer, Eckhard Boles, Martin Grininger: Engineering fungal de novo fatty acid synthesis for short chain fatty acid production. In: Nature Communications. Band 8, 10. März 2017, S. 14650, doi:10.1038/ncomms14650, PMID 28281527.
- Zaigao Tan, Jong Moon Yoon, Anupam Chowdhury, Kaitlin Burdick, Laura R. Jarboe: Engineering of E. coli inherent fatty acid biosynthesis capacity to increase octanoic acid production. In: Biotechnology for Biofuels. Band 11, Nr. 1, Dezember 2018, doi:10.1186/s13068-018-1078-z, PMID 29619083.
- Junjun Wu, Xia Zhang, Xiudong Xia, Mingsheng Dong: A systematic optimization of medium chain fatty acid biosynthesis via the reverse beta-oxidation cycle in Escherichia coli. In: Metabolic Engineering. Band 41, S. 115–124, doi:10.1016/j.ymben.2017.03.012 (elsevier.com [abgerufen am 17. Mai 2019]).
