Butane
Die Butane bilden eine Stoffgruppe innerhalb der Alkane, die die Summenformel C4H10 haben. Sie besteht aus den beiden Vertretern n-Butan und iso-Butan, die zueinander isomer sind. Beide Butane sind farblose, brennbare, leicht zu verflüssigende Gase („Flüssiggase“), die sich kaum in Wasser, aber gut in Ethanol und Ether lösen.[1] Mit „Butan“ oder „Butan-Gas“ ist fast immer n-Butan gemeint.
| Eigenschaften der Butane | ||
| Name | n-Butan[2] | Isobutan[3] |
| Kältemittel[4] | R-600 | R-600a |
| Strukturformel | 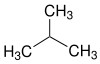 | |
| CAS-Nummer | 106-97-8 | 75-28-5 |
| ECHA-InfoCard | 100.003.136 | 100.000.780 |
| PubChem | 7843 | 6360 |
| Summenformel | C4H10 | |
| Molare Masse | 58,12 g·mol−1 | |
| Schmelzpunkt | −138,29 °C | −159,42 °C |
| Siedepunkt | −0,50 °C | −11,7 °C |
| Dampfdruck (20 °C) | 2081 hPa | 3019 hPa |
| Dichte (Gas, 0 °C, 1013 mbar) | 2,71 kg·m−3 | 2,70 kg·m−3 |
| Dichte (Flüssigkeit am Siedepunkt) | 0,59 kg·l−1 | 0,60 kg·l−1 |
| Heizwert | 46 MJ·kg−1 (12,72 kWh·kg−1) 123 MJ·m−3 (34,32 kWh·m−3) | |
| Löslichkeit in Wasser bei 20 °C | 61 mg·l−1 | 49 mg·l−1 |
| Untere Explosionsgrenze (UEG) |
1,4 Vol.‑% | 1,5 Vol.‑% |
| 33 g·m−3 | 37 g·m−3 | |
| Obere Explosionsgrenze (OEG) |
9,4 Vol.‑% | |
| 231 g·m−3 | ||
Vorkommen und Darstellung
Butane kommen natürlicherweise im Erdgas vor, werden aber auch durch Cracken aus Erdöl gewonnen. Eine Trennung der beiden Isomere kann durch Adsorption und fraktionierte Desorption ab Aktivkohle oder Zeolithen erfolgen. Isobutan wird in großen Mengen aus n-Butan durch Isomerisierung mit einem Gemisch von Aluminiumchlorid und Chlorwasserstoff als Katalysator hergestellt.[1]
Verwendung

Butane werden als Brenngas (z. B. Feuerzeuggas), Kältemittel (Isobutan: R600a), als Treibgase[1][5], Lebensmittelzusatzstoff[6] und Extraktionsmittel[6] (beispielsweise um CBD zu extrahieren) eingesetzt. Gasgemische beispielsweise aus 40 % Propan und 60 % Butan werden an Tankstellen als Autogas, als Flaschengas für Gas-Rechauds und für technische Geräte zum Löten und Schweißen, als Gaskartuschen im Campingbereich und als Nachfülldosen für Feuerzeuge und dergleichen mehr verwendet.
Im Winter wird Otto-Kraftstoff (Benzin) mit Isopentan- und Butanzusatz verkauft, da diese Stoffe wegen des tiefen Siedepunktes die Kaltstartfreudigkeit des Otto-Motors bei tiefen Außentemperaturen verbessern (siehe dazu auch Motorenbenzin#Herstellung).
Butane werden in der chemischen Industrie zur Darstellung von C4-Alkenen wie 1,3-Butadien, 1-Buten, 2-Buten und Isobuten sowie für Synthesen höherer Kohlenwasserstoffe (für „Alkylatbenzin“), Thiophen sowie von Oxidationsprodukten wie tert-Butylhydroperoxid eingesetzt.
Sicherheitshinweise
Butane besitzen – wie alle Alkane – eine narkotische und sauerstoffverdrängende Wirkung. Bei einer dadurch ausgelösten Atemdepression können Effekte auf das Zentralnervensystem wie Erregung, Euphorie und Erbrechen, bei hohen Dosierungen auch negative Wirkungen auf Blutkreislauf und Herz (wie Herzrhythmusstörungen) auftreten.[5]
Einzelnachweise
- Wissenschaft-Online-Lexika: Eintrag zu „Butane“ im Lexikon der Chemie, abgerufen am 17. November 2011.
- Eintrag zu Butan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu Isobutan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- Kältemittel gefahrgutbrumme.de, abgerufen 23. Dezember 2019.
- Eintrag zu Butane. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. November 2011.
- Lebensmittellexikon