Coenzym A
Coenzym A (auch Koenzym A, kurz CoA oder CoASH) ist ein Coenzym, das zur „Aktivierung“ von Alkansäuren und deren Derivaten dient und unmittelbar am Fettstoffwechsel sowie mittelbar am Zucker- und am Proteinstoffwechsel beteiligt ist.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Coenzym A | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C21H36N7O16P3S | |||||||||||||||||||||
| Kurzbeschreibung |
beiger Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 767,53 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Es ist Acylgruppenüberträger in Acyltransferasen (E.C. 2.3.N.N.) und CoA-Transferasen (E.C. 2.8.3.N).
Die Isolierung gelang erstmals im Jahr 1951 durch den deutschen Biochemiker und späteren Nobelpreisträger Feodor Lynen in Form von Acetyl-Coenzym A („aktivierte Essigsäure“) aus Hefezellen. Die Aufklärung der Struktur erfolgte zwei Jahre später durch James Baddiley vom britischen Lister Institute of Preventive Medicine und Fritz Albert Lipmann von der Harvard University.
Struktur
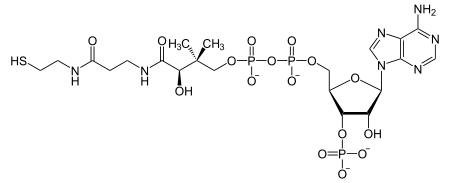
Das Coenzym-A-Molekül setzt sich aus mehreren Komponenten zusammen: dazu gehören ein Nukleotid (Adenosindiphosphat, ADP), ein Vitamin (Pantothensäure, Vitamin B5) sowie eine Aminosäure (Cystein), die während der Synthese im Körper miteinander verknüpft und anschließend noch leicht modifiziert werden.
Im Detail besteht das fertige Coenzym A aus Cysteamin (auch Thioethanolamin) (5), β-Alanin (4), Pantoinsäure (2,4-Dihydroxy-3,3-dimethylbuttersäure) (3), Diphosphat (2) und 3'-phosphoryliertem Adenosin (1).
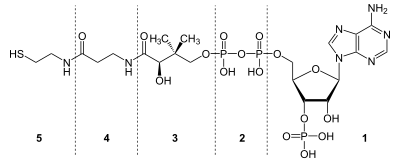
β-Alanin (4) und Pantoinsäure (3) zusammen bezeichnet man auch als Pantothensäure. Betrachtet man diese zusammen mit dem Cysteamin (5), spricht man vom Pantethein (5+4+3). 3'-Phospho-Adenosin kann man zusammen mit dem Diphosphat als 3'-Phospho-Adenosindiphosphat auffassen. Demnach besteht Coenzym A aus Pantethein und 3'-Phospho-ADP.
Biosynthese
Die Synthese im tierischen Organismus geht aus von der essentiellen Pantothensäure, an die zunächst mithilfe der Pantothenatkinase eine Phosphorylgruppe, und anschließend mithilfe der Phosphopantothenat-Cystein-Ligase ein Cystein gebunden wird. Nachdem das Cystein durch die Phosphopantothenoylcystein-Decarboxylase zum Cysteamin decarboxyliert wurde, wird an die Phosphatgruppe ein Adenosinmonophosphat (AMP) geknüpft und zuletzt wird das Adenosin an der 3'-OH-Gruppe phosphoryliert. Die letzten beiden Schritte werden von verschiedenen Domänen der Coenzym-A-Synthase katalysiert.
Zu den detaillierten Vorgängen bei der Synthese inklusive Strukturformeln siehe den Abschnitt Weblinks.
Funktion
Das Coenzym A ist in der Lage, energiereiche Verbindungen über die SH-Gruppe (Thiolgruppe) des Cysteamin-Anteils einzugehen. Diese Verbindungen geht sie mit den Carboxygruppen (-COOH) von Alkan- und Fettsäuren unter Bildung von sogenannten Thioesterbindungen ein.
Coenzym A ist dadurch direkt – als Acyl-CoA – am Stoffwechsel der Fette und indirekt – als Acetyl-CoA – am Kohlenhydrat- und Eiweißstoffwechsel beteiligt.
Man spricht davon, dass Coenzym A die Bindungspartner durch die Bildung der energiereichen Thioesterbindung aktiviert, denn erst hierdurch sind sie in der Lage, bestimmte chemische Reaktionen im Körper in ausreichender Geschwindigkeit einzugehen. Ohne Coenzym A wären die Bindungspartner wesentlich reaktionsträger.
Acetyl-CoA
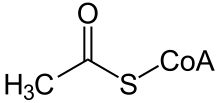
Acetyl-Coenzym A (kurz Acetyl-CoA) ist ein „aktivierter“ Essigsäurerest (CH3CO-). Dieser ist an die SH-Gruppe des Cysteamin-Anteils von Coenzym A gebunden.
Acetyl-CoA entsteht im Organismus bei mehreren Stoffwechselvorgängen:
- Zum einen wird es durch die sogenannte oxidative Decarboxylierung von Pyruvat, welches seinerseits als Endprodukt der Glykolyse anfällt, gebildet, aber auch durch den Abbau von Aminosäuren (wie z. B. L-Alanin). Die oxidative Decarboxylierung des Pyruvats findet im Mitochondrium statt. Dort katalysiert der Pyruvatdehydrogenase-Enzymkomplex die Abspaltung von Kohlendioxid CO2 (die Carboxygruppe wird abgespalten, daher „Decarboxylierung“) und gleichzeitig die Verknüpfung des übrigbleibenden Acetylrests mit der SH-Gruppe des Coenzym A. Dabei wird das ursprünglich mittlere C-Atom des Pyruvats oxidiert (daher „oxidativ“).
- Außerdem entsteht Acetyl-CoA beim Abbau von Fettsäuren im Rahmen der β-Oxidation. Hier werden von der Fettsäure nacheinander immer zwei Kohlenstoffatome in Form von Acetyl-CoA abgespalten. So entstehen z. B. beim Abbau von Palmitinsäure mit 16 C-Atomen im Rahmen der β-Oxidation acht Moleküle Acetyl-CoA. Auch dieser Vorgang findet in der Mitochondrien-Matrix statt.
- Im assimilatorischen Stoffwechsel vieler Anaerobier tritt es außerdem als Produkt des reduktiven Acetyl-CoA-Wegs sowie des reduktiven Citratzyklus auf.
Das gebildete Acetyl-CoA kann im Mitochondrium durch Citratzyklus und Atmungskette komplett zu CO2 und H2O abgebaut werden oder aber erneut zur Synthese energiereicher Verbindungen wie Triglyceride, Ketonkörper oder Cholesterin herangezogen werden. Diese anabolen Prozesse finden teils im Zytosol statt (z. B. Fettsäuresynthese), jedoch kann das Acetyl-CoA nicht ohne weiteres das Mitochondrium verlassen und auch die Transportwege für längerkettige Carbonsäuren (s. u.) sind ihm versperrt. Für den Transport von Acetyl-CoA aus dem Mitochondrium in das Zytosol gibt es daher ein spezielles Transportsystem, das sogenannte Citrat-Shuttle.
Acyl-CoA
Acyl-Coenzym A (kurz Acyl-CoA) ist die Bezeichnung für eine „aktivierte“ Fettsäure. Analog zum Acetyl-CoA ist hier statt eines Acetylrests der Rest einer Fettsäure – ein Acylrest – an die SH-Gruppe gebunden.
Acyl-CoA ist am Abbau der Fettsäuren (β-Oxidation) beteiligt, indem es die Fettsäure bindet. Bei der Synthese von Fettsäuren im Körper übernimmt eine strukturell verwandte prosthetische Gruppe der Fettsäuresynthase – Acyl-Carrier-Protein genannt (kurz ACP) – die Rolle des Coenzyms A.
Gebildet wird Acyl-CoA durch das Enzym Acyl-CoA-Synthetase (auch Thiokinase), dies geschieht im Cytosol. Zunächst reagiert die freie Fettsäure an der Carboxygruppe (-COOH) mit ATP unter Abspaltung von Diphosphat. Es entsteht das sogenannte Acyl-Adenylat. Die Energie dieser Bindung wird anschließend genutzt, um das Coenzym A mit der Fettsäure zu verestern, dabei wird AMP abgespalten. Beide Schritte werden durch die Thiokinase katalysiert.
Zum Fettsäureabbau muss das Acyl-CoA in die Mitochondrien transportiert werden. Ebenso wie Acetyl-CoA kann Acyl-CoA nicht selbständig die innere Mitochondrienmembran überwinden und wird zum Transport auf L-Carnitin übertragen. Von dieser Acyl-Carnitin genannten Transportform wird der Acylrest im Mitochondrieninnern wieder auf ein Coenzym A übertragen, so dass erneut Acyl-CoA vorliegt.
Aus Acyl-CoA werden Fettalkohole gebildet, die beispielsweise für die Synthese von Bienenwachs durch die Honigbiene genutzt werden.[3]
Propionyl-CoA
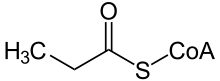
Propionyl-CoA entsteht im Stoffwechsel bei mehreren Gelegenheiten. Der bekannteste Weg ist der Abbau (β-Oxidation) von ungeradzahligen Fettsäuren. Nach wiederholter Abspaltung einer Einheit von zwei Kohlenstoffatomen in Form von Acetyl-CoA bleibt am Schluss eine Einheit von drei Kohlenstoffatomen in Form von Propionyl-CoA übrig. Aber auch beim Abbau von Fettsäuren mit Methyl-Verzweigungen entsteht Propionyl-CoA. Das betrifft auch den Abbau der verzweigten Seitenkette des Cholesterins, wie er bei der Biosynthese der Gallensäuren stattfindet – dabei wird ebenfalls Propionyl-CoA abgespalten. Eine sehr bedeutende Quelle für Propionyl-CoA stellt der Abbau der Aminosäuren Isoleucin, Valin und Methionin sowie der Hauptabbauweg von Threonin dar.[4]
Propionyl-CoA wird zu Succinyl-CoA umgewandelt, das dann in den Citratzyklus eintreten kann und zu dessen Auffüllung beiträgt. Dazu wird Propionyl-CoA zunächst von der von Biotin abhängigen Propionyl-CoA-Carboxylase zu D-Methylmalonyl-CoA umgesetzt. Die Methylmalonyl-CoA-Epimerase[5] erzeugt dann das L-Isomer. Dieses wiederum wird von der Methylmalonyl-CoA-Mutase, deren Funktion von Cobalamin abhängt, in Succinyl-CoA umgewandelt.[6]
Aber auch bei der Fettsäuresynthese spielt Propionyl-CoA eine Rolle. Der Aufbau von ungeradzahligen Fettsäuren startet mit Propionyl-CoA. Methyl-Verzweigungen innerhalb einer Fettsäurekette können durch Kettenverlängerung mit Methylmalonyl-CoA erzeugt werden, das durch die Propionyl-CoA-Carboxylase aus Propionyl-CoA entsteht.[7]
Einzelnachweise
- Eintrag zu COENZYME A in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Datenblatt Coenzyme A hydrate, ≥85% (UV, HPLC) bei Sigma-Aldrich, abgerufen am 18. April 2017 (PDF).
- Janine Hellenbrand: Charakterisierung von Acyl-CoA-Reduktasen. Dissertation, RWTH Aachen, 2012.
- D. Doenecke, J. Koolman, G. Fuchs, W. Gerok: Karlsons Biochemie und Pathobiochemie. 15. Auflage. Georg Thieme Verlag, Stuttgart 2005; S. 214f, 219ff, 281, 328f ISBN 978-3-13-357815-8.
- Eintrag EC 5.1.99.1 in der Enzymdatenbank BRENDA
- J. M. Berg, J. L. Tymoczko, L. Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Elsevier GmbH, München 2007; S. 697f, 741f, 744f; ISBN 978-3-8274-1800-5.
- K. Urich: Comparative Animal Biochemistry. Springer Verlag, Berlin 1994; S. 564f; ISBN 3-540-57420-4.
Quellen
- Biochemie des Menschen, Florian Horn e.a., 3. Auflage, Thieme Verlag 2005, ISBN 3-13-130883-4