Aminozucker
Aminozucker sind Monosaccharide (Einfachzucker), bei denen eine oder mehrere Hydroxygruppen (–OH) formal durch eine Aminogruppe (–NH2) ersetzt sind. Freie Aminozucker sind stark basisch und kommen in der Natur nicht vor; die Monosaccharide sind immer Bestandteile von Glycosiden und polymeren Stoffen. Als Bausteine verschiedener, häufig essentieller Biomoleküle sind sie für viele zentrale chemische Vorgänge und molekulare Strukturen in der Natur grundlegend.
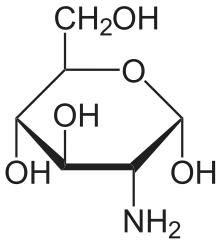
Ist der Stickstoff an das Kohlenstoffatom des anomeren Zentrums eines Monosaccharids gebunden, so heißt der betreffende Aminozucker Glycosylamin, andernfalls wird er Aminodesoxyzucker genannt.[1]
Entdeckt wurde diese Stoffgruppe 1875 von dem jungen Mediziner Georg Ledderhose, als er Scheren und Panzer eines jüngst verzehrten Hummers in Salzsäure einkochte und daraufhin glitzernde Kristalle (D-Glucosamin-Hydrochlorid) entdeckte. Im Jahr darauf folgte die Erstbeschreibung, 1903 die erste Synthese (durch Fischer und Leuchs), 1914 entdeckten Phoebus Levene und F. B. La Forge D-Galactosamin. Der Nachweis von Aminozuckern im Influenzavirus erfolgte 1947 (durch C. A. Knight).[2]
Funktion und Bedeutung
In der Natur
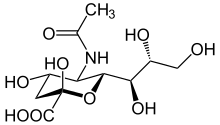
Aminozucker sind in verschiedensten Organismen als Bestandteil ihrer Zellstruktur von Bedeutung: so festigen sie etwa bei Bakterien mit Murein die Zellwand, fungieren bei Gliedertieren und Pilzen als Baustein des Chitins und stellen bei vielen höheren Lebewesen die Gruppe der Glycosaminoglycane, die als Faserstoffe, Bestandteile von Zellmembranen und der Grundsubstanz der extrazellulären Matrix, zudem auch in Blut und Frauenmilch[3] vorhanden sind.[4] Allgemein gelten 2-Desoxy-2-Amino-Aldosen wie D-Glucosamin oder D-Galactosamin als die wichtigsten Aminozucker.[3] Doch auch bei Nukleotiden, den codierenden Grundbausteinen der DNA, handelt es sich um substituierte Glycosylamine.[1]
Aufgrund ihrer Aminogruppen stellen Aminozucker außerdem einen relevanten Faktor für den Stickstoffgehalt von Böden dar: schätzungsweise 5–10 % des Bodenstickstoffs gehen auf sie zurück, davon entstammt der Großteil abgestorbenen Mikroorganismen, wogegen Pflanzen Aminozucker nicht in signifikanten Mengen produzieren.[5] In intensiv bewirtschafteten Böden ist der Aminozuckeranteil messbar verringert, da die bakterielle Synthese als Folge der industriellen Landnutzung deutlich abnimmt; zudem treten zwischen unterschiedlich stark kultivierten Böden Differenzen innerhalb des Anteils bestimmter Aminozucker (zwischen denen bakteriellen Ursprungs, deren Konzentration infolge Ackernutzung stärker absinkt, und jenen dem Chitin entstammenden) auf, wodurch sich die Relation zwischen den beiden Gruppen als Indikator für Landnutzungseinflüsse anwenden lässt.[6]
Verwendung
Eine Reihe von glycosidisch gebundenen Aminozuckern sind charakteristisch für Aminoglycoside, welche als Antibiotika so auf die Proteinbiosynthese von Bakterien einwirken, dass anschließend Proteine unsinniger Zusammensetzung gebildet werden. Zudem werden Sialinsäureanaloga als Neuramidasehemmer zur Bekämpfung von Viruserkrankungen wie Influenza eingesetzt, doch sind diese selbst keine Zucker. Weiters wird der physiologisch in den Mastzellen gebildete Kofaktor des gerinnungshemmenden Antithrombin III, Heparin, als Antikoagulans eingesetzt.[8]
Mit der Amadori-Umlagerung lassen sich aus Aldose-N-Glucosiden korrespondierende Ketose-N-Glucoside gewinnen, welche wichtige Zwischenprodukte in der Herstellung von Osazonen, Osonen, Chinoxalinen und den Vitaminen Riboflavin (B2) und Folsäure (B9) sind.[9]
Da Aminozucker eine besonders starke magnetische Kopplung zeigen, wurde ferner vorgeschlagen, sie – anstelle der bisher verwendeten Proteine – als Koordinationspartner für die Metallzentren synthetischer Katalysatoren einzusetzen.[10]
Chemie
Freie Aminozucker reagieren stark basisch, weshalb sie in lebenden Organismen acetyliert werden. Natürlicherweise sind vor allem Aminozucker aus Hexosen verbreitet, zu denen Mannose, Glucose (Traubenzucker) und Galactose zählen. Da die Hydroxygruppe des C2-Atom bevorzugt ersetzt wird, entstehen vielfach 2-Amino-Hexosen: So bildet sich etwa aus Glucose Glucosamin, aus Mannose Mannosamin und aus der Galactose ein Galactosamin.[11]
Biosynthese
Die Biosynthese der Aminozucker verläuft über eine Transaminierung, wobei die Aminogruppe aus der Aminosäure Glutamin stammt. Glucose-6-phosphat wird beispielsweise durch das Enzym Hexosephosphat-Transaminase zu D-Glucosamin-6-phosphat aminiert. Das gebildete Glucosaminphosphat kann mit Hilfe einer Transacetylase in das N-Acetylderivat überführt werden. Nach Umwandlung zum 1-Phosphat wird dieses durch Reaktion mit UTP aktiviert und danach in verschiedenste Polymerverbindungen eingebaut.[12]
Laborsynthese
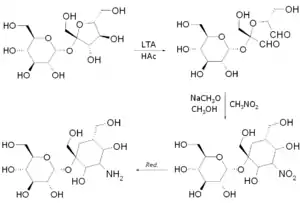
Es gibt verschiedene Wege, Aminozucker herzustellen. Eine Methode ist eine Ringschlussreaktion vom Aldoltyp zwischen Dialdehyden und Nitroalkanen. So kann etwa Saccharose zuerst mit Blei(IV)-acetat und Essigsäure am Ring der Fructofuranose-Untereinheit oxidativ gespalten, jener anschließend wieder über Reaktion mit Nitromethan unter Präsenz von Natriummethanolat und Methanol geschlossen und anschließend die Nitrogruppe zur Aminogruppe reduziert werden.[13]
Ein jüngerer Syntheseweg für Aminodesoxyzucker ist die von 1-Hydroxy-1,2-benziodoxol-3(1H)-on-1-oxid („IBX“) vermittelte Darstellung aus Glycalen.[14]
Analytik
2-Acetamidozucker können durch die Morgan-Elson-Reaktion nachgewiesen werden. Dabei werden unter basischen Bedingungen Furane gebildet, die anschließend mit Ehrlichs Reagenz umgesetzt werden.[15]
Literatur
- Debenham et al.: Recent Advances in N-Protection for Amino Sugar Synthesis. In: Liebigs Annalen, Jahrgang 1997, Ausgabe 5, S. 791–802.
- Suzuki et al.: Rapid analysis of amino sugars by microchip electrophoresis with laser-induced fluorescence detection. In: Electrophoresis, Jahrgang 22, Ausgabe 18, S. 4023–4031.
Einzelnachweise
- Peter, Vollhardt: Organische Chemie, Wiley-VCH, Weinheim 1990. ISBN 3-527-26912-6, S. 1102.
- Kuhn et al.: Aminozucker. In: Angewandte Chemie, Jahrgang 69 (1957), Ausgaben 1–2, S. 23–33, insb. S. 26.
- Ternes, Täufel, Tunger, Zobel: Lexikon der Lebensmittel und der Lebensmittelchemie. S. 74–79. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2007. ISBN 978-3-8047-2275-0.
- Eintrag zu Aminozucker. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- Roberts et al.: Free amino sugar reactions in soil in relation to soil carbon and nitrogen cycling. In: Soil Biology and Biochemistry, 39 (2007), S. 3081–3092.
- Zhang et al.: Amino sugars in soils of the North American cultivated prairie. In: Zeitschrift für Pflanzenernährung und Bodenkunde, Jahrgang 160 (1997), Ausgabe 5, S. 533–538.
- Bruice: Organische Chemie. S. 1150. Pearson Studium, München 2007. ISBN 978-3-8273-7190-4.
- Lüllmann, Mohr, Hein: Taschenatlas Pharmakologie. S. 280–281,290,150. Thieme, Stuttgart 2004. ISBN 3-13-707705-2.
- Eintrag zu Amadori-Umlagerung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- Wegner et al.: Neue Bausteine zum Design von Mehrkern-Kupferkomplexen auf der Basis von Aminokohlenhydraten. In: Angewandte Chemie, Jahrgang 112 (2000), Ausgabe 3, S. 608–612.
- Wissenschaft-Online-Lexikon: Eintrag zu Aminozucker im Lexikon der Chemie.
- Löffler, Petrides, Heinrich: Biochemie und Pathobiochemie. S. 544–545. Springer, Heidelberg 2007. ISBN 3-540-32680-4.
- Shing: Glycol Cleavage Reactions. In: Trost, Fleming (Hrsg.): Comprehensive organic synthesis: selectivity, strategy and efficiency in modern organic chemistry. S. 712, Band 7. Pergamon Press, 1991. ISBN 0-08-035929-9.
- Nicolaou et al.: Novel IBX-Mediated Processes for the Synthesis of Amino Sugars and Libraries Thereof. In: Angewandte Chemie, Jahrgang 112 (2000), Ausgabe 14, S. 2625–2629.
- Michael Sinnott: Carbohydrate Chemistry and Biochemistry. Royal Society of Chemistry, 2013, ISBN 978-1-782-62632-9. S. 721, 722.