Tetrachlorethen
Tetrachlorethen (Trivialname Perchlorethylen, Perchlor, PER, PCE) ist eine farblose, nicht brennbare flüchtige Flüssigkeit, deren Dämpfe viel schwerer als Luft sind. Es lässt sich formal vom Ethen ableiten, bei dem alle vier Wasserstoffatome durch Chloratome ersetzt wurden, daher gehört es zu den leichtflüchtigen Chlorkohlenwasserstoffen. Tetrachlorethen löst Polyolefine und chemisch verwandte Kunststoffe an und macht sie weich und undurchsichtig.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
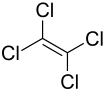 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetrachlorethen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2Cl4 | |||||||||||||||
| Kurzbeschreibung |
farblose, chlorartig riechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 165,83 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,62 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
121 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,5059[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−50,6 kJ/mol[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Aufgrund seiner weiten Verbreitung in Industrie und Gewerbe (besonders in der chemischen Reinigung) und einer hohen Umweltmobilität gehört Tetrachlorethen zu den Hauptkontaminanten des Grundwassers.[6]
Gewinnung und Darstellung
Michael Faraday synthetisierte Tetrachlorethen zuerst 1821 durch thermische Zersetzung von Hexachlorethan in einer glühenden Röhre.[7]
Heute wird Tetrachlorethen meist durch Hochtemperatur-Chlorolyse leichter Kohlenwasserstoffe produziert, wobei die Methode der von Faraday verwandten ähnelt.[8] Nebenprodukte der Reaktion sind Tetrachlormethan, Chlorwasserstoff und Hexachlorbutadien.
Einige weitere Verfahren wurden entwickelt. So die Reaktion von 1,2-Dichlorethan bei 400 °C mit Chlor:
Die Reaktion wird mit einem Gemisch von Kaliumchlorid und Aluminiumchlorid als Katalysator durchgeführt. Das als Nebenprodukt entstehende Trichlorethen wird durch Destillation abgetrennt.
Eigenschaften
Tetrachlorethen ist eine farblose Flüssigkeit, die unter Normaldruck bei 121 °C siedet.[2] Die Verdampfungsenthalpie beträgt am Siedepunkt 34,68 kJ·mol−1.[9] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,18056, B = 1440,819 und C = −49,171 im Temperaturbereich von 301 bis 380,8 K.[10] In fester Phase existieren zwei polymorphe Kristallformen. Die Kristallform II wandelt sich bei −63,15 °C mit einer Umwandlungswärme von 0,82 kJ·mol−1 in die Kristallform I um. Diese schmilzt dann bei −22,35 °C mit einer Schmelzenthalpie von 10,88 kJ·mol−1.[11][12] Die Mischbarkeit mit Wasser ist begrenzt. Mit steigender Temperatur steigt die Löslichkeit von Tetrachlorethen in Wasser bzw. steigt die Löslichkeit von Wasser in Tetrachlorethen.[13]
Löslichkeiten zwischen Tetrachlorethen und Wasser[13] Temperatur °C 0 9,5 19,5 31,1 40,0 50,1 61,3 71,0 80,2 91,8 Tetrachlorethen in Wasser in Ma-% 0,0273 0,0270 0,0286 0,0221 0,0213 0,0273 0,0304 0,0377 0,0380 0,0523 Wasser in Tetrachlorethen in Ma-% 0,0045 0,0054 0,0075 0,0091 0,0104 0,0117 0,0142 0,0205 0,0214 0,0245
Verwendung

Tetrachlorethen ist ein Lösungsmittel, das in der Textil-, Film-, optischen und in der Metallindustrie Anwendung findet. Wegen seines hohen Fettlösevermögens wird es dort als Entfettungsmittel verwendet. In der optischen Fertigung werden Linsen und Prismen vor der Verbindung zu optischen Elementen durch Verkittung oder Ansprengen mit Tetrachlorethen gereinigt (auch manuell). Die heute gebräuchlichen Anlagen haben mehrere Fluttanks sowie die Möglichkeit der Dampfentfettung (Kondensation von Lösemitteldampf auf den zu reinigenden Teilen), so dass eine praktisch fettfreie Oberfläche erhalten wird. Das Lösemittel wird anlagenintern durch Destillation aufgearbeitet. Da chlorierte Kohlenwasserstoffe bei Säureeintrag zur autokatalytischen Zersetzung (Bildung von Chlorwasserstoff) neigen, wird Tetrachlorethylen für die Metallreinigung mit speziellen Stabilisatoren (Amine, Epoxide) angeboten.
.svg.png.webp)
Ein weiteres bedeutendes Anwendungsgebiet ist die chemische Reinigung. Daher rührt auch das „P“ („Perchlorethylen“) auf dem Pflegesymbol der Textiletiketten.
Eine ungewöhnliche Verwendung fand Tetrachlorethen in den 1960er Jahren in dem Homestake-Experiment, einem Pionierexperiment der Elementarteilchenphysik. Hier wurden 615 t des Stoffes in einer Goldmine eingelagert, um mit Hilfe einer Kernreaktion das lange postulierte, aber sehr schwer nachzuweisende Neutrino zu finden.[14]
In der Tierkörperverwertung[15] findet Tetrachlorethen heute keine Verwendung mehr.[16]
Sicherheitshinweise
Tetrachlorethen ist als krebserzeugender Gefahrstoff der Kategorie drei eingestuft. Die chronische Aufnahme führt zu Leber- und Nierenschäden. Es steht in Verdacht, reproduktionstoxisch und karzinogen zu sein.
Die IARC stufte Tetrachlorethen im Jahr 2014 als wahrscheinlich krebserzeugend ein.[17]
Tetrachlorethen zersetzt sich durch Licht, Feuchtigkeit und Hitze (Zersetzungstemperatur: ab 150 °C). Dabei setzt es u. a. eine Reihe gefährlicher Zersetzungsprodukte frei, wie z. B. Chlorwasserstoff, Phosgen, Chlor, polychlorierte Dibenzodioxine (PCDD) oder polychlorierte Dibenzofurane (PCDF).
Tetrachlorethen reagiert mit einer Reihe anderer Chemikalien (vor allem mit Metallen und Metallverbindungen) teils sehr heftig, dabei kann es zur starken Hitzeentwicklung bis hin zur Explosion kommen. Auch dabei können gefährliche Produkte und Dämpfe entstehen oder freigesetzt werden.
Tetrachlorethen als Gefahrstoff
Bei der Verwendung von Tetrachlorethen sind Arbeitsplatzbelastungen in der Metallindustrie und in Chemischen Reinigungen möglich. Belastungen der Anwohner in der Nähe von Betrieben, die mit Tetrachlorethen arbeiten, für die ein Grenzwert von 0,1 mg pro Kubikmeter Raumluft gilt[18] und die Anreicherung von Tetrachlorethen im Grundwasser sind die häufigsten Umweltbelastungen. Das Referenzverfahren, um Belastungen in der Umgebung von Tetrachlorethenemittenten zu ermitteln, sind Raumluftanalysen mit Hilfe sogenannter Passivsammler, die nach dem Diffusionsprinzip arbeiten.[19] Dabei beträgt die durchschnittliche Tetrachlorethenbelastung in ländlichen Regionen weniger als 1 µg pro Kubikmeter Luft und in Ballungsgebieten zwischen 2 und 5 µg pro Kubikmeter Luft, was der Größenordnung nach 1/100 des Grenzwertes entspricht.[20]
Stand der Technik ist seit geraumer Zeit die Verwendung in geschlossenen Anlagen, deren Luft-Emissionen durch verschiedene Maßnahmen wie Vakuum und Aktivkohlefilter in der Abluft minimiert werden. Jedoch ist der Betrieb solcher Anlagen in Altbauten mit Balkendecken nach wie vor kritisch, weil in den Balkendecken das Tetrachlorethen gespeichert wird und nur langsam verdampft.[21] Chemische Textilreinigungen werden teils aus diesen Gründen auf nichthalogenierte Kohlenwasserstofflösemittel umgestellt (d. h. Kohlenwasserstoffe, bei denen kein Wasserstoffatom durch eines der Halogene Fluor, Chlor oder Brom ersetzt ist).
Bodenkontamination durch Tetrachlorethen werden im Altlastenkataster erfasst.
Für Trinkwasser ist laut der deutschen Trinkwasserverordnung ein Grenzwert von 10 µg pro Liter für die Summe von Trichlorethen und Tetrachlorethen festgelegt.[22]
Tetrachlorethen wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und gegebenenfalls Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Tetrachlorethen waren die Besorgnisse bezüglich der Einstufung als CMR-Substanz, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der PBT/vPvB-Substanzen. Die Neubewertung fand ab 2013 statt und wurde von Lettland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[23][24]
Weblinks
- Stoffdossier beim Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung
- Einsatz von PER in der chemischen Reinigung
- Concise International Chemical Assessment Document (CICAD) für Tetrachlorethene
Einzelnachweise
- Eintrag zu Tetrachlorethen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. März 2014.
- Eintrag zu Tetrachlorethen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. November 2017. (JavaScript erforderlich)
- Eintrag zu tetrachloroethylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 127-18-4 bzw. Tetrachlorethen), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- Silke Granzow: Isolierung und Charakterisierung eines neuen Tetrachlorethen dechlorierenden strikt anaeroben Bakteriums. Herbert Utz Verlag, 1998, ISBN 3-89675-388-6.
- Faraday, M.: On Two New Compounds of Chlorine and Carbon, and on a New Compound of Iodine, Carbon, and Hydrogen in Philosophical Transactions of the Royal Society of London 111 (1821 47–74).
- M. Rossberg u. a.: Chlorinated Hydrocarbons. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2006. doi:10.1002/14356007.a06_233.pub2
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- J. Polak, S. Murakami, V. T. Lam, Benson, George C.: Excess enthalpy, volume, and Gibbs free energy of cyclopentane-tetrachloroethylene mixtures at 25.deg. In: J. Chem. Eng. Data. 15, 1970, S. 323–328, doi:10.1021/je60045a041.
- N. V. Novoselova, I. B. Rabinovich, L. Ya. Tsvetkova, E. M. Moseeva, A. G. Babinkov: Heat capacity and thermodynamic functions of tetrachloroethylene. In: Zhur. Fiz. Khim. 60, 1986, S. 1627–1630.
- E. S. Domalski, E. D. Hearing: Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III. In: J. Phys. Chem. Ref. Data. 25, 1996, S. 1, doi:10.1063/1.555985.
- R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols. In: J. Chem. Eng. Data. 37, 1992, S. 80–95, doi:10.1021/je00005a024.
- Lothar Oberauer, Michael Wurm: Astrophysik mit Neutrinos. (PDF; 1,1 MB). In: Sterne und Weltraum. Februar 2010, S. 30–38.
- inFranken.de: Noch immer chemischer Fettlöser im Grundwasser (Umweltschadensfall ausgelöst durch eine mit PER betriebene Tierkörperverwertungsanstalt).
- Reinhard Matissek, Gabriele Steiner, Markus Fischer: Lebensmittelanalytik. Springer, Berlin 2010, ISBN 978-3-540-92204-9, S. 334.
- IARC Monograph 106 - Tetrachlorethen, 2014
- § 15 der Verordnung zur Emissionsbegrenzung von leichtflüchtigen halogenierten organischen Verbindungen.
- innenraumanalytik.at: Merkblatt – Tetrachlorethen (PDF; 15 kB).
- umweltlexikon-aktuell.de: „Tetrachlorethen“
- Luftreinhaltung bei Chemischen Reinigungen. (Memento des Originals vom 1. März 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Umweltportal auf Berlin.de, abgerufen am 9. Dezember 2010.
- Text der Anlage 2 (zu § 6 Absatz 2) der Trinkwasserverordnung.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Tetrachloroethylene, abgerufen am 26. März 2019.


