Milchsäuregärung
Milchsäuregärung bezeichnet Prozesse des Energiestoffwechsels bei Lebewesen, bei denen Glucose und andere Monosaccharide zu Milchsäure abgebaut werden. Dabei können auch noch andere Endprodukte entstehen. Es sind exergone chemische Umsetzungen, die den Lebewesen als Energiequelle dienen.
| Übergeordnet |
| Gärung |
| Gene Ontology |
|---|
| QuickGO |
Neben den Milchsäurebakterien, welche Milchsäure aus Zuckern bilden, nutzen aber auch manche Pilze, Pflanzen und Tiere (wie der Mensch) bei Sauerstoffmangel die Milchsäuregärung (→ Hypoxämie). Bei Menschen und anderen Tieren dient die Milchsäuregärung im Regelfall jedoch zur Energiegewinnung aus Glucose in Muskelzellen, die zur oxidativen Weiterverstoffwechselung nicht oder nur eingeschränkt befähigt sind – vgl. hierzu den Abschnitt Milchsäuregärung in Säugetierzellen.
Biochemischer Ablauf
Nach den gebildeten Hauptendprodukten und den Abbauwegen unterscheidet man verschiedene Typen der Milchsäuregärung:
- homofermentative Milchsäuregärung, bei der als Hauptendprodukt nur Milchsäure gebildet wird,
- heterofermentative Milchsäuregärung, bei der als Hauptendprodukte neben Milchsäure im Fall von Hexosen-Abbau Ethanol sowie Kohlenstoffdioxid, im Fall von Pentosen-Abbau Essigsäure gebildet werden,
- Milchsäuregärung durch Bifidobacterium, bei der als Hauptendprodukte Milchsäure und Essigsäure gebildet werden.
Disaccharide werden zunächst in Monosaccharide gespalten.
Homofermentative Milchsäuregärung
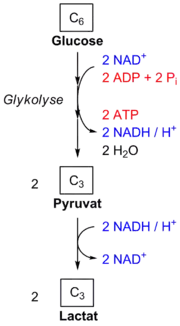
Bei der homofermentativen Milchsäurebildung werden die Monosaccharide zu Milchsäure umgesetzt, welche unter physiologischen Bedingungen dissoziiert in Lactat-Ionen und Protonen vorliegt.
Dabei wird Glucose zunächst in der Glykolyse zu Pyruvat abgebaut. Dieses wird vom Enzym Laktatdehydrogenase mit dem bei der Oxidation von Glycerinaldehydphosphat zu Phosphoglycerat gebildeten Coenzym NADH zu Lactat (Anion der Milchsäure) reduziert, das NADH wird dabei zu NAD+ oxidiert.
Im Verlauf der homofermentativen Gärung von Glucose werden je Molekül Glucose je zwei Moleküle Lactat und Adenosintriphosphat gebildet, so dass die Summengleichung der homofermentativen Milchsäuregärung wie folgt lautet:
Also reagiert ein Glucose-Molekül mit zwei Adenosindiphosphat (ADP)-Molekülen und zwei freien Phosphaten zu zwei Milchsäure-Molekülen, zwei Protonen, zwei Adenosintriphosphat (ATP)-Molekülen und zwei Molekülen Wasser.
Die Nettoenergieausbeute beträgt also 2 Moleküle ATP je Molekül Glucose.
Das Lactat kann in Säugetierzellen nicht weiter verstoffwechselt werden, sondern nur – falls in ausreichender Menge NAD zur Verfügung steht – zurück in Pyruvat umgewandelt werden. Daher wird es auch als „Stoffwechselsackgasse“ bezeichnet.[1]
Manche Mikroorganismen wie beispielsweise Clostridium propionicum oder Megasphaera elsdenii dagegen können Lactat noch weiter abbauen, beispielsweise zu Propionat und Acetat in der Propionsäuregärung.
Heterofermentative Milchsäuregärung
Im Gegensatz zur homofermentativen Gärung treten bei der heterofermentativen Milchsäuregärung auch die Abbauprodukte Kohlendioxid, Acetat (Essigsäure) und Ethanol (Alkohol) auf. Neben der Hefe Kluyveromyces lactis[2] sind dabei überwiegend Milchsäurebakterien aktiv, denen das Enzym Aldolase fehlt. Dieses ist für die Glykolyse zur Spaltung von Fructose-1,6-bisphosphat in die beiden Phosphotriosen Dihydroxyacetonphosphat und Glycerinaldehydphosphat erforderlich. Heterofermentative Milchsäuregärer können durch diesen speziellen Stoffwechselweg sowohl Hexosen (wie beispielsweise Glucose oder Fructose), als auch insbesondere Pentosen (Xylose, Ribose) über Xylulose-5-phosphat abbauen. Typische Vertreter sind die obligat heterofermentativen Milchsäuregärer Oenococcus oeni und Leuconostoc mesenteroides, sowie die fakultativen Gärer Lactobacillus pentosus und Lactobacillus plantarum. Siehe auch: Lactobacillaceae.
Biochemie
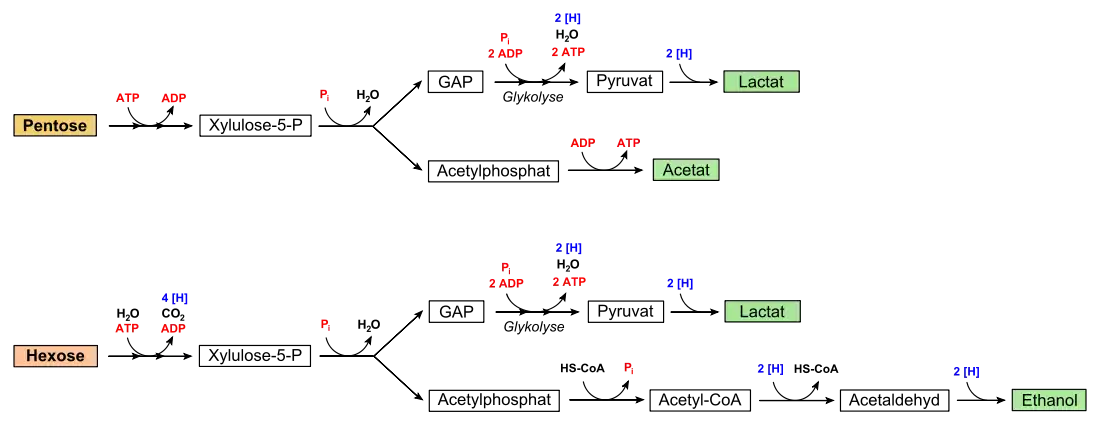
Heterofermentative Milchsäurebakterien sind auf den Abbau von Pentosen spezialisiert. Diese wird unter Adenosintriphosphat (ATP)-Verbrauch in Pentose-5-phosphat überführt und in Xylulose-5-phosphat isomerisiert, was eine Epimerase (EC 5.1.3.1) katalysiert. Das Produkt wird von dem Schlüsselenzym des Stoffwechselweges, der Phosphoketolase (EC 4.1.2.9), unter Einbeziehung eines anorganischen Phosphates (Pi) in die Triose Glycerinaldehydphosphat (GAP) und Acetylphosphat[3] gespalten. Glycerinaldehydphosphat wird im Zuge der Glykolyse regulär zu Pyruvat umgesetzt, wobei zwei Moleküle ATP sowie ein Molekül NADH gewonnen werden. Dieses NADH wird reoxidiert, indem Pyruvat zu Lactat reduziert wird. Diese Reaktion entspricht dem letzten Schritt der homofermentativen Milchsäuregärung (siehe oben).
Das bei der Spaltung erhaltene Acetylphosphat wird zu Acetat umgesetzt. Die energiereiche Säureanhydridbindung wird genutzt, um ATP über Substratkettenphosphorylierung zu gewinnen. Daher wird bei diesem Schritt ATP aufgebaut, die Reaktion katalysiert eine Acetatkinase (EC 2.7.2.1).
Der Abbau von Pentosen wird auch als Phosphoketolaseweg bezeichnet.[4] Die Nettoenergieausbeute beträgt also 2 Moleküle ATP je Molekül Pentose.
Auch Hexosen können verwertet werden. Hierbei wird diese, beispielsweise Glucose, wie bereits mit den Eingangsschritten des Entner-Doudoroff-Weges durch eine Hexokinase zunächst zu Glucose-6-phosphat durch ATP-Verbrauch aktiviert. Dieses oxidiert eine Glucose-6-phosphat-Dehydrogenase zu 6-Phosphoglucono-δ-Lacton unter NADP+-Verbrauch. Das Lacton wird anschließend durch eine 6-Phosphoglucolactonase zu 6-Phosphogluconat hydrolysiert. Dieses wird dann zu Ribulose-5-phosphat decarboxyliert und mit NADP+ oxidiert, was eine Phosphogluconatdehydrogenase (EC 1.1.1.44) katalysiert. Ribulose-5-phosphat wird dann zu Xylulose-5-phosphat epimerisiert und schließlich durch die Phosphoketolase gespalten. Im Gegensatz zum Abbauweg von Pentosen wird jedoch kein Acetat gebildet, da vier zusätzliche Reduktionsäquivalente anfallen, die wieder reoxidiert werden müssen. Dazu wird das entstandene Acetylphosphat über Acetyl-CoA und Acetaldehyd zu Ethanol reduziert.
In der Bilanz wird von den zwei gewonnenen ATP eins zur Phosphorylierung der abzubauenden Glucose verwendet, beim Acetatzweig aber keines gebildet. Infolgedessen beträgt die Nettoenergieausbeute bei der heterofermentativen Milchsäuregärung für Hexosen nur ein Molekül ATP je Hexose:
Variationen
Bei der heterofermentativen Milchsäuregärung kann die Phosphoketolase auch Fructose-6-phosphat als Substrat akzeptieren, dabei entsteht neben Acetylphosphat auch Erythrose-4-phosphat. Letzteres wird zu Erythrit-4-phosphat reduziert und nach Phosphatabspaltung zu Erythrit umgesetzt. Dieser als „Erythritweg“ bezeichnete Nebenweg hat indes nur eine geringe Aktivität.
Alternativ kann auch das Glycerinaldehyd zu Glycerin abgebaut werden. Hierbei wird Glycerinaldehyd zunächst zu Glycerin-1-phosphat reduziert und dann zu Glycerin hydrolysiert.
Bedeutung
Da bei Unfähigkeit zur Glykolyse wegen des Fehlens von Aldolase der Abbau von Pentosen günstiger ist als der von Hexosen, sind heterofermentative Milchsäuregärer auf den Abbau von Pentosen spezialisiert.[5] Diese stammen beispielsweise aus Pflanzenmaterial, das diese Bakterien abbauen. Neben Hexosen kommen in größeren Mengen Pentosen auch im Traubenmost, Wein oder Sauerteig vor, so dass viele heterofermentative Milchsäuregärer dort wachsen.
Die Wachstumsraten von heterofermentativen Milchsäuregärern sind beim Abbau von Hexosen niedriger als beim Abbau von Pentosen, da die Wasserstoffüberträger langsamer reoxidiert werden. Der Grund dafür ist die geringe Aktivität der Acetaldehyddehydrogenase. Außerdem wird für diesen Abbauweg Coenzym A als Cofaktor benötigt. Daher ist die Versorgung mit Pantothensäure für die Aufrechterhaltung des Abbauweges nötig. Andernfalls wird die Bildung von Ethanol inhibiert. Damit die Gärung ablaufen kann, müssen die Wasserstoffüberträger durch die Bildung von Glycerin bzw. Erythrit reoxidiert werden (Coenzym A-unabhängig). Da beim Abbau von Pentosen Coenzym A nicht benötigt wird, hat dort ein Mangel von Pantothensäure keinen direkten Einfluss.
Bifidobacterium-Gärung
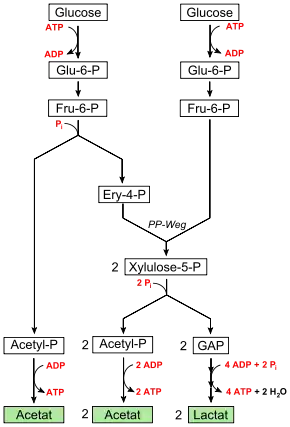
Das Milchsäurebakterium Bifidobacterium bifidum besitzt ebenso wie heterofermentative Milchsäurebakterien keine Aldolase, umgeht den Aldolase-Schritt jedoch auf andere Weise: Fructose-6-phosphat wird phosphorolytisch zu Erythrose-4-phosphat und Acetylphosphat gespalten. Erythrose-4-phosphat wird mit einem weiteren Molekül Fructose-6-phosphat in Transaldolase- und Transketolase-Reaktionen zu zwei Molekülen Xylulose-5-phosphat umgesetzt, die beide phosphorolytisch durch eine Phosphoketolase zu Glycerinaldehydphosphat und Acetylphosphat gespalten werden (Pentosephosphatweg). Mit den drei Molekülen Acetylphosphat werden 3 Adenosindiphosphat (ADP) zu 3 Adenosintriphosphat (ATP) phosphoryliert, wodurch Energie in Form von drei Molekülen ATP konserviert und Essigsäure als eins der beiden Endprodukte gebildet wird. Die beiden Moleküle Glycerinaldehydphosphat werden wie bei anderen Milchsäurebakterien zu Milchsäure, dem zweiten Endprodukt der Gärung, umgesetzt, wobei vier Moleküle ADP zu ATP phosphoryliert werden. Die Nettoenergieausbeute beträgt also 2,5 Moleküle ATP je Molekül Glucose.
Beispiele für das Auftreten von Milchsäuregärung
Milchsäuregärung durch Milchsäurebakterien
Bakterien, die Milchsäure als einziges oder hauptsächliches Gärungsprodukt erzeugen, werden als Milchsäurebakterien bezeichnet. Sie bilden eine Ordnung grampositiver Bakterien und zeichnen sich durch das Fehlen der für die Elektronentransportphosphorylierung nötigen Porphyrine und Cytochrome aus, so dass sie ihre Energie nur mittels an den Zuckerabbau gekoppelter Substratkettenphosphorylierung gewinnen können.
Man unterscheidet dabei:
- homofermentative Stämme von Milchsäurebakterien, die Milchsäure als einziges Hauptendprodukt bilden. Hierzu gehören unter anderem die Gattungen Streptococcus, Enterococcus, Lactococcus und Pediococcus sowie einige Angehörige der Gattung Lactobacillus.
- heterofermentative Stämme von Milchsäurebakterien, die als Hauptendprodukte neben Milchsäure und Kohlenstoffdioxid bei Hexosen-Abbau Ethanol und bei Pentosen-Abbau Essigsäure bilden. Diesen Bakterien mangelt es an Aldolase, dem Schlüsselenzym der Glykolyse. Hierzu gehören die Gattungen Leuconostoc und einige Angehörige der Gattung Lactobacillus, hauptsächlich Lactobacillus buchneri.
- Die Bakterien-Art Bifidobacterium bifidum, die die Bifidobacterium-Gärung durchführt.[6]
Milchsäuregärung in Säugetierzellen
Im Vergleich zur Atmung wird bei Gärungen nur eine geringe Menge Energie gewonnen, da dabei statt Citratzyklus und anschließender Atmungskette nur die Substratkettenphosphorylierung genutzt wird. Die Gärung ist jedoch ein Weg, um durch Substratkettenphosphorylierung schnell Adenosintriphosphat (ATP) zu bilden, ohne auf Sauerstoff angewiesen zu sein.
Bei Säugern, zu denen auch der Mensch zählt, gibt es zahlreiche Beispiele dafür, dass Zellen ihre Energie aus der (homofermentativen) Milchsäuregärung decken. So gewinnen schnell zuckende weiße Muskelfasern (FT-Fasern) wegen ihrer geringeren Ausstattung mit Mitochondrien und den entsprechenden Enzymen[7] im Vergleich zu langsam zuckenden roten Muskelfasern (ST-Fasern)[8] ihre Energie bereits bei geringer Intensität durch Milchsäuregärung.
Bei höherer Intensität wird ein höherer Anteil an FT-Fasern rekrutiert. Hierdurch fällt auch Laktat in größeren Mengen an. Solange das gesamte Organ- und Muskelsystem mit dem Transport (vgl. unten) und der weiteren Verstoffwechselung (Laktatutilisation) aber nicht überfordert ist, kann der Körper einen Laktat-Steady-State in Bezug auf das Blut-Laktat aufrechterhalten. Bei sehr hohen Intensitäten (beim Sprint von vornherein) ist eine ausreichend schnelle Energiebereitstellung nur durch eine hohe Glykolyse-Rate möglich, wodurch es zu einem exponentiellen Anstieg des Blutlaktats kommt.
Das bei der Gärung anfallende Laktat wird teilweise während, teilweise im Anschluss an die erhöhte Leistungsabforderung auf verschiedenen Wegen weiter verstoffwechselt.[9] Laktat wird durch einen Monocarboxylat-Transporter 1 in das Blut abgegeben und aus diesem von Leberzellen oder zur Laktatoxidation befähigten Muskelzellen der Skelettmuskulatur und des Herzmuskels aufgenommen und anschließend zu Pyruvat oxidiert („Zell-Zell-Lactat-Shuttle“). Pyruvat kann über den Citratzyklus zur weiteren Energiegewinnung genutzt werden oder – in der Leber – wieder zu Glucose aufgebaut (Gluconeogenese) und den Muskeln und Organen über den Blutkreislauf zugeführt werden (Cori-Zyklus).
Auch andere Organe beziehen ihre Energie aus der Milchsäuregärung, und zwar dann, wenn sie mit Sauerstoff unterversorgt werden.[10] Die dabei ansteigende Lactatkonzentration im Blut führt zu einem Absinken des pH-Wertes, was unter besonderen Umständen (z. B. Erstickung) zu einer Laktatazidose führen kann.
Andere, spezialisierte Zellen beziehen Adenosintriphosphat (ATP) ausschließlich aus dem anaeroben Abbau von Glucose in der Milchsäuregärung. Erythrozyten beispielsweise können wegen fehlender Mitochondrien Glucose nur unter anaeroben Bedingungen verstoffwechseln. Da die Hornhaut gefäßfrei ist, kann Sauerstoff nur durch Diffusion an die Hornhautzellen gelangen und nicht durch den Blutstrom. Dies begrenzt das Angebot an Sauerstoff, so dass eine konstante Energieversorgung nur über die Milchsäuregärung sichergestellt wird.
Auch bei größeren Tieren gelangt häufig Sauerstoff nicht schnell genug in die Gewebe, so dass nötige Energie durch Gärung gewonnen wird.[11] Alligatoren und Krokodile vermögen blitzschnelle Angriffe zu starten, die viel Energie kosten. Diese Energie stammt aus der Milchsäuregärung. Auch Elefanten, Nashörner, Wale und Robben sind auf die Milchsäuregärung angewiesen.
Milchsäuregärung zur Herstellung von Lebens- und Futtermitteln
Zur Konservierung von Lebensmitteln wird die Milchsäuregärung mindestens seit der Jungsteinzeit eingesetzt. Durch die Milchsäurebildung wird das Lebensmittel gesäuert und Verderbniserreger werden fast vollständig in ihrer Aktivität gehemmt oder sogar abgetötet. Beispiele sind Sauermilchprodukte wie Joghurt, Quark und Buttermilch, Brottrunk, Sauerkraut, Salzgurken, Saure Bohnen, das koreanische Kimchi, das japanische Tsukemono und andere Sauergemüse.
Die Milchsäuregärung wird auch zur Veredelung einiger Biersorten genutzt wie Lambic, Berliner Weiße, Gose und andere, was bei diesen veredelten Biersorten zu einer sehr langen Haltbarkeit führt.
Außerdem wird die Milchsäuregärung zum Brotbacken mit Sauerteig und zur Reifung von Rohwürsten wie Teewurst, Salami und anderen Rohwürsten angewendet.
Zur Milchsäuregärung bei Milchprodukten benötigen die Milchsäurebakterien das Enzym Lactase, welches unter Verwendung von H2O den Milchzucker Lactose (C12H22O11) in Glucose (C6H12O6) und Galactose (C6H12O6) umwandelt. Beide so entstandenen Zucker werden über einen oder mehrere der oben beschriebenen Wege umgesetzt.
Die Milchsäuregärung wird auch zur Konservierung von Pflanzenmaterial als Futtermittel in der Landwirtschaft eingesetzt. Man bezeichnet das in der Regel in Silos durchgeführte Verfahren als Silierung und das Produkt als Silage. Bei der Silage-Bereitung wird das Pflanzenmaterial mit einem Trockenmassegehalt von 25 % – 50 % (optimal: etwa 34 %) meist gehäckselt oder kurzgeschnitten eingelagert (in Fahrsilos, Hochsilos oder in Folie eingewickelte Großballen). Durch sofortigen Luftabschluss nach Beendung der Befüllung kommt es zu einem Verbrauch des Restsauerstoffs durch aerobe Bakterien und Pilze. Im Anschluss setzt die anaerobe Gärung durch Milchsäurebildner (MSB; meist Milchsäurebakterien, aber auch andere) ein. Hierbei wird der Restzucker der Pflanzen in Milchsäure umgesetzt und dadurch das Material gesäuert, der pH-Wert auf etwa 4,0 – 4,5 abgesenkt. Bei diesem Wert werden die MSB selbst gehemmt, die bakteriellen Gärschädlinge werden bereits über einem pH-Wert von 4,5 gehemmt. Damit kommt die Gärung zum Stillstand und die Silage ist stabil.
Falls das Siliergut zu nass eingelagert wird, besteht die Gefahr, dass die Silage nicht stabil wird. Das zusätzliche Wasser in der Silage wirkt puffernd, so dass zur Absenkung des pH-Werts auf 4,0 – 4,5 deutlich mehr Milchsäure notwendig ist. Da Milchsäure aus dem Restzucker entsteht, ist unter Umständen zu wenig davon als Substrat für die MSB vorhanden. Auch werden Gärschädlinge (Clostridien, Hefen und coliforme Bakterien) durch die langsamere Säuerung nicht schnell genug inaktiviert. Da diese Gärschädlinge ihrerseits Zucker als Substrat verwenden und als Produkte schwächere Säuren (u. a. Essigsäure, Buttersäure) ausscheiden, wird der vorhandene Zucker nicht so effektiv für die Säuerung, die Absenkung des pH-Werts verwendet – und im Falle von Buttersäure daneben auch ein sehr unangenehmer Geruch der Silage erzeugt. Daneben können einige Gärschädlinge auch Milchsäure in Buttersäure überführen, was ebenfalls ungünstig für die pH-Absenkung ist. Folge eines zu hohen pH-Werts ist, dass die Silagequalität sich durch die Stoffwechselaktivität schädlicher Organismen verschlechtert: Der Energiegehalt sinkt, außerdem wird aus Proteinen Nicht-Protein-Stickstoff (NPN), hier v. a. Ammoniak abgespalten.
Bei einem Wassergehalt von >70 % kommt es daneben zum Austritt von Sickersaft, der sehr nährstoffreich ist und damit die Qualität der Silage ebenfalls vermindert.
Zu trocken eingelagertes Siliergut führt zu einer nicht ausreichenden Verdichtung des Pflanzenmaterials des sogenannten Silostocks. In der Folge ist dadurch mehr Restsauerstoff in dem Stock vorhanden. Vor allem aerobe Hefen nutzen unter diesen Bedingungen Zucker zum Wachstum, was allerdings zunächst wenig Einfluss auf den pH-Wert hat, es sei denn, es ist zu wenig Zucker für die Milchsäuregärung vorhanden. Das Problem zu trocken eingelagerten Siliergutes ist vor allem bei Maissilagen oder Getreide-Ganzpflanzensilagen (GPS) zu erwarten, die ohnehin ausreichend Zucker haben. Sobald der Sauerstoff verbraucht ist, kommt das Wachstum der Hefen zum Stillstand. Der später durch die Milchsäuregärung verursachte niedrige pH-Wert tötet die Hefen nicht, sondern inaktiviert sie nur. Daher ist beim Öffnen des Silostockes mit weiterem Wachstum der Hefen zu rechnen. Wegen des hohen Hefe-Gehalts aufgrund des vorherigen ausgiebigen Wachstums vermehren sich die Hefen jetzt exponentiell, was zu einer Erwärmung der Silage führt (Nacherwärmung der Silage; geringe aerobe Stabilität). In warmem Siliergut sind gute Lebensbedingungen für coliforme Bakterien erreicht, die ihrerseits die Milchsäure in Buttersäure umwandeln, so den pH-Wert der Silage anheben und schließlich zum Verderb dieser führen.
Neben der Verschlechterung der Qualität der Silage durch Energieverluste und Proteinabbau ist fast immer damit zu rechnen, dass die Ausscheidungsprodukte der Gärschädlinge, insbesondere der Hefen und Pilze, toxisch sind. Diese führen zu einer Leistungsdepression bei den Tieren, an die diese Silage, soweit nicht ausreichend verschnitten, verfüttert wird.
Literatur
- Zaunmüller, T. et al. (2006): Variations in the energy metabolism of biotechnologically relevant heterofermentative lactic acid bacteria during growth on sugars and organic acids. In: Appl Microbiol Biotechnol. 72(3):421–429; PMID 16826375; doi:10.1007/s00253-006-0514-3
- Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. Thieme Verlag Stuttgart, 8. Auflage 2007, ISBN 3-13-444608-1, S. 353ff.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008, ISBN 978-3-13-144861-3, S. 376ff.
- Neil A. Campbell: Biologie. Spektrum Lehrbuch, 6. Auflage, Herausgegeben von J.Markl, Spektrum Verlag, Heidelberg, Berlin 2003, ISBN 3-8274-1352-4.
- Michael T. Madigan, John M. Martinko: Brock Mikrobiologie 11. Auflage, Pearson Studium, München, 2006, ISBN 3-8273-7187-2.
Einzelnachweise
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 460.
- Kluyveromyces lactis, In: MycoCosm.jgi.doe.gov; abgerufen im Januar 2020
- Acetylphosphat, Lexikon der Biologie; Acetylphosphat, Lexikon der Chemie. Auf spektrum.de.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008; ISBN 978-3-13-144861-3; S. 355.
- Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. Thieme Verlag Stuttgart; 8. Auflage 2007; ISBN 3-13-444608-1; S. 355.
- Wytske de Vries and A. H. Stouthamer: Pathway of Glucose Fermentation in Relation to the Taxonomy of Bifidobacteria. In: Journal of Bacteriology. Band 93(2), 1967, S. 574–576 (englisch).
- Benninghoff/Drenckhahn (Hrsg.): Anatomie, Bd. 1 – Makroskopische Anatomie, Histologie, Embryologie, Zellbiologie, Mchn. & Jena (16. Aufl.) 2003, S. 160f.
- Paul Haber: Leitfaden zur medizinischen Trainingsberatung. Rehabilitation bis Leistungssport. Springer, Wien; 3., aktualisierte u. erw. Auflage 2009; ISBN 978-3-211-75635-5; S. 62.
- vgl. SCHMIDT/LANG: Physiologie des Menschen, 30. Auflage, Heidelberg 2007, S. 931, Abschnitt "Laktatutilisation".
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 460f.
- Albert L. Lehninger, David L. Nelson und Michael M. Cox: Lehninger Biochemie. Springer, Berlin; 3., vollst. überarb. u. erw. Auflage 2009; ISBN 978-3-540-41813-9; S. 584ff.