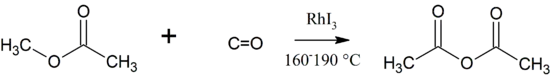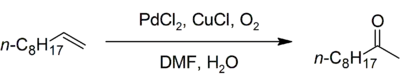Wacker-Hoechst-Verfahren
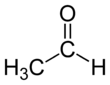
Das Wacker-Hoechst-Verfahren ist ein großtechnischer Prozess der chemischen Industrie, bei dem durch die Oxidation von Ethylen in Gegenwart von Palladium(II)-chlorid als Katalysator Acetaldehyd entsteht. Der Sauerstoff der entstehenden Aldehydfunktion stammt dabei aus dem als Lösungsmittel verwendeten Wasser; der im Verfahren verwendete Sauerstoff dient der Reoxidation des Katalysators.
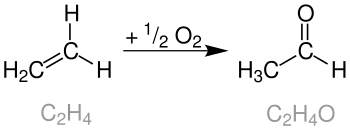
Die installierte Produktionskapazität betrug 2009 etwa zwei Millionen Jahrestonnen. Acetaldehyd ist ein wichtiger Ausgangsstoff der chemischen Industrie und dient hauptsächlich der Herstellung von Essigsäure und Essigsäureanhydrid; weitere Folgeprodukte sind 1,3-Butadien, Acrolein oder Pentaerythrit.
Walter Hafner, Jürgen Smidt, Reinhard Jira und weitere Mitarbeiter der Wacker Chemie entwickelten gegen Ende der 1950er Jahre das Verfahren im Wacker-Forschungszentrum, dem Consortium für elektrochemische Industrie. Es nutzte als erstes Verfahren im industriellen Maßstab eine Palladiumverbindung als Katalysator.
Die Veröffentlichung des Verfahrens bewirkte eine rege Forschungstätigkeit auf dem Gebiet der palladiumkatalysierten Olefinreaktionen im technischen und chemisch-präparativen Bereich und führte zu zahlreichen mechanistischen Studien der Reaktion. Neben den vielfältigen ausgearbeiteten Synthesewegen bei höheren Olefinen entwickelte Hoechst basierend auf dem Wacker-Hoechst-Verfahren ein technisches Verfahren, bei dem aus Propylen das Lösungsmittel Aceton gewonnen wird, welches wiederum Ausgangsstoff für viele Synthesen ist.
Geschichte
Die direkt nach dem Zweiten Weltkrieg in Deutschland in Betrieb genommenen großtechnischen Chemie-Verfahren beruhten noch auf der Kohlechemie der Vorkriegs- und Kriegszeit. Einer der Grundbausteine dieser Chemie war Acetylen aus der Hydrolyse von Calciumcarbid, das wiederum aus Calciumoxid und Kohle gewonnen wurde. Aus Acetylen stellte die Wacker-Chemie mittels des Ersten Wacker-Verfahrens den wichtigen Synthesebaustein Acetaldehyd her.[1]
Die Herstellung von Acetylen erforderte jedoch einen hohen Energieeinsatz, während Olefine aus Erdöl nach dem Krieg leichter zugänglich wurden und damit preiswertere Rohmaterialien für die chemische Synthese darstellten. Ethylen aus den petrochemischen Crackeranlagen stand ab Mitte der 1950er Jahre in großen Mengen zur Verfügung.[1] Verfahren wie die von der Azienda Nazionale Idrogenazione Combustibili (ANIC) in Ravenna, Italien, eingesetzte Oxidation von Ethylen zu Acetylen, welches wiederum nach dem Ersten Wacker-Verfahren zu Acetaldehyd konvertiert wurde, erwiesen sich als energetisch ungünstig und fanden keine Verbreitung.[2]
Für die Darstellung von Acetaldehyd suchte Wacker daher ein Verfahren auf Basis der direkten Oxidation von Ethylen. Ausgangspunkt dieser Suche war die bereits seit 1894 von Francis C. Phillips entdeckte stöchiometrische Oxidation von Ethen zu Acetaldehyd mittels Palladium(II)-chlorid in wässriger Lösung.[3] Bei dieser Reaktion wurde das Palladiumsalz zu metallischem Palladium reduziert, fiel dabei aus und stand für weitere Oxidationsreaktionen nicht zur Verfügung.[1]
Forscher der Wacker-Chemie suchten Ende der 1950er Jahre nach einer katalytischen Variante dieser Reaktion.[4] Zunächst fokussierte sich die Suche auf ein heterogenkatalytisches Verfahren. Hafner stellte bei Versuchen, bei denen er Ethylen und Sauerstoff mit Spuren von Wasserstoff über einen heterogenen Palladiumkontakt leitete, olfaktorisch Spuren von Acetaldehyd fest.[1] Neben den heterogenkatalytischen Gasphasenreaktionen untersuchte das Consortium auch die Reaktion von Ethylen in wässriger Phase. Die Beobachtung, dass das metallische Palladium mit Kupfer(II)-chlorid wieder zum Palladium(II)-chlorid oxidiert werden kann, war dabei mitentscheidend für die Entwicklung des katalytischen Verfahrens in wässriger Lösung. Die Oxidation von Kupfer(I)- zu Kupfer(II)-chlorid durch Sauerstoff war als schnelle Reaktion bekannt.[5] Eine ähnliche Methode der Katalysatorregenerierung, die Reoxidation von metallischem Quecksilber mittels Eisen(III)-chlorid, war schon aus dem Ersten Wacker-Verfahren bekannt.[4]
Die Wacker-Chemie entschied sich, das Patent in drei Patentanträge aufzuteilen. Die neu zu bauende Anlage sollte in Köln in der Nähe einer petrochemischen Anlage der Esso, die das Ethylen liefern sollte, errichtet werden. In Zusammenhang mit den Gesprächen zum Erwerb des Grundstücks, bei dem Hoechst als Teilhaber der Wacker-Chemie zustimmen musste, wurden Einzelheiten des Verfahrens an Hoechst weitergegeben.[4] Hoechst nahm daraufhin selbst Forschungstätigkeiten zur Ethylenoxidation auf und platzierte ein eigenes Patent zwischen der zweiten und dritten Patentanmeldung der Wacker-Chemie. Hoechst erhielt dadurch einen Teilanspruch an dem Verfahren, worauf Wacker und Hoechst das Gemeinschaftsunternehmen Aldehyd GmbH gründeten, welche die Vermarktung des Patents übernahm.[1] Da für den vorgesehenen Kölner Standort kein reiner Sauerstoff zu akzeptablen Preisen zu Verfügung stand, entwickelte die Wacker-Chemie im Folgenden ein Zwei-Stufen-Verfahren, das mit Luftsauerstoff als Oxidationsmittel arbeitete. Die erste Anlage nach dem Zwei-Stufen-Verfahren wurde im Januar 1960 in Köln in Betrieb genommen (Lage).[1] Wolfgang Hafner und Jürgen Smidt wurden für ihre Forschungen und die Entwicklung des Verfahrens 1962 mit dem DECHEMA-Preis ausgezeichnet.[6]
Das Wacker-Hoechst-Verfahren verdrängte im Laufe weniger Jahre alternative Verfahren wie die katalytische Dehydrierung oder die Oxidation von Ethanol.[7] Es gehörte zu den ersten chemisch-technischen Verfahren, die auf die Bedeutung von Alkenen hinwiesen. Bereits 1969, nur wenige Jahre nach der Inbetriebnahme der ersten Anlage, betrug die installierte Kapazität etwa 350.000 Jahrestonnen.[8] Um die Jahrtausendwende betrug die installierte Kapazität etwa zwei Millionen Jahrestonnen.[1] Es war die allgemeine Meinung, dass „die Erfindung des Wacker-Verfahrens einen Triumph des gesunden Menschenverstandes“ darstellt.[9]
Durch die Entwicklung neuerer Verfahren wie dem Monsanto-Prozess und dem Cativa-Prozess zur Herstellung von Essigsäure aus Basis von Methanol und Kohlenstoffmonoxid verliert das Wacker-Hoechst-Verfahren an Bedeutung.[10]
Essigsäureanhydrid lässt sich aus Essigsäuremethylester und Kohlenstoffmonoxid nach dem Tennessee-Eastman-Essigsäureanhydrid-Prozess gewinnen.[11]
Katalysator
Palladium(II)-chlorid wird durch das Auflösen von metallischem Palladium in Königswasser gewonnen. Es löst sich leicht in Salzsäure unter Bildung des Tetrachloropalladats.
Als Reoxidationsmittel für das im Prozess anfallende metallische Palladium dienen neben Kupferchlorid auch Kupfer(II)-acetat, Kupfer(II)-nitrat, Eisen(III)-chlorid und weitere Oxidationsmittel, etwa Salpetersäure oder Wasserstoffperoxid. Bei der Verwendung chloridfreier Oxidationsmittel wird die Bildung chlorierter Nebenprodukte, unter anderem Chloracetaldehyd, reduziert.[12]
Verfahren
Das Wacker-Hoechst-Verfahren kann ein- oder zweistufig durchgeführt werden. Die Ausbeute liegt bezogen auf Ethylen für beide Verfahren bei etwa 95 %.[7] Nebenprodukte sind chlorierte und höher oxidierte Produkte des Ethylens und des Acetaldehyds. Im Zwei-Stufen-Verfahren ist die Anforderung an die Reinheit des Ethens geringer als im einstufigen Verfahren. Allerdings sind die Investitionskosten in die Anlagen sowie der Energieverbrauch beim zweistufigen Verfahren höher, weshalb das einstufige Verfahren bevorzugt eingesetzt wird, wenn die Versorgung mit reinem Sauerstoff gewährleistet ist.
Ein-Stufen-Verfahren
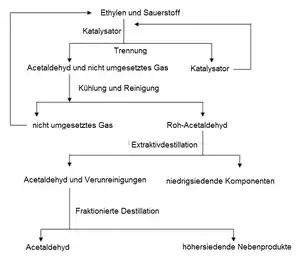
Beim einstufigen Verfahren wird in einem Reaktor die Oxidation des Ethens sowie die Regeneration des Katalysators bei Temperaturen von etwa 120 bis 130 °C und Drücken von 3 bis 4 bar durchgeführt. Die Regeneration erfolgt mit reinem Sauerstoff, außerdem muss das verwendete Ethen sehr rein sein. Um unterhalb der Explosionsgrenze zu bleiben, wird mit einem Überschuss an Ethen gearbeitet, dadurch sinkt die Ausbeute auf etwa 35 %. Nicht umgesetztes Ethen kann jedoch erneut in den Reaktor geführt werden.
Das entstehende Roh-Acetaldehyd enthält niedrigsiedende Komponenten wie Methylchlorid, Ethylchlorid oder Kohlenstoffdioxid, die durch Extraktivdestillation abgetrennt werden.[13] Die dabei entstehende Acetaldehyd-Fraktion enthält noch höhersiedende Anteile wie chloriertes Acetaldehyd, Chloroform, Methylenchlorid, 1,2-Dichlorethan, 2-Chlorethanol und Essigsäure, die durch fraktionierende Destillation abgetrennt werden.[13]
Die verwendeten Reaktoren sind wegen der korrosiven Eigenschaften der Katalysatorlösung mit einer keramischen Auskleidung versehen. Aus demselben Grund sind die Rohrleitungen und Pumpen aus Titan gefertigt. Die Verwendung dieser schlecht wärmeleitenden Materialien ist möglich, da die Reaktionswärme durch die Verdampfung von Acetaldehyd und Wasser abgeführt werden kann.[14]
Zwei-Stufen-Verfahren
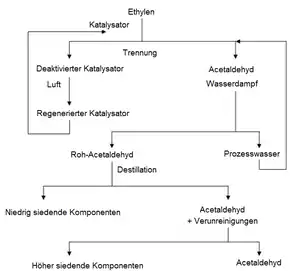
Beim zweistufigen Verfahren sind die Oxidation des Ethens und die Regeneration des Katalysators räumlich getrennt. Zunächst reagiert das Ethen in Abwesenheit von Sauerstoff im Oxidationsreaktor aus Titan, meist einem Blasensäulenreaktor, bei Drücken von etwa 10 bar und Temperaturen zwischen 100 und 110 °C stöchiometrisch mit dem Palladiumchlorid und dem Prozesswasser zu Acetaldehyd und Palladiummetall. Nach Entspannung auf Normaldruck wird das Roh-Acetaldehyd vom Prozesswasser getrennt und anschließend destillativ gereinigt.[14]
Die palladium- und kupferhaltige Lösung wird in einen weiteren Blasensäulereaktor gepumpt und dort regeneriert. Es kann mit Luftsauerstoff regeneriert werden.
Die erste Anlage nach dem Zwei-Stufen-Verfahren nahm die Wacker-Chemie im Januar 1960 im Werk Köln-Merkenich in Betrieb. Es handelte sich dabei um die weltweit erste Chemieanlage mit Apparaten aus Titan.[4]
Produkte
Das Hauptprodukt des Wacker-Hoechst-Verfahrens ist Acetaldehyd, welches eine reiche Folgechemie aufweist. Etwa 80 % des produzierten Acetaldehyds werden zu Essigsäure und Essigsäureanhydrid weiterverarbeitet, aus den verbleibenden 20 % wird eine Vielzahl von weiteren Produkten hergestellt. Die Herstellung der Essigsäure erfolgte durch die Oxidation von Acetaldehyd unter Verwendung von Mangan(II)-acetat als Katalysator, einem Verfahren, das ebenfalls von der Wacker-Chemie entwickelt wurde:[4]
Das Mangansalz katalysiert dabei den Zerfall der primär entstehenden Peroxyessigsäure.
Die Herstellung von 1,3-Butadien erfolgte zum Beispiel im Lebedew-Prozess über die Aldoladdition zweier Moleküle Acetaldehyd
zum Crotonaldehyd, das mit Ethanol bei Temperaturen um 380 bis 500 °C unter Bildung von 1,3-Butadien, Acetaldehyd und Wasser reagiert.[15] In einem dem Lebedew-Prozess ähnlichen Prozess, der vom russischen Chemiker Iwan Ostromislenski entwickelt wurde, reagiert Ethanol direkt mit Acetaldehyd bei Temperaturen von etwa 325 bis 350 °C über einem Tantal-modifizierten Silica-Katalysator zu 1,3-Butadien. Acrolein entsteht bei der Aldoladdition von Formaldehyd an Acetaldehyd.[16] Pentaerythrit entsteht ebenfalls aus der Aldoladdition von Formaldehyd und Acetaldehyd.[17]
Reaktionsmechanismus

Der Reaktionsmechanismus wurde über Jahrzehnte intensiv untersucht, nicht nur wegen der industriellen Bedeutung der Reaktion, sondern auch weil sie den Beginn der katalytischen Palladiumchemie markierte.[5]
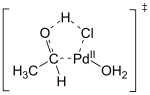
Im ersten Schritt des Reaktionsmechanismus entsteht aus Palladium(II)-chlorid, Ethen und einem Chloridion ein zum Zeise-Salz äquivalenter anionischer Palladium(II)-Ethen-Komplex, das Trichloridoethylenpalladinat(II)-Anion (oben rechts in der Abbildung). Aus Untersuchungen von Substitutionsreaktionen des Zeise-Salzes war bekannt, dass der Ethenligand einen starken trans-Effekt ausübt. Dadurch wird die Bindung des trans-ständigen Chloridoliganden geschwächt[18] und die Anlagerung von Wasser (eines Aquoliganden) unter Verdrängungen eines Chlorid-Liganden erleichtert. Durch diesen Austausch entsteht ein neutraler Palladium(II)-Ethen-Komplex (Abbildung Mitte rechts).[19] Durch Deprotonierung entsteht wieder ein anionischer Ethen-Hydroxo-Komplex. Durch Addition von Wasser und Insertion des Ethen-Liganden in die Pd-OH-Bindung entsteht ein 2-Hydroxyethyl-Komplex.[19]
Ein weiterer wichtiger Schritt im Wacker-Prozess ist die Migration des Wasserstoffs von Sauerstoff zu Chlorid und die Bildung der C-O-Doppelbindung (Abbildung unten bis oben links). Der genaue Mechanismus dieses Schritts ist nicht bekannt. Eine Hypothese ist eine β-Hydrid-Eliminierung in einem zyklischen viergliedrigen Übergangszustand:
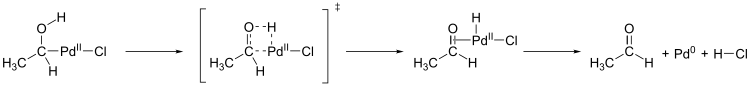 Wacker Hydrid-Eliminierung
Wacker Hydrid-Eliminierung
Berechnungen ergaben jedoch, dass ein viergliedriger Übergangszustand unter β-Hydrid-Eliminierung für diesen Reaktionsschritt energetisch ungünstig ist (151 kJ/mol). Ein durch Wassermoleküle unterstützter fünfgliedriger Übergangszustand mit anschließender reduktiver Elimination ist energetisch günstiger (78,6 kJ/mol) und wird damit als wahrscheinlicher angesehen:[20]
Der ablaufende katalytische Kreisprozess (siehe Abbildung) kann in folgenden Bilanzgleichungen zusammengefasst werden:
mit der Gesamtbilanz:
Die Teilreaktionen a) bis c) lassen sich als gekoppelte Teilreaktionen darstellen:[19]
Der genaue Mechanismus der Reaktion blieb lange Gegenstand kinetischer und mechanistischer Studien. Frühe kinetische Studien lieferten eine Geschwindigkeitsgleichung, die erster Ordnung bezüglich des Tetrachloropalladats und des Ethylens war sowie eine Inhibierung erster Ordnung bezüglich des Protons und zweiter Ordnung bezüglich des Chloridions zeigte.[5]
Während sich die inhibierende Wirkung des Chlorids durch die schnellen Gleichgewichtsreaktionen
erklären ließ, gab es für die inhibierende Wirkung des Protons mehrere Erklärungsansätze.[5]
Die Oxidation von nicht-deuteriertem Ethylen C2H4 in Schwerem Wasser D2O führte nur zur Bildung von nicht deuteriertem Acetaldehyd CH3CHO.[13] Umgekehrt führte die Oxidation von deuteriertem Ethylen C2D4 in normalem Wasser H2O nur zur Bildung von deuteriertem Acetaldehyd CD3CDO. Durch diese Versuche konnte die These, dass der Prozess über eine Vinylalkohol-Zwischenstufe verläuft, bei der ein Wasserstoffatom des Acetaldehyds, etwa über eine Keto-Enol-Tautomerie, aus dem Wasser stammen sollte, widerlegt werden.
Verfahrensvarianten
Wird im Wacker-Hoechst-Verfahren mit einem Gemisch aus Essigsäure und Alkaliacetaten statt Wasser als Lösungsmittel gearbeitet, entsteht Vinylacetat als Hauptprodukt, welches das Monomer zur Herstellung von Polyvinylacetat und damit dem Polyvinylalkohol darstellt.[21]
Dieses homogenkatalytische Verfahren wurde früh durch ein heterogenkatalytisches Oxidationsverfahren auf Basis eines Palladium-Kontakts verdrängt.[22] Neben Essigsäure können verschiedene andere Lösungsmittel verwendet werden. Mit Alkoholen als Lösungsmittel entstehen meist Acetale, mit Diolen erfolgt die Bildung von 1,3-Dioxolanen.[23]
Propylen kann mittels Wacker-Hoechst-Verfahren zu Aceton oxidiert werden. Die Reaktion läuft bei einer Temperatur von etwa 110 bis 120 °C und einem Druck von 10 bis 14 bar ab. Wie bei der Oxidation von Ethylen wird das metallisch anfallende Palladium mit Kupferchlorid reoxidiert. Die Selektivität zum Aceton beträgt 92 %. Als Nebenprodukt entsteht Propionaldehyd. Das Verfahren kann ein- oder zweistufig durchgeführt werden. Die einzigen industriellen Anlagen nach diesem Verfahren wurden in Japan erbaut und betrieben.[24] Ein von Wacker entwickeltes Verfahren zur Oxidation von 1-Buten zu Methylethylketon konnte sich nicht etablieren.[1]
Wacker-Oxidation
Neben den großtechnischen Verfahren findet die dem Wacker-Hoechst-Verfahren zu Grunde liegende Reaktion als Wacker-Oxidation bezeichnet in Laborsynthesen Anwendung, etwa in Form der Wacker-Tsuji-Oxidation. Dabei handelt es sich um die Oxidation höherer α-Olefine zu Methylketonen, wie etwa die Oxidation von 1-Decen zu 2-Decanon.[25]
Generell reagieren höher substituierte Alkene schneller als unsubstituierte und Diene mit konjugierten Doppelbindungen reagieren langsamer als nicht konjugierte Systeme. Die Produktbildung folgt der Markownikow-Regel, nach der das Wasserstoffatom immer an das bereits wasserstoffreichere Kohlenstoffatom gebunden wird.[26]
Im Labormaßstab wird die Reaktion meist bei Raumtemperatur mit Palladium(II)-chlorid und Kupfer(II)-chlorid unter Sauerstoffatmosphäre durchgeführt. Zur Vermeidung von Chlorierungsreaktionen werden neben dem klassischen Palladium-/Kupferchloridsystem andere lösliche Palladiumsysteme wie Palladium(II)-acetat oder Bis(acetonitril)chloronitropalladium(II) verwendet. Starke anorganische Säuren wie die Perchlorsäure erhöhen zum Teil die Reaktionsgeschwindigkeit. Die Reaktionsgeschwindigkeit der Oxidation von schlecht wasserlöslichen höheren Alkenen lässt sich durch die Verwendung von Gemischen aus Wasser und polaren organischen Lösungsmitteln wie Dimethylformamid oder N-Methyl-2-pyrrolidon oder der Verwendung oberflächenaktiver Substanzen wie Natriumlaurylsulfat erhöhen.[27] Als häufige Nebenreaktion lässt sich die Doppelbindungsisomerisierung beobachten; die Reaktionsgeschwindigkeit dieser Nebenreaktion scheint stark von der Wahl des Lösungsmittels abhängig zu sein.[27] Zur Re-Oxidation des anfallenden Palladiummetalls werden unter Laborbedingungen neben dem klassischen Kupferchlorid verschiedene Oxidationsmittel verwendet.
Literatur
- Patrick Henry: Palladium Catalyzed Oxidation of Hydrocarbons (Catalysis by Metal Complexes). Verlag Springer, 1980, ISBN 978-94-009-9448-5.
Weblinks
Einzelnachweise
- Reinhard Jira: Acetaldehyd aus Ethylen – ein Rückblick auf die Entdeckung des Wacker-Verfahrens. In: Angewandte Chemie. 121, 2009, S. 9196–9199, doi:10.1002/ange.200903992.
- Albert Hester, Karl Himmler: Chemicals from Acetaldehyde. In: Industrial and Engineering Chemistry. 51.12, 1959, S. 1424–1430.
- Francis C. Phillips, Am. Chem. J., 1894, 16, S. 255–277.
- Menschen • Märkte • Moleküle: Die Erfolgsformel Wacker Chemie 1914–2014, S. 154 und S. 175–185 (pdf).
- John A. Keith, Patrick M. Henry: Zum Mechanismus der Wacker-Reaktion: zwei Hydroxypalladierungen! In: Angewandte Chemie. 121, 2009, S. 9200–9212, doi:10.1002/ange.200902194.
- Die DECHEMA-Preisträger seit 1951.
- Marc Eckert, Gerald Fleischmann, Reinhard Jira, Hermann M. Bolt, Klaus Golka: Acetaldehyde. In: Ullmann’s Encyclopedia of Industrial Chemistry, 2005, Weinheim, Wiley-VCH, doi:10.1002/14356007.a01_031.pub2.
- James A. Kent (Hrsg.): Riegel’s Handbook of Industrial Chemistry. 7. Auflage. Verlag Van Nostrand Reinhold, ISBN 0-442-24347-2, S. 790.
- George W. Parshall, Steven D. Ittel: Homogeneous Catalysis. Wiley, New York 1992, ISBN 978-0-471-53829-5, S. 138.
- Glenn J. Sunley, Derrick J. Watson: High productivity methanol carbonylation catalysis using iridium. In: Catalysis Today. 58, 2000, S. 293–307, doi:10.1016/S0920-5861(00)00263-7.
- Joseph R. Zoeller, Victor H. Agreda, Steven L. Cook, Norma L. Lafferty, Stanley W. Polichnowski, David M. Pond: Eastman chemical company acetic anhydride process. In: Catalysis Today. 13, 1992, S. 73–91, doi:10.1016/0920-5861(92)80188-S.
- Adolph Segnitz: s-Organocobalt,- rhodium, -iridium, -nickel, -palladium Compounds. In: Houben-Weyl Methods of Organic Chemistry Vol. XIII/9b, 4th Edition. Georg Thieme Verlag, 1984, ISBN 978-3-13-215004-1, S. 882.
- Jürgen Smidt, W. Hafner, R. Jira, R. Sieber, J. Sedlmeier, A. Sabel: The Oxidation of Olefins with Palladium Chloride Catalysts. In: Angewandte Chemie International Edition in English. 1, 1962, S. 80–88, doi:10.1002/anie.196200801.
- Wilhelm Keim, Arno Behr und Günter Schmitt: Grundlagen der industriellen Chemie. Technische Produkte und Prozesse. ISBN 3-7935-5490-2 (Salle), ISBN 3-7941-2553-3 (Sauerländer), S. 217–223.
- Boy Cornils, Wolfgang A. Herrmann, Chi-Huey Wong, Horst-Werner Zanthoff: Catalysis from A to Z: A Concise Encyclopedia. Verlag Wiley-VCH, 2012, ISBN 3-527-33307-X, S. 337.
- H. Schulz, H. Wagner: Synthese und Umwandlungsprodukte des Acroleins. In: Angewandte Chemie. 62, 1950, S. 105–118, doi:10.1002/ange.19500620502.
- P. Rave, B. Tollens: XXXIV. Ueber den Penta-Erythrit (Tetramethylolmethan). In: Justus Liebig’s Annalen der Chemie. 276, 1893, S. 58–69, doi:10.1002/jlac.18932760106.
- Ido Leden, Joseph Chatt: The stability constants of some platinous halide complexes. In: Journal of the Chemical Society. 1955, S. 2936–2943, doi:10.1039/JR9550002936.
- Dirk Steinborn: Grundlagen der metallorganischen Komplexkatalyse. Teubner, Wiesbaden 2007, ISBN 978-3-8351-0088-6, S. 283–292.
- John A. Keith, Jonas Oxgaard, William A. Goddard: Inaccessibility of β-Hydride Elimination from −OH Functional Groups in Wacker-Type Oxidation. In: Journal of the American Chemical Society. 128, 2006, S. 3132–3133, doi:10.1021/ja0533139.
- Wilhelm Keim: Homogeneous Catalysis in Germany: Past and Present. In: Studies in Surface Science and Catalysis. 44, 1989, S. 321–331.
- W. Schwerdtel: Vinylacetal auf Basis Äthylen in der Gasphase. In: Chemie Ingenieur Technik. 40, 1968, S. 781–784, doi:10.1002/cite.330401602.
- William G. Lloyd, B. J. Luberoff: Oxidations of olefins with alcoholic palladium(II) salts. In: The Journal of Organic Chemistry. 34, 1969, S. 3949–3952, doi:10.1021/jo01264a043.
- Gian Paolo Chiusoli, Peter M. Maitlis: Metal-catalysis in Industrial Organic Processes. RSC Publishing, 2008, ISBN 978-0-85404-150-3, S. 69.
- Jiro Tsuji, Hideo Nagashima, Hisao Nemoto: A General Synthetic Method for the Preparation of Methyl Ketones from Terminal Olefins: 2-Decanone. In: Organic Syntheses. 62, 1984, S. 9, doi:10.15227/orgsyn.062.0009.
- Michael B. Smith: Organic Synthesis. 1. Auflage, McGraw-Hill, 1994, ISBN 0-07-113909-5, S. 1350–1353.
- James Takacs, Xun-tian Jiang: The Wacker Reaction and Related Alkene Oxidation Reactions. In: Current Organic Chemistry. 7, 2003, S. 369–396, doi:10.2174/1385272033372851.