Acetylsalicylsäure
Acetylsalicylsäure (kurz ASS) ist ein weit verbreiteter schmerzstillender, entzündungshemmender, fiebersenkender und thrombozytenaggregationshemmender (TAH) Arzneistoff aus der Gruppe der nichtsteroidalen Antirheumatika (NSAR). ASS wird seit 1977 auf der Liste der unentbehrlichen Arzneimittel der WHO aufgeführt. Der Stoff wird seit Anfang des 20. Jahrhunderts in diversen Produkten von Pharmaherstellern vertrieben.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Acetylsalicylsäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C9H8O4 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus |
irreversibler Cyclooxygenasen-Inhibitor | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 180,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
zersetzt sich[3] | ||||||||||||||||||
| pKS-Wert |
3,49[1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Schweiz: 5 mg·m−3[5] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Die Bezeichnung Aspirin, die zunächst im englischsprachigen Raum und später teilweise auch international zum Synonym für ASS wurde, ist ein Markenname der Bayer AG für Medikamente mit diesem Wirkstoff.
Nomenklatur
Acetylsalicylsäure ist der Trivialname für 2-Acetoxybenzoesäure, wie sie nach den IUPAC-Regularien heißt. Dabei handelt es sich um ein Derivat der Salicylsäure (o-Hydroxybenzoesäure), womit die Acetylsalicylsäure sowohl als Derivat der Benzoesäure (siehe IUPAC-Name) als auch als Ester der Essigsäure (Essigsäuresalicylester) aufgefasst werden kann.
Etymologie
Reine Acetylsalicylsäure wurde erstmals 1897 von Felix Hoffmann in Zusammenarbeit mit Arthur Eichengrün in den Farbenfabriken vorm. Friedr. Bayer & Co. synthetisiert.[8] Der Markenname Aspirin wurde am 6. März 1899 in die Warenzeichenrolle des Kaiserlichen Patentamtes aufgenommen. Dieser Name leitet sich vom Echten Mädesüß ab, einem salicylathaltigen Rosengewächs, das auch Spiere genannt wurde (veraltet: Spiraea ulmaria L. heute: Filipendula ulmaria (L.) Maxim.): ‚A' (für die Acetylgruppe), ‚spir’ soll auf die Geschichte des Wirkstoffs hinweisen (Anlehnung an die Spirsäure, die mit Salicylsäure chemisch identisch ist) und ‚in’ als gebräuchliches Suffix der chemischen Namensgebung dieser Zeit.[9] Geprägt wurde der Name durch Kurt Witthauer, Oberarzt am Diakonissenkrankenhaus Halle/Saale, der im April 1899 die erste klinische Studie über die Anwendung von Acetylsalicylsäure publizierte.[10][8]
Handelsnamen und Darreichungsformen
Acetylsalicylsäure wird als Monopräparat weltweit in über 500 Fertigarzneimitteln in der Darreichungsform von Tabletten, Sublingualtabletten, Filmtabletten, Schmelztabletten, Trinktabletten, Pulver, Granulat, Kautabletten, Kaudragées, Brausetabletten, Retardtabletten, Kapseln, Retardkapseln, Injektionslösungen, Suppositorien und Dragées vermarktet.[11] Nachfolgend einige Beispiele von Handelsnamen:
- Deutschland: ASS-AbZ, Acesal, Acetylin (hist.), Alka-Seltzer, Aspirin, Aspirin i.v. (ehemals Aspisol), Eudorlin, Godamed, Herz-ASS, Miniasal, Togal-ASS, ASS-ratiopharm
- Schweiz: Alcacyl, Asa-Tabs, Aspégic, Aspirin, Aspirin Direkt, Aspirin Effect, Aspirin Migräne, Aspirin protect, Aspro, Contra-Schmerz plus[12], Kardégic, Tiatral
- Österreich: Acekapton, Aspirin, Aspro Classic, Herz-ASS, Thrombo-ASS, Togal Mono, ASS Genericon
Neben diesen Monopräparaten sind noch zahlreiche Generika und Kombinationspräparate im Handel, die neben Acetylsalicylsäure auch Vitamin C, Paracetamol, Coffein oder Pseudoephedrin-Hydrochlorid enthalten, wie Aspirin Plus C, Aspirin Plus C Forte – mit den Wirkstoffen Acetylsalicylsäure und Ascorbinsäure (Vitamin C); Aspirin Coffein – mit den Wirkstoffen Acetylsalicylsäure und Coffein oder Aspirin Complex – mit den Wirkstoffen Acetylsalicylsäure und Pseudoephedrin-Hydrochlorid.
Die oben angezeigte Abkürzung Asa (oder ASA, statt ASS) stammt von englischen acetylsalicylic acid.
Geschichte

Weidenrinde wurde als Mittel gegen Fieber und Schmerzen aller Art spätestens in den frühen Hochkulturen eingesetzt.[13] Hippokrates von Kos, Dioscurides und der römische Gelehrte Plinius der Ältere sahen die Weidenrinde als Arznei an.[14] Durch Kochen von Weidenbaumrinden haben Germanen und Kelten Extrakte gewonnen und zu Heilzwecken verwendet, die der synthetischen Acetylsalicylsäure verwandte Substanzen enthielten. 1763 meldete der in Oxford lebende Geistliche Edward Stone der Royal Society in London, dass diese aus der Überlieferung bekannten Erkenntnisse korrekt seien.[14] 1828 gelang es Johann Andreas Buchner, das Salicin, einen chemischen Verwandten der ASS, der im Körper zu Salicylsäure umgesetzt wird, aus den besagten Weidenrindenextrakten (Weide, Salix sp.) zu isolieren, ebenso wie der französische Apotheker Pierre-Joseph Leroux.
Auch Bibergeil (Castoreum), ein Sekret der Analdrüse des Bibers, enthält Salicylsäure und wurde bis ins 19. Jahrhundert gegen Krämpfe, hysterische Anfälle, Nervosität u. v. m. eingesetzt. In der gräco-romanischen Antike war die Substanz schon als Wirkstoff gegen Epilepsie bekannt.
Die Vorstufe Salicylsäure wurde (weltweit als erstes industriell hergestelltes und „abgepacktes“ Medikament) ab 1874 durch Friedrich von Heyden (Chemische Fabrik v. Heyden in Radebeul) großtechnisch durch die Kolbe-Schmitt-Reaktion hergestellt. Der bittere Geschmack der Substanz und Nebenwirkungen wie Magenbeschwerden schränkten jedoch die Einsatzmöglichkeiten als Medikament stark ein.
Der Chemiker Charles Frédéric Gerhardt hatte 1853 in Straßburg bereits Acetylsalicylsäure in nichtreiner Form synthetisiert.[15] Durch Kochen von Acetylchlorid mit Salicylsäure konnte Hugo von Gilm (1831–1906) 1859 unreine o-Acetylsalicylsäure als wasserunlöslichen Feststoff erhalten.[16] Die Verfahren von Friedrich von Heyden und Hugo von Gilm wurden 1869 von Karl Kraut eingehend untersucht, es bildeten sich bei beiden in stark unterschiedlichen Mengenverhältnissen schlecht charakterisierbare Anhydride und „Acetylosalicylsäure“ (Schmelzpunkt 118 °C) als Ester.[17]
1872 wies Hugo Schiff nach, dass sich acetylhaltige Anhydride der Salicylsäure thermisch sehr leicht in isomere Salicylsäure-Ester umwandeln und darüber hinaus höhere Kondensationsprodukte gebildet werden.[18] Aus Acetylchlorid und Salicylsäure, jedoch unter Zusatz von Eisen(III)-chlorid unter Friedel-Crafts-Bedingungen von 1877, wurde Anfang 1897 die p-Acetylsalicylsäure (Schmelzpunkt 210 °C) hergestellt.[19]

Am 10. August 1897 gelang erstmals im Bayer-Stammwerk in Wuppertal-Elberfeld die Synthese von nebenproduktfreier o-Acetylsalicylsäure (Schmelzpunkt 136 °C) aus Acetanhydrid und Salicylsäure. In einer US-Patentschrift vom 1. August 1898[20] stellte der Erfinder Felix Hoffmann nochmals detailliert klar, dass nur bei seinem Verfahren und im Gegensatz zu den von Kraut beschriebenen Varianten die gewünschte Acetylsalicylsäure in reiner Form gebildet wird. Das Patent wurde in den USA und in Großbritannien erteilt, nicht jedoch in Deutschland, da die Chemische Fabrik v. Heyden in Radebeul bei Dresden unter dem Chemiker Carl Kolbe bereits seit 1897 Acetylsalicylsäure in industriellem Maßstab, erst unter ihrem chemischen Namen und später unter dem Handelsnamen Acetylin, als Heilmittel produzierte und vertrieb.[21]
Das Mittel wurde von Kurt Witthauer am Diakoniekrankenhaus in Halle 1898 auf seine Vorzüge an über 50 Patienten geprüft und er stellte vor allem die gute Verträglichkeit im Vergleich zu anderen Salicylpräparaten heraus.[22] Eine Beschreibung des industriellen Schwefelsäure-katalysierten Verfahrens findet sich in Ullmanns Enzyclopädie von 1915.[23] Am 7. April 1921 meldete Bayer eine Modifikation dieses Verfahrens zum Patent an. Anstelle von Schwefelsäure eignete sich auch ein geringer Pyridin-Zusatz als Katalysator bei ansonsten milderen Reaktionsbedingungen.[24]
1949 veröffentlichte Arthur Eichengrün eine Arbeit, in der er schrieb, er habe die Entwicklung von Aspirin sowie einiger benötigter Hilfsstoffe geplant und koordiniert. Schon zuvor schrieb Eichengrün aus dem Konzentrationslager – fast ein halbes Jahrhundert nach der Erfindung von Aspirin – der I.G. Farben (Bayer), als er sich seinem Tode nahe sah, dass Hoffmann an der Erfindung von Aspirin nur in der Weise beteiligt gewesen sei, dass er (bei der ersten chemisch völlig reinen Synthese der Acetylsalicylsäure) die Anordnungen Eichengrüns befolgte, ohne überhaupt zu wissen, was er dabei genau tat. Während des Nationalsozialismus wurde er weiterhin als Beteiligter oder gar Erfinder verleugnet, wie dies bei allen jüdischen Errungenschaften üblich war, und die Erfindung des Aspirins öffentlich vor allem Hoffmann zugesprochen. Eichengrün hat dies nach seiner Entlassung in einer noch aus Zeiten des Nationalsozialismus stammenden Ausstellung, über deren Pforte „Juden ist der Zutritt verboten“ prangte, auf einer Tafel zum Thema Aspirin gelesen. Auf ihr wurden Hoffmann und eine mit der Entwicklung Aspirins nicht in Verbindung stehende Person als Erfinder genannt, ohne jegliche Erwähnung Eichengrüns. In vielen geschichtlichen Abhandlungen und Lexika zu dem Thema wird aufgrund dieser Vorgänge während des Nationalsozialismus und der damit entsprechend beeinflussten Geschichtsbücher vornehmlich Felix Hoffmann als Erfinder oder wahrscheinlicher Erfinder genannt und die Erklärung Eichengrüns in seiner 1949 veröffentlichten Arbeit oftmals lediglich als Behauptung betitelt.
Sowohl Felix Hoffmann als auch Arthur Eichengrün werden als Erfinder für den nebenproduktelosen Syntheseweg der Acetylsalicylsäure diskutiert. Zuletzt kam 1999 Walter Sneader von der Abteilung Pharmazeutische Wissenschaften der Universität Strathclyde in Glasgow zu dem Ergebnis, dass Eichengrün der Erfinder des Aspirins sei – Bayer bestritt diese Theorie unmittelbar darauf in einer Pressemitteilung.[25] Eichengrün wurde aufgrund seiner jüdischen Herkunft während der Nazizeit in seiner wissenschaftlichen Arbeit zunehmend behindert. Sicher ist, dass Eichengrün nach der Zulassung von Aspirin zum Leiter der pharmazeutischen Abteilung bei der Bayer AG befördert und Hoffmann Leiter der Marketing-Abteilung wurde. Bayer vermarktete jedoch vorerst den elf Tage später von Hoffmann entwickelten Hustenstiller, das als Heroin bekannt gewordene Diacetylmorphin (DAM), stärker, da man nach Versuchen an Menschen davon ausging, dass Aspirin zu viele Nebenwirkungen habe.
 Warenpräsenz in einem US-Drugstore (2018)
Warenpräsenz in einem US-Drugstore (2018).png.webp) Werbeannonce für Aspirintabletten im Tiroler Volksboten (Südtirol) vom 28. Oktober 1926
Werbeannonce für Aspirintabletten im Tiroler Volksboten (Südtirol) vom 28. Oktober 1926 Verpackung, um 1940
Verpackung, um 1940
Chemische und physikalische Eigenschaften

Acetylsalicylsäure liegt als weißes Pulver vor oder bildet flache bis nadelförmige Kristalle mit schwachem Geruch nach Essigsäure. Der pKS-Wert beträgt 3,5. Sie schmilzt bei einer Temperatur von 136 °C, bei Temperaturen über 140 °C tritt Zersetzung ein.[1] Acetylsalicylsäure ist gut löslich in Ethanol und Alkalilauge, aber schlecht löslich in Benzol oder kaltem Wasser (3,3 g·l−1 bei 20 °C), was auf den hydrophoben Benzolring zurückzuführen ist. Die Wasserlöslichkeit steigt erheblich beim Erwärmen. Aufgrund der erheblich besseren Wasserlöslichkeit werden therapeutisch auch das Magnesium- und Calciumsalz eingesetzt.[26] Die Dichte von Acetylsalicylsäure beträgt 1,35 g·cm−3, der Dampfdruck ist gering.
Herstellung

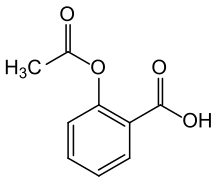
Die phenolische Hydroxygruppe in Ortho-Stellung zur Carboxygruppe der Salicylsäure reagiert mit dem Essigsäureanhydrid unter Acetylierung, wobei der Wasserstoff der Hydroxygruppe durch eine Acetylgruppe ersetzt wird.
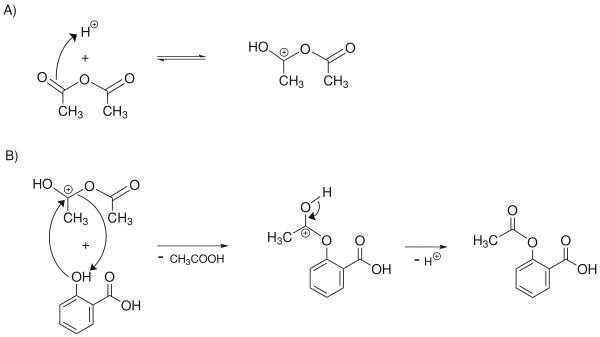
Hierzu wird durch Kolbe-Schmitt-Reaktion industriell hergestellte Salicylsäure mit protoniertem Essigsäureanhydrid an der phenolischen Hydroxygruppe zu Acetylsalicylsäure verestert (acetyliert). Alternativ kann das Reaktionsprodukt der Kolbe-Schmitt-Reaktion (Natriumsalicylat) auch direkt mit Essigsäureanhydrid acetyliert werden, wobei Acetylsalicylsäure resultiert und Natriumacetat in stöchiometrischer Menge entsteht.[27]
Typische Nebenprodukte aller ASS-Synthesen sind die Kondensationsprodukte Acetylsalicylsäureanhydrid (ASN), o-Acetylsalicyl-salicylsäure (ASSA), o-Salicoyl-salicylsäure (SSA) und Disalicylid, sie müssen durch nachfolgende Kristallisationen entfernt werden.[28]
Pharmakologie

Wirkungen
Acetylsalicylsäure wirkt durch Hemmung der Cyclooxygenasen COX-1 und COX-2.
Schmerzstillend, antirheumatisch, antipyretisch und antiinflammatorisch
Acetylsalicylsäure wirkt durch Hemmung der Cyclooxygenase COX-1 schon in kleinen Dosen (30–50 mg) thrombozytenaggregationshemmend, mit steigender Dosis (0,5–2 g) durch Hemmung der Cyclooxygenasen COX-1 und COX-2 und der daraus folgenden sinkenden Bildung von Prostaglandinen auch dezentral schmerzstillend, antirheumatisch sowie fiebersenkend und schließlich (2–5 g) entzündungshemmend.
Erhöhung der Magensäuresekretion
Prostaglandine sind aber unter anderem auch noch an der Regelung der Magensäuresekretion und der Magenschleimhautdurchblutung beteiligt, so dass durch die Hemmung der Prostaglandinsynthese bei höheren Dosierungen und längerfristiger ASS-Einnahme, beispielsweise im Rahmen der Behandlung von rheumatischen Beschwerden, Magenbeschwerden und Magenblutungen auftreten können.
Die Magenunverträglichkeit beruht zu einem wesentlichen Teil auf der (gewünschten) systemischen Hemmung der Prostaglandinsynthese und lässt sich durch andere Darreichungsformen (magensaftresistente Tablette, Zäpfchen oder intravenöse Gabe) allenfalls abmildern. Eine Arzneiform, die auf der Magenschleimhaut aufliegend den Wirkstoff abgibt, beeinträchtigt das Gewebe des Magens kurzzeitig jedoch noch zusätzlich.
Geschwülste
Über die Hemmung der Prostaglandinsynthese kann die Acetylsalicylsäure auch die Entartung von gutartigen Darmgeschwülsten zu Krebs behindern. Auch das Melanom könnte durch die regelmäßige Einnahme von ASS verhindert werden.[29]
Bei der kurzzeitigen Anwendung in Dosierungen von 500 bis 1000 mg bei akuten Schmerzen ist Acetylsalicylsäure in ihrer Verträglichkeit etwa mit den anderen apothekenpflichtigen Schmerzmitteln vergleichbar.
Wirkmechanismus

Die Funktionsweise der Acetylsalicylsäure, nämlich die Hemmung der Prostaglandinproduktion, wurde 1971 von John Robert Vane aufgeklärt,[30] wofür er 1982 zusammen mit Sune Bergström und Bengt Samuelsson den Nobelpreis für Medizin erhielt:[31]
Die Wirkung der Acetylsalicylsäure beruht auf einer irreversiblen Hemmung der Prostaglandin-H2-Synthase, genauer der Cyclooxygenasen COX-1 und COX-2. Diese Enzyme katalysieren die Bildung von entzündungsverstärkenden Prostaglandinen sowie z. B. Thromboxan A2, das u. a. thrombozytenaktivierend wirkt. Die Acetylsalicylsäure überträgt bei der Hemmung einen Acetylrest auf einen Aminosäurerest (Serin 530) kurz vor dem katalytischen Zentrum. Dadurch kann die Arachidonsäure als Substrat des Enzyms das aktive Zentrum nicht mehr erreichen und das Enzym wird dauerhaft inaktiviert. Die COX-1 wird durch Acetylsalicylsäure etwa 10- bis 100-mal stärker gehemmt als die COX-2. Da Thrombozyten aufgrund des fehlenden Zellkerns keine Enzyme nachbilden können, ist die gerinnungshemmende Wirkung auf sie irreversibel – die Wirkungsdauer deckt sich daher mit der Überlebenszeit der Thrombozyten (8–11 Tage).
Ein weiterer indirekter Wirkmechanismus scheint die indirekte Hemmung der Cyclooxygenase zu sein: Acetylsalicylsäure verstärkt effektiv die Aktivität der Cytochrom P450-Isoformen CYP2E1 und CYP4A1, welche Arachidonsäure zu Epoxyeicosatriensäuren abbauen. Einige dieser Epoxyeicosatriensäuren gehören zu den endogenen Antipyretika, also Stoffen des Körpers, die die Fieberreaktion begrenzen; sie hemmen die Cyclooxygenase-2 effektiver als das Aspirin an sich.[32]
Pharmakokinetik
Acetylsalicylsäure unterliegt einem ausgeprägten First-pass-Metabolismus (zum Teil schon in Magen- und Darmwand durch spezielle Esterasen) und hat eine orale Bioverfügbarkeit von etwa 70 %. Sie wird im Körper innerhalb von 15 Minuten in den Hauptmetaboliten Salicylsäure umgewandelt.[33] Im Blut geht sie zu 50–70 % eine Bindung an Albumin ein.
Nebenwirkungen und Gegenanzeigen
Die bei analgetischer Dosierung auftretenden Nebenwirkungen sind meist leichterer Art: Übelkeit, Sodbrennen und Erbrechen werden relativ häufig beobachtet. Bei Asthmatikern kann Acetylsalicylsäure Ursache von Anfällen sein, die sich dadurch erklären, dass durch Hemmung der Cyclooxygenasen ein Überangebot an Arachidonsäure vorliegt[34], die dann die Bildung von bronchokonstriktorischen (die Bronchien verengenden) Leukotrienen begünstigt. Eine Kreuzreaktion zu anderen Schmerzmitteln wie beispielsweise Ibuprofen, Diclofenac oder Naproxen ist häufig.
Die Arzneimittelkommission der deutschen Ärzteschaft weist darauf hin, dass Acetylsalicylsäure aufgrund ihrer Reizwirkung bei regelmäßiger Einnahme Schleimhautreizungen, Blutungen im Magen-Darm-Trakt und Magengeschwüre verursachen kann. Bei chronisch entzündlichen Darmerkrankungen (Morbus Crohn, Colitis ulcerosa) ist Vorsicht geboten, da Acetylsalicylsäure schubauslösend wirken kann.
Zur möglichen positiven Beeinflussung der oben genannten UAW werden Antioxidantien wie z. B. Tocopherole und Tocotrienole erforscht.[35][36]
Bei Kindern und Jugendlichen mit fieberhaften Erkrankungen sollte Acetylsalicylsäure nicht eingesetzt werden, da es (möglicherweise nach einer überstandenen Viruserkrankung) das mitunter tödliche Reye-Syndrom auslösen könnte; es sollte auf alternative Substanzen – wie Paracetamol oder Ibuprofen – ausgewichen werden. In Großbritannien ist die rezeptfreie Abgabe von Acetylsalicylsäure an Kinder und Jugendliche unter 16 Jahren aus diesem Grund verboten. Diskutiert wird auch eine suppressive Wirkung auf das unspezifische Immunsystem, da der Immunmodulator Desoxycholsäure (Literatur) erst nach Abklingen der Wirkungen der Acetylsalicylsäure aktiv werden kann. Dennoch gibt es auch im Kindesalter Krankheitsbilder, bei denen die Behandlung mit Acetylsalicylsäure durchaus angezeigt ist. Dazu gehören das rheumatische Fieber oder das Kawasaki-Syndrom.
In der Schwangerschaft darf Acetylsalicylsäure nur in kleinen Mengen verabreicht werden, da ASS insbesondere im dritten Trimenon zu einem vorzeitigen Verschluss des Ductus arteriosus des ungeborenen Kindes führen kann. Außerdem besteht durch die gehemmte Blutgerinnung eine erhöhte Blutungsneigung der Mutter bei der Geburt.
1999 wurde die Anzahl tödlicher Ereignisse im Zusammenhang mit Aspirin und ähnlichen Schmerzmitteln unter Amerikanern auf jährlich 16.500 geschätzt.[37]
Im Jahr 2004 geriet Aspirin in die Schlagzeilen, da in einer großen Studie mit 88.000 Teilnehmerinnen (Nurses’ Health Study) ein Zusammenhang zwischen langjähriger und häufiger Aspirineinnahme und Bauchspeicheldrüsenkarzinomen gezeigt wurde. In einer vorhergehenden Studie mit 28.000 Teilnehmerinnen (Iowa Women's Health Study) wurde zuvor jedoch gerade ein gegenteiliger Effekt für Aspirin gezeigt, nämlich dass die regelmäßige Einnahme vor Bauchspeicheldrüsenkrebs schützt. Eine noch größere Studie der American Cancer Society mit insgesamt 987.000 Teilnehmern zeigte dann jedoch, dass Aspirin weder einen fördernden noch einen schützenden Effekt in Bezug auf Bauchspeicheldrüsenkrebs hat. Dies gilt für Frauen wie für Männer.
Eine britische Metaanalyse zeigte 2010 eine deutliche, signifikante Reduktion der Entstehung von Darmkrebs – und möglicherweise auch anderer Krebstypen – bei täglicher Einnahme von ASS auf. Dabei wurden die Patientendaten aus 7 Studien (23.535 Patienten, 657 Todesfälle durch Krebs) analysiert. Es konnte gezeigt werden, dass eine Langzeiteinnahme (mindestens 5 Jahre) von Aspirin zu einer Reduktion der Krebssterbefälle unabhängig von der Dosierung (75 mg oder mehr), Geschlecht oder Rauchverhalten führt, wobei sich der Effekt mit zunehmendem Alter der Probanden und Verlängerung der Einnahmedauer verstärkt. Sowohl gastrointestinale (zum Beispiel kolorektales Karzinom oder Speiseröhrenkrebs) als auch nicht-gastrointestinale Karzinome (zum Beispiel Lungenkrebs) führten seltener zum Tod bei Langzeitaspirineinnahme (bis 20 Jahre wurde analysiert). Der Effekt war bei Adenokarzinomen (gastrointestinale und nicht-gastrointestinale) besonders ausgeprägt. Somit würde eine tägliche Aspirineinnahme über 5–10 Jahre unter Berücksichtigung der Nebenwirkungen von ASS zu einer Reduktion der Todesfälle während dieser Zeit um etwa 10 % führen.[38]
Bei Asthmatikern beträgt der Anteil der Patienten mit ASS-Intoleranz etwa 8 bis 20 % und bei Patienten mit Nasenpolypen etwa 6 % bis 15 %. Diese Allergie wird als Samter-Trias bezeichnet. Es wird eine genetische (erbliche) Prädisposition vermutet.[39]
In einer schwedischen Studie, veröffentlicht im August 2009 im Fachmagazin Pharmacoepidemiology and Drug Safety, mit 58.465 Studienteilnehmern konnte durch Einsatz des Mortalitätsregisters und des im Patientenregister dokumentierten Arzneimittelgebrauchs festgestellt werden, dass der Gebrauch von Aspirin bei diabetischen Patienten ohne kardiovaskuläre Krankheitsanzeichen zu einer erhöhten Mortalität führte. Bei diabetischen Patienten mit kardiovaskulären Krankheitsanzeichen wurde jedoch eine Verminderung der Mortalität unter der Anwendung von Aspirin beobachtet. Die bisherige Praxis der Anwendung von Aspirin auch bei Diabetikern ohne kardiovaskuläre Krankheitszeichen sollte danach revidiert werden, bis weitere Erkenntnisse aus laufenden Studien verfügbar sind.[40]
Wie eine 2010 veröffentlichte Studie aus der Schweiz aufzeigte, kann die regelmäßige Einnahme von Aspirin nicht nur zu häufigerem Nasenbluten führen; bei den Patienten, die Aspirin zur Prophylaxe von Herzerkrankungen in Dosen von 100 mg und 300 mg täglich einnahmen, verlief Nasenbluten schwerer als bei vergleichbaren Patienten ohne Aspirineinnahme und bedurfte öfter einer chirurgischen Behandlung.[41]
Im Tierversuch an Ratten ergaben sich laut Roter Liste Hinweise auf eine mögliche teratogene (fruchtschädigende) Wirkung bei chronischer Einnahme von ASS während der Schwangerschaft.
Mediziner der University of Sydney veröffentlichten 2013 im Journal of the American Medical Association (JAMA) eine Studie, in der die Vermutung nahe liegt, dass die regelmäßige Einnahme von Aspirin für Netzhautschädigungen (Makuladegeneration (AMD)) verantwortlich ist.[42]
Eine am 18. Oktober 2018 veröffentlichte australische Langzeitstudie der Monash University in Melbourne, die im US-Fachmagazin The New England Journal of Medicine erschien, sieht bei der Einnahme von Acetylsalicylsäure negative Auswirkungen auf die Lebenszeit. Die Einnahme des Arzneimittels durch gesunde Patienten sei sogar oft komplett überflüssig.[43] Eine am 22. Januar 2019 veröffentlichte Metaanalyse von Wissenschaftlern des King’s College London im US-Fachmagazin Journal of the American Medical Association (JAMA) mit 164.225 Probanden aus insgesamt 13 klinischen Testreihen kam zum Schluss, dass die Verwendung von Acetylsalicylsäure (ASS, Aspirin) bei Menschen ohne Herz-Kreislauf-Erkrankungen mit einem geringeren Risiko für kardiovaskuläre Ereignisse (Hazard ratio, 0,89; absolute Risikoreduktion, 0,38 %) und einem erhöhten Risiko für schwere Blutungen (Hazard ratio, 1,43; absolute Risikoerhöhung, 0,47 %) verbunden ist.[44] Die Deutsche Herzstiftung rät zur ASS-Einnahme als Thrombozytenaggregationshemmer nur bei Patienten mit einem deutlichen Risikoprofil für Herzinfarkt oder Schlaganfall.[45][46]
Arzneimittelinteraktionen und Wechselwirkungen
Wegen der Häufigkeit der gleichzeitigen Anwendung von ASS- und Vitamin-E-Präparaten wird der möglichen Arzneimittelinteraktion hinsichtlich der Auswirkungen auf das Gerinnungssystem vermehrte Aufmerksamkeit geschenkt und eine gründliche Kontrolle der Gerinnungsparameter empfohlen. Gesundheitliche Aspekte einer möglichen erhöhten Blutungsneigung unter Komedikation mit Tocopherolpräparaten werden seit einiger Zeit in der Literatur diskutiert.[47][48]
Weiterhin mehren sich in letzter Zeit die Hinweise, dass Acetylsalicylsäure und bestimmte andere Schmerzmittel aus der Gruppe der nichtsteroidalen Antiphlogistika bzw. der nichtsteroidalen Antirheumatika (NSAIDs) sowie Paracetamol die Wirksamkeit von Impfstoffen herabsetzen können, indem der Körper nach einer Impfung weniger der schützenden Antikörper bildet.[49][50][51][52][53] Letzteres wird darauf zurückgeführt, dass durch Medikamente wie Acetylsalicylsäure die terminale Differenzierung der B-Zellen zu Antikörper-produzierenden Plasmazellen beeinträchtigt wird.[54] Forscher und Ärzte raten daher, einige Zeit vor und nach der Impfung auf entsprechende Medikamente zu verzichten.[55][56][57]
Fehlanwendung bei Verletzungen
Als Schmerzmittel zur Unterdrückung von Wundschmerz, wie nach chirurgischen Eingriffen oder nach Verletzungen, ist Acetylsalicylsäure ungeeignet, da die gerinnungshemmende Wirkung bis etwa sieben Tage nach der letzten Einnahme anhält und damit Blutungen begünstigt. Wegen der irreversiblen Hemmung der Cyclooxygenase in den Thrombozyten ist auch eine Gabe eines Gegenmittels zur sofortigen Aufhebung der Gerinnungshemmung nicht möglich. Es muss vielmehr abgewartet werden, bis neue, funktionsfähige Thrombozyten vom Körper gebildet werden. Auf diese Weise kann eingenommene Acetylsalicylsäure aufgrund des erhöhten Blutungsrisikos eine geplante medizinische Operation vereiteln. In besonders dringenden Fällen kann die gerinnungshemmende Wirkung der Acetylsalicylsäure durch Gabe von Thrombozyten-Konzentraten teilweise aufgehoben werden.
Fehlanwendung bei retinalem Venenverschluss
Bei Augenärzten besteht die weit verbreitete Gewohnheit, Aspirin als Zusatz-Medikament bei der Behandlung von Patienten mit retinalem Venenverschluss zu verschreiben, also bei Zentralvenenverschluss (ZZV) oder bei Venenastverschluss (VAV) in der Netzhaut des Auges. Der Grund für die weite Verbreitung liegt in der nachgewiesenen Wirkung von Aspirin bei größeren systemischen Thrombosen der Venen. Von daher wurde angenommen, dass es auch bei retinalen Venenverschlüssen ähnlich nützlich sein könne.
Eine umfassende Untersuchung auf der Basis von fast 700 Patienten zeigte jedoch, dass Aspirin und andere Gerinnungshemmer (Antikoagulanzien) einen nachteiligen Effekt auf die Entwicklung des Sehvermögens bei Patienten mit ZZV hatten, und keinerlei schützende oder die Heilung fördernde Wirkung.[58] Mehrere Expertengruppen, u. a. das Royal College of Ophthalmologists (Augenärzte) in London, sprachen sich gegen die Verwendung dieser Medikamente (einschließlich Aspirin) bei Patienten mit retinalem Venenverschluss aus.[59]
Einsatzgebiete
Acetylsalicylsäure wird nicht nur als Schmerzmittel, zur Fiebersenkung und als Antirheumatikum eingesetzt, sondern vor allem auch niedrigdosiert zur Hemmung der Thrombozytenaggregation und damit zur Vorbeugung von erneuten Herzinfarkten und Schlaganfällen (Sekundär/Tertiärprophylaxe) bei bekannten arteriosklerotischen Gefäßveränderungen verwendet.
- Nicht zur Primärprävention gesunder Patienten geeignet
Acetylsalicylsäure eignet sich jedoch nicht für die Primärprävention gesunder Patienten mit erhöhtem kardiovaskulären Risiko – das wurde 2018 durch drei Studien belegt. Die American Heart Association und das American College of Cardiology hatten daraufhin entschieden, die entsprechenden Richtlinien für die klinische Praxis zu ändern. Acetylsalicylsäure verursacht häufig Blutungen im Magen-Darm-Trakt. Trotzdem nehmen Millionen Menschen, auch ohne ärztliche Verordnung, weiterhin täglich niedrigdosiert Acetylsalicylsäure ein.[60]
ASS wird in Kombination z. B. mit Clopidogrel auch bei Patienten mit frischen Stents in den Herzkranzgefäßen eingesetzt, um einen Verschluss (Stentthrombose) zu vermeiden. Auch bei der Notfallbehandlung des akuten Koronarsyndroms, etwa beim Herzinfarkt, gehört ASS zur Standardtherapie.[61] In einer Studie erwies sich in diesen Fällen die intravenöse Gabe von ASS als vorteilhafter im Vergleich zur oralen Verabreichung.[62]
Aufgrund seiner positiven Wirkungen bei Polycythaemia vera wurde Aspirin von der Europäischen Kommission der Status eines Orphan-Arzneimittels erteilt.[63]
Resistenzdiskussion
Eine Acetylsalicylsäure-Resistenz unterschiedlicher Ausprägung wurde in einer kleinen Studie festgestellt, wobei wohl auch die Darreichungsform Einfluss nimmt.[64] Aus diesem Grund gibt es eine Kontroverse über die Einführung von Geräten, um Patienten, die einen Gerinnungshemmer benötigen, auf Acetylsalicylsäure-Resistenz testen zu lassen. Schlussfolgerung wäre bei einem positiven Test, einen anderen Gerinnungshemmer (z. B. zur Vorsorge gegen erneute Infarkte) zu verschreiben. Clopidogrel ist dafür ein Kandidat, jedoch ist dieser etwa 100-mal teurer als Acetylsalicylsäure. Aus diesem Grund hat die Pharmaindustrie eine starke Motivation, für die Einführung von Acetylsalicylsäure-Resistenz-Tests zu werben, während Krankenversicherungen und teilweise Ärzte diesbezüglich eher zurückhaltend sind.[65]
Sonstige Verwendung, Flussmittel beim Weichlöten
Acetylsalicylsäure kann als Flussmittel beim Weichlöten verwendet werden.[66]
Toxizität
Hohe Dosen, beispielsweise 10 g ASS beim Erwachsenen, können bereits zu einer lebensgefährlichen metabolischen Azidose (Übersäuerung) mit Atemlähmung und Bewusstlosigkeit führen. Außerdem kann das Innenohr geschädigt werden, was sich in einem Hörverlust oder Tinnitus äußert. Auch Nierenschädigungen sind beschrieben worden (Analgetikanephropathie).
Abgelaufene oder nach Essig riechende Präparate sollten nicht mehr verwendet werden. Letztere waren wahrscheinlich großer Wärme und Feuchtigkeit ausgesetzt, wodurch nicht nur die Wirkung beeinträchtigt wird, sondern auch für den Magen toxische phenolische Abbauprodukte durch autokatalytische Zersetzung entstehen.
Nebenwirkungen der Schmerzmittelgruppe um ASS, der Nichtopioid-Analgetika (also zusammen mit Paracetamol, Ibuprofen u. a.), gehören zu den 16 häufigsten Todesursachen in den USA. Da aber die Zahl der Opfer frei verkäuflicher Schmerzmittel in Statistiken nicht einzeln aufgeführt wird, nimmt die Öffentlichkeit die Gefahren v. a. einer gewohnheitsmäßigen oder dauernden Einnahme kaum wahr.
Die CLP-Verordnung mit dem H-Satz gesundheitsschädlich beim Verschlucken beziehen sich auf größere Mengen des Wirkstoffes, wie sie bei dessen Produktion gehandhabt werden, selbstverständlich jedoch nicht auf die Mengen in fertigen Tabletten bei deren Einnahme gemäß Beipackzettel.
Die mittlere letale Dosis (LD50) bei oraler Aufnahme liegt bei Ratten bei 200 mg/kg Körpergewicht.[6]
Nachweis
Um Acetylsalicylsäure chemisch nachzuweisen, wird sie zunächst mittels alkalischer oder saurer Hydrolyse in Salicylsäure und Essigsäure gespalten. Als Katalysator wird entsprechend Natronlauge oder Salzsäure verwendet, in der die Substanz gekocht wird.[67] Ohne Erhitzen bildet sich in der Natronlauge lediglich das Natriumsalz, welches aufgrund seiner ionischen Eigenschaft in Lösung geht, jedoch nicht reagiert. Nach der Hydrolyse kann der Nachweis der freigesetzten Salicylsäure mit Eisen(III)-chlorid (FeCl3) (es entsteht ein rotvioletter Chelatkomplex)[68] oder Hydroxamsäurereaktion[69] erfolgen. Der Nachweis von Acetat oder Essigsäure erfolgt durch Geruchsprüfung, Veresterung mit Chlorethan (Entstehung von charakteristisch riechendem Ethylacetat)[70] oder Versetzen mit Lanthan(III)-nitrat (La(NO3)3) und Iod (blaue Färbung).[71]
Die qualitative und quantitative Bestimmung der Acetylsalicylsäure in pharmazeutischen Zubereitungen oder im Blutplasma erfolgt vorzugsweise durch chromatographische Verfahren wie z. B. die HPLC, Gaschromatographie oder Gaschromatographie mit Massenspektrometrie-Kopplung.[72][73][74] Die hochspezifische Analytik der Salicylsäure – als Stoffwechselprodukt im Humanserum – kann durch Einsatz der HPLC mit Fluoreszenzdetektion erfolgen.[75]
Siehe auch
- NOSH-Aspirin, eine Gruppe chemischer Verbindungen, die sich strukturell von der Acetylsalicylsäure (Aspirin) ableiten
Literatur
- Helga Vollmer: Aspirin – Ein Jahrhundertmittel macht Karriere, Wilhelm Heyne Verlag, München 1997, ISBN 3-453-12268-2.
- Uwe Zündorf: 100 Years Aspirin – The Future has just begun / 100 Jahre Aspirin – die Zukunft hat gerade erst begonnen. Herausgegeben von der Bayer AG. Leverkusen 1997, OCLC 174457867 (deutsch).
- Nicolai Kuhnert: Hundert Jahre Aspirin. In: Chemie in unserer Zeit. 1999, 33 (4), S. 213–220, doi:10.1002/ciuz.19990330406.
- Kay Brune, Tobias Egger: Die Entwicklung der antipyretischen Analgetika. In: Pharmazie in unserer Zeit. 2002, 31 (2), S. 133–139, doi:10.1002/1615-1003(200203)31:2<133::AID-PAUZ133>3.0.CO;2-3.
- Doris Schwarzmann-Schafhauser: Aspirin. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 114.
- Andrew T. Chan u. a.: Long-term Aspirin Use and Mortality in Women. In: Archives of Internal Medicine. 2007, 167, S. 562–572. PMID 17389287.
- Karsten Schrör: Acetylsalicylsäure. 3., vollständig neu überarbeitete und aktualisierte Auflage, 2018. Dr. Schrör Verlag, Frechen. ISBN 978-3-9819062-0-2.
- Acetylsalicylsäure. In: Beilsteins Handbuch der Organischen Chemie. 3. Auflage. 2. Band, S. 1496. und Ergänzungswerk, S. 889.
- Acetylsalicylsäure. In: Beilsteins Handbuch der Organischen Chemie. 4. Auflage. Band 10, H S. 67., EI S. 28. und EII S. 41.
Weblinks
- Fachinfo (D): Aspirin 500 mg Tabletten (PDF) pharmazie.com.
- Eintrag zu Acetylsalicylsäure in der DrugBank der University of Alberta – detaillierte Daten zu Acetylsalicylsäure (englisch)
- Synthese von Acetylsalicylsäure (Memento vom 20. Dezember 2016 im Internet Archive) (PH Heidelberg)
- biochemische Grundlagen der Aspirin-Wirkung (FIZ Chemie Berlin)
Einzelnachweise
- Eintrag zu O-Acetylsalicylsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Zur Problematik der thermischen Umwandlung während der Smp.-Messung siehe H. Erdmann: γ-Oxycarbostyril aus Antranilsäure. In: Berichte der Deutschen Chemischen Gesellschaft. Jg. 32, Band 3. F. Friedländer, Berlin 1899, S. 3572 f. (Digitalisat auf Gallica).
- Patent DE134234: Verfahren zur Darstellung von Salicylid. Veröffentlicht am 1. September 1901, Anmelder: Hoffmann-La Roche. und R. Anschütz: Über ein neues Disalicylid. In: Ber. d. Dt. Chem. Ges. 52, 1919, S. 1875–1895, und zwar S. 1883; doi:10.1002/cber.19190520911.
- Eintrag zu Aspirin®. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Mai 2014.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 50-78-2 bzw. Acetylsalicylsäure), abgerufen am 16. September 2019.
- Eintrag zu Aspirin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- H. Bekemeier: Salicylamid- und Salicylsäure-Vergiftung bei der Katze im Vergleich mit anderen Tieren. I. In: Arzneimittelforschung. 5, 1955, S. 572–575. PMID 13276287.
- Walter Sneader: The discovery of aspirin: a reappraisal. In: BMJ. 321(7276), 23. Dez 2000, S. 1591–1594. PMC 1119266 (freier Volltext).
- Christina Schott, Eva Maria Feller, ASPIRIN – Eine unendliche Geschichte, Universität Bayreuth, 25. Juli 2018. Abgerufen am 2. August 2019.
- Karsten Schrör, H. K. Breddin: Acetylsalicylsäure im kardiovaskulären System: 50 Jahre nach Felix Hoffmann. Springer DE, 1996, ISBN 3-7643-5646-4, S. 8 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pharmavista – Datenbank Internationale Fertigarzneimittel.
- Contra-Schmerz® plus. In: compendium.ch. 25. Mai 2016. Abgerufen am 27. Juli 2018.
- z. B. K.-C. Bergmann, J. Ring (Hrsg.): History of Allergy. Verlag Karger Medical and Scientific Publishers, 2014, S. 132 (eingeschränkte Vorschau in der Google-Buchsuche); Adrian Kerr: Ancient Egypt and Us: The Impact of Ancient Egypt on the Modern World. 2009, S. 100 f. (eingeschränkte Vorschau in der Google-Buchsuche).
- O. Lafont: From the willow to aspirin. In: Rev Hist Pharm. (Paris). 55 (354), Jul 2007, S. 209–216. PMID 18175528.
- Charles F. Gerhardt: VII.—On some new compounds of salicyl. In: Q. J. Chem. Soc. 7, 1855, S. 60–62, doi:10.1039/QJ8550700060.
- H. Hlasiwetz, Hugo v. Gilm: Acetylderivate der Phloretin- und Salicylsäure. In: Annalen der Chemie und Pharmacie. 112, 1859, S. 180–182.
- K. Kraut: Ueber Salicylverbindungen. In: Annalen der Chemie und Pharmacie. 150, 1869, S. 1–20, und zwar S. 9 ff.
- Hugo Schiff: Ueber Anhydride der Salicylsäure. In: Annalen der Chemie und Pharmazie. Band 163, 1872, S. 218–228 (archive.org).
- M. Bialobrzeski, M. Nencki: Ueber die Acetsalicylsäure. In: Berichte der Deutschen Chemischen Gesellschaft. Jg. 30, Band 2. F. Friedländer, Berlin 1897, S. 1776–1779 (Digitalisat auf Gallica). – CAS-Nr. 13110-96-8 (Schmelzpunkt 215–216 °C).
- Patent US644077: Acetyl salicylic acid. Angemeldet am 1. August 1898, veröffentlicht am 27. Februar 1900, Anmelder: Farbenfabriken of Elberfeld Co., NY, Erfinder: Felix Hoffmann.
- Andreas Schuhmann, Bernhard Sorms: Geschichte des Arzneimittelwerkes Dresden. Hrsg.: AWD.pharma GmbH & Co. KG. Dresden 2002, S. 31 f.
- Diakoniekrankenhaus Halle von 1868 (Memento vom 18. November 2013 im Internet Archive)
- Ullmanns Enzyclopädie Band 1, S. 150. Beschreibung des Bayer-Verfahrens, vermutlich durch Eichengrün als Mitglied der Redaktion
- Patent DE386679C: Verfahren zur Darstellung von O-Acetylderivaten aromatischer Oxycarbonsäuren. Angemeldet am 7. April 1921, veröffentlicht am 14. Dezember 1923, Anmelder: Farbenfabriken vorm. Friedr. Bayer & Co, Erfinder: Rudolf Berendes, Wilhelm Grüttefien.
- Presseerklärung der Bayer AG, September 1999 (Memento vom 28. September 2007 im Internet Archive). Zitat aus Gelsenzentrum Der jüdische Chemiker Dr. Arthur Eichengrün – Pionier des Aspirin.
- F. von Bruchhausen, S. Ebel, A. W. Frahm, E. Hackenthal: Hagers Handbuch der Pharmazeutischen Praxis. Band 7: Stoffe A–D. 5. Auflage. Birkhäuser/Springer, 1991, ISBN 3-540-52688-9, S. 43–44.
- Bernd Schäfer: Naturstoffe in der chemischen Industrie. Spektrum Akademischer Verlag, 2007, ISBN 978-3-8274-1614-8, S. 277.
- Elisabeth Arkenau: Neue Arzneiformen für die Acetylsalicylsäure, Dissertation, Friedrich-Wilhelms-Universität Bonn, S. 32: Nebenprodukte der ASS-Synthesen
- Christina A. Gamba, Susan M. Swetter, Marcia L. Stefanick, Jessica Kubo, Manisha Desai, Katrina M. Spaunhurst, Animesh A. Sinha, Maryam M. Asgari, Susan Sturgeon, Jean Y. Tang: Aspirin is associated with lower melanoma risk among postmenopausal Caucasian women. In: Cancer. 2013, S. n/a–n/a, doi:10.1002/cncr.27817.
- J. R. Vane: Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. In: Nat. New Biol. 231, 1971, S. 232–235. PMID 5284360.
- Nobelpreis für Medizin oder Physiologie 1982: „Für ihre bahnbrechenden Arbeiten über Prostaglandine und nahe verwandter biologisch aktiver Substanzen.“ Informationen der Nobelstiftung zur Preisverleihung.
- W. Kozak u. a.: Molecular mechanisms of fever and endogenous antipyresis. In: Ann N Y Acad Sci. 917, 2000, S. 121–134. PMID 11268336.
- Fachinformation Aspirin® 100 mg-Tabletten. (Memento vom 29. April 2006 im Internet Archive) (PDF).
- T H Lee, P E Christie: Leukotrienes and aspirin induced asthma. In: Thorax. Band 48, Nr. 12, 1. Dezember 1993, S. 1189–1190, doi:10.1136/thx.48.12.1189, PMID 8303620, PMC 464963 (freier Volltext).
- Y. Kamisah, H. M. Qodriyah, K. H. Chua, M. F. Nur Azlina: Vitamin E: A potential therapy for gastric mucosal injury. In: Pharm Biol. 52(12), Dez 2014, S. 1591–1597. PMID 25026358
- M. I. Nafeeza, A. M. Fauzee, J. Kamsiah, M. T. Gapor: Comparative effects of a tocotrienol-rich fraction and tocopherol in aspirin-induced gastric lesions in rats. In: Asia Pac J Clin Nutr. 11(4), 2002, S. 309–313. PMID 12495264
- M. M. Wolfe u. a.: Gastrointestinal Toxicity of Nonsteroidal Antiinflammatory Drugs. In: N Engl J Med. 340, 1999, S. 1888–1899.
- P. M. Rothwell u. a.: Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials. In: Lancet. 2010 Dec 6. PMID 21144578
- A. May u. a.: Familienuntersuchung bei Patienten mit ASS-Intoleranz und Rhinosinusitis. In: HNO. 48/2000, S. 650–654.
- L. Welin, L. Wilhelmsen, A. Björnberg, A. Odén: Aspirin increases mortality in diabetic patients without cardiovascular disease: a Swedish record linkage study. In: Pharmacoepidemiol Drug Saf. 2009 August 11. PMID 19672841.
- M. B. Soyka, K. Rufibach, A. Huber, D. Holzmann: Is severe epistaxis associated with acetylsalicylic acid intake? In: The Laryngoscope. Band 120, Nr. 1, Januar 2010, S. 200–207, doi:10.1002/lary.20695, PMID 19877246.
- Aspirin kann offenbar die Netzhaut schädigen. Die Welt online.
- John J. McNeil, et al., for the ASPREE Investigator Group: Effect of Aspirin on All-Cause Mortality in the Healthy Elderly In: The New England Journal of Medicine, October 18, 2018, doi:10.1056/NEJMoa1803955.
- Sean L. Zheng, Alistair J. Roddick: Association of Aspirin Use for Primary Prevention With Cardiovascular Events and Bleeding Events. In: JAMA. 321, 2019, S. 277, doi:10.1001/jama.2018.20578.
- Helmut Gohlke: ASS gegen Herzinfarkt nur für bestimmte Menschen ratsam. Deutsche Herzstiftung, 10. März 2010, abgerufen am 10. September 2019.
- Thomas Voigtländer: ASS: Wegen möglicher Nebenwirkungen nicht dauerhaft einnehmen? Deutsche Herzstiftung, 1. November 2016, abgerufen am 10. September 2019.
- Co-medication and multimedication in users of acetylsalicylic acid and vitamin E in Germany. Special review. In: J. K. Aronson (Hrsg.): Side Effects of Drugs Annual. Band 26. Elsevier, Amsterdam / Boston / Heidelberg 2003 (eingeschränkte Vorschau in der Google-Buchsuche).
- Melchert HU, Knopf H, Pabel E, Braemer-Hauth M, Du Y: Co- and multimedication in users of ASA and vitamin E drugs in the Federal Republic of Germany. Results of the Federal Health Surveys 1984-1999., Int J Clin Pharmacol Ther. 2001 Nov;39(11):488-91, PMID 11727969
- S. Bancos, M. P. Bernard, D. J. Topham, R. P. Phipps: Ibuprofen and other widely used non-steroidal anti-inflammatory drugs inhibit antibody production in human cells. In: Cell Immunol. Band 258, Nr. 1, 2009, S. 18–28, PMID 19345936.
- V. A. Blaho u. a.: Cyclooxygenase-1 orchestrates germinal center formation and antibody class-switch via regulation of IL-17. In: J Immunol. Band 183, Nr. 9, 2009, S. 5644–5653, PMID 19843949.
- Roman Prymula u. a.: Effect of prophylactic paracetamol administration at time of vaccination on febrile reactions and antibody responses in children: two open-label, randomised controlled trials. In: The Lancet. Band 374, Nr. 9698, 2009, S. 1339–1350, PMID 19837254. soniped.org (Memento vom 14. November 2011 im Internet Archive) (PDF)
- Common Pain Relievers May Dilute Power of Flu Shots. University of Rochester Medical Center (URMC), abgerufen am 27. Juli 2011.
- Schmerzmittel schwächen Impfschutz. In: Spiegel Online. Abgerufen am 4. Dezember 2009.
- M. P. Bernard, R. P. Phipp: Inhibition of cyclooxygenase-2 impairs the expression of essential plasma cell transcription factors and human B-lymphocyte differentiation. In: Immunology. Band 129, Nr. 1, 2010, S. 87–96, PMID 20050331.
- Over-the-Counter Pain Drugs May Affect Vaccine Strength. WXXI, abgerufen am 27. Juli 2011.
- Impfeffekt kann durch manche Medikamente deutlich abgeschwächt werden. Lungenärzte im Netz, abgerufen am 4. Dezember 2009.
- Effect of Prophylactic Paracetamol Administration at Time of Vaccination on Febrile Reactions and Antibody Responses in Children F1000 Ranking: “Exceptional” and Changes Clinical Practice. Medscape, abgerufen am 26. Juli 2011.
- Hayreh SS: Ocular vascular occlusive disorders: natural history of visual outcome.. In: Prog Retin Eye Res. 41, 2014, S. 1-25. doi:10.1016/j.preteyeres.2014.04.001. PMID 24769221. PMC 4073304 (freier Volltext).
- Ageno W, Beyer-Westendorf J, Garcia DA, Lazo-Langner A, McBane RD, Paciaroni M: Guidance for the management of venous thrombosis in unusual sites.. In: J Thromb Thrombolysis. 41, Nr. 1, 2016, S. 129-43. doi:10.1007/s11239-015-1308-1. PMID 26780742. PMC 4715841 (freier Volltext).
- Colin W. O'Brien, Stephen P. Juraschek, Christina C. Wee: Prevalence of Aspirin Use for Primary Prevention of Cardiovascular Disease in the United States: Results From the 2017 National Health Interview Survey. In: Annals of Internal Medicine. 171, 2019, S. 596, doi:10.7326/M19-0953.
- Myokardinfarkt. Abgerufen am 17. März 2018.
- U. Zeymer, T. Hohlfeld, J. vom Dahl, R. Erbel, T. Münzel: Prospective, randomised trial of the time dependent antiplatelet effects of 500 mg and 250 mg acetylsalicylic acid i. v. and 300 mg p. o. in ACS (ACUTE). In: Thrombosis and Haemostasis. Band 117, Nr. 3, 2017, doi:10.1160/TH16-08-0650.
- Entscheidung der EU-Kommission vom 29. Juli 2004 über die Ausweisung des Arzneimittels „Acetylsalicylsäure“ als Arzneimittel für seltene Leiden gemäß Verordnung (EG) Nr. 141/2000 des Europäischen Parlaments und des Rates.
- Studie zur ASS-Resistenz auf neurologyreviews.com (Memento vom 21. November 2004 im Internet Archive).
- K. Schrör, H.-Ch. Diener: Sekundärprävention bei TIA und Schlaganfall – Clopidogrel oder ASS?. In: CARDIOVASC. 2/2001, S. 8.
- Patentanmeldung DE4415527A1: Flußmittel zum Weichlöten. Angemeldet am 3. Mai 1994, veröffentlicht am 9. November 1995, Erfinder: Tadeusz Tumalski.
- Blume: Aspirin und Paracetamol im chemischen Vergleich. Cornelsen-Verlag.
- K. Hohmann: Organisches Grundpraktikum. Versuch: Nachweis von Salicylsäure (PDF; 389 kB), Philipps-Universität Marburg, Script Wintersemester 2007/2008.
- Hermann Hager: Hagers Handbuch der Pharmazeutischen Praxis. 5. Auflage. Springer Verlag, 1994, ISBN 3-540-52688-9.
- H. Kallbacher: Chemisches Praktikum für Mediziner: Synthese eines Arzneimittels Acetylsalicylsäure (ASS, Aspirin). (PDF; 128 kB), Kurstag 8, Praktikumsscript der Eberhard-Karls-Universität Tübingen.
- F. v. Bruchhausen, H. Hager: Hagers Handbuch Der Pharmazeutischen Praxis. Band 2: Methoden. Springer-Verlag, 1994, ISBN 3-540-52688-9, S. 124.
- N. Ramos-Martos, F. Aguirre-Gómez, A. Molina-Díaz, L. F. Capitán-Vallvey: Application of liquid chromatography to the simultaneous determination of acetylsalicylic acid, caffeine, codeine, paracetamol, pyridoxine, and thiamine in pharmaceutical preparations. In: Journal of AOAC International. 2001, 84 (3), S. 676–683. PMID 11417630.
- J. T. Franeta, D. Agbaba, S. Eric, S. Pavkov, M. Aleksic, S. Vladimirov: HPLC assay of acetylsalicylic acid, paracetamol, caffeine and phenobarbital in tablets. In: Farmaco. 57 (9), 2002, S. 709–713. PMID 12385520.
- D. Tsikas, K. S. Tewes, F. M. Gutzki, E. Schwedhelm, J. Greipel, J. C. Frölich: Gas chromatographic-tandem mass spectrometric determination of acetylsalicylic acid in human plasma after oral administration of low-dose aspirin and guaimesal. In: J Chromatogr B Biomed Sci Appl. 709 (1), 1998, S. 79–88. PMID 9653928.
- H. U. Melchert, H. Knopf, E. Pabel, M. Braemer-Hauth, Y. Du: Co- and multimedication in users of ASA and vitamin E drugs in the Federal Republic of Germany. Results of the Federal Health Surveys 1984–1999. In: Int J Clin Pharmacol Ther. 39 (11), 2001, S. 488–491. PMID 11727969.